名校
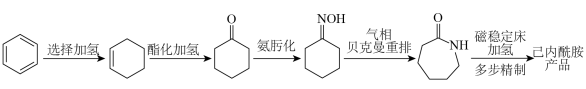
1 . 2023年12月具有完全知识产权、全球首套己内酰胺的绿色生产线正式在中国石化岳阳巴陵石化子公司投产。其生产流程如下:
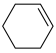
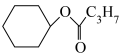
(1)已知:①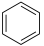
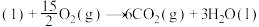
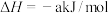
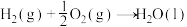

 的物质的量之比为1∶4,初始压强为5MPa的条件下,达平衡时,苯的转化率为20%,环己烷的选择性达90%,则反应②的
的物质的量之比为1∶4,初始压强为5MPa的条件下,达平衡时,苯的转化率为20%,环己烷的选择性达90%,则反应②的
___________ 。(填写计算式)
Ⅱ.苯选择加氢制环己烯是实现环己酮绿色合成新途径的关键,从热力学的角度来看极为不利,可选择更高效的催化剂,加快环己烯从催化剂的表面脱附,从而提高环己烯的选择性。采用的新型催化剂为:Ru-Zn纳米粒子@BZSS碱式复盐,通过调控BZSS滞水膜厚度进一步提高了环己烯选择性,使用该催化剂使苯的转化率达到70%以上,环己烯的选择性达到80%。已知:苯在水中的溶解度大于环己烯在水中的溶解度,新型负载型催化剂具有亲水性。
(3)请解释Ru-Zn纳米粒子@BZSS碱式复盐能提高环己烯选择性的原因(请从溶解性的角度解释):___________ 。
Ⅲ.中国石化环己酮氨肟化技术以微米级空心TS-1分子筛原粉为催化剂,并成功开发浆态床/膜分离组合新工艺,从而实现微米级催化剂的分离与连续循环使用。该环节中用蒽醌法生产过氧化氢的反应进程如下: 的分解温度为60℃,AQ的沸点377℃,AHQ的沸点390℃。
的分解温度为60℃,AQ的沸点377℃,AHQ的沸点390℃。
(4)有关该反应过程,说法不正确的是___________(填标号)。
(5)已知环己烯与羧酸发生加成反应的机理如下:
8S3SiIH催化的环烯烃与羧酸加成酯化反应结果
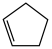
从表格中得出,环己烯与不同羧酸加成,其中与HCOOH反应的产率最高,最有可能的原因是___________ (从分子结构的角度解释)。而环己烯与环戊烯相比,在同样的催化剂条件下,相同温度下,环戊烯加成的产率更高的原因可能是___________ 。
(6)已知在标准状况下,AgCl的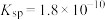 ,
, 的
的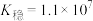 ,若把足量AgCl溶于10mol/L的氨水中,则形成的
,若把足量AgCl溶于10mol/L的氨水中,则形成的 的浓度为
的浓度为___________ mol/L(已知: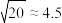 ,结果保留两位有效数字)。
,结果保留两位有效数字)。
(1)已知:①

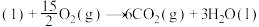
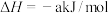
②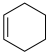
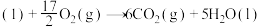
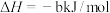
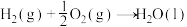

则:
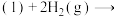

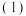

①
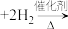
 、
、
②
 。
。
 的物质的量之比为1∶4,初始压强为5MPa的条件下,达平衡时,苯的转化率为20%,环己烷的选择性达90%,则反应②的
的物质的量之比为1∶4,初始压强为5MPa的条件下,达平衡时,苯的转化率为20%,环己烷的选择性达90%,则反应②的
Ⅱ.苯选择加氢制环己烯是实现环己酮绿色合成新途径的关键,从热力学的角度来看极为不利,可选择更高效的催化剂,加快环己烯从催化剂的表面脱附,从而提高环己烯的选择性。采用的新型催化剂为:Ru-Zn纳米粒子@BZSS碱式复盐,通过调控BZSS滞水膜厚度进一步提高了环己烯选择性,使用该催化剂使苯的转化率达到70%以上,环己烯的选择性达到80%。已知:苯在水中的溶解度大于环己烯在水中的溶解度,新型负载型催化剂具有亲水性。
(3)请解释Ru-Zn纳米粒子@BZSS碱式复盐能提高环己烯选择性的原因(请从溶解性的角度解释):
Ⅲ.中国石化环己酮氨肟化技术以微米级空心TS-1分子筛原粉为催化剂,并成功开发浆态床/膜分离组合新工艺,从而实现微米级催化剂的分离与连续循环使用。该环节中用蒽醌法生产过氧化氢的反应进程如下:
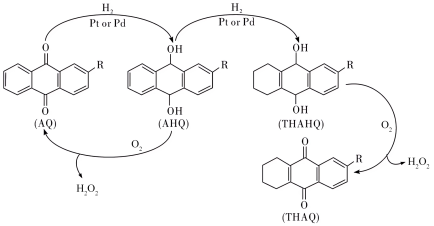
 的分解温度为60℃,AQ的沸点377℃,AHQ的沸点390℃。
的分解温度为60℃,AQ的沸点377℃,AHQ的沸点390℃。(4)有关该反应过程,说法不正确的是___________(填标号)。
A.从AQ到AHQ的反应中,发生变化的碳原子的杂化类型由 到 到 |
B.由THAHQ制备 的反应方程式为 的反应方程式为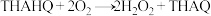 |
C.在AHQ的氧化过程中,生成的 和有机物AQ、AHQ的分离方法为蒸馏 和有机物AQ、AHQ的分离方法为蒸馏 |
| D.我国采用的浆态蒽醌氢化法,使用更高效的Pd基细颗粒催化剂,有利于提高催化的效率 |
(5)已知环己烯与羧酸发生加成反应的机理如下:

8S3SiIH催化的环烯烃与羧酸加成酯化反应结果
| 序号 | 羧酸 | 环烯烃 | 温度/℃ | 产物 | 产率/% |
| 1 | HCOOH |
| 95 |
| 90 |
| 2 |  |
| 110 |
| 82 |
| 3 |  |
| 120 |
| 62 |
| 4 | 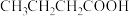 |
| 130 |
| 51 |
| 5 | HCOOH |
| 95 |
| 93 |
(6)已知在标准状况下,AgCl的
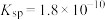 ,
, 的
的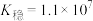 ,若把足量AgCl溶于10mol/L的氨水中,则形成的
,若把足量AgCl溶于10mol/L的氨水中,则形成的 的浓度为
的浓度为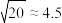 ,结果保留两位有效数字)。
,结果保留两位有效数字)。
您最近一年使用:0次
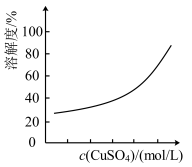
2 .  纳米晶体作钠离子电池正极材料。某科研团队以某矿石(主要成分是
纳米晶体作钠离子电池正极材料。某科研团队以某矿石(主要成分是 、
、 ,含少量CaS、
,含少量CaS、 等杂质)开发一种合成介孔
等杂质)开发一种合成介孔 的路线如图所示:
的路线如图所示:
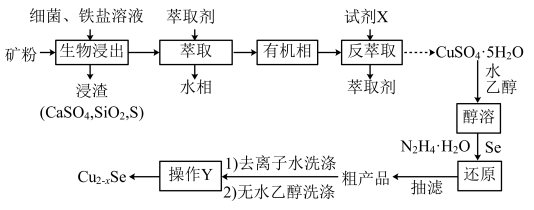
已知:有机相中 溶解度与
溶解度与 浓度的关系如图所示;萃取剂密度为0.86
浓度的关系如图所示;萃取剂密度为0.86 。
。
回答下列问题:
(1)纯净物试剂X是_______ (填名称)。
(2) 和硫酸铁溶液反应的离子方程式为
和硫酸铁溶液反应的离子方程式为_______ 。
(3)使用物理方法从浸渣中提取硫黄的操作包括溶于 、
、_______ 、蒸馏(简述操作名称即可)。萃取和反萃取都需要使用的仪器有_______ (填字母)。
A. B.
B. C.
C. D.
D.
(4)获取“去离子水”的方法是将含 、
、 、
、 、
、 、
、 、
、 等离子的自来水,依次通过阳离子交换树脂生成
等离子的自来水,依次通过阳离子交换树脂生成 、阴离子交换树脂生成
、阴离子交换树脂生成 ,最终得到去离子水。如果先通过阴离子交换树脂,会产生的沉淀有
,最终得到去离子水。如果先通过阴离子交换树脂,会产生的沉淀有_______ 。
(5)“生物浸出”中金属浸出率与温度关系如图。简述温度高于a点,浸出率降低的可能原因是_______ (答一条即可)。

(6) 是一种钠离子电池正极材料,充放电过程中正极材料立方晶胞(示意图)的组成变化如图所示,晶胞内未标出因放电产生的0价Cu原子。
是一种钠离子电池正极材料,充放电过程中正极材料立方晶胞(示意图)的组成变化如图所示,晶胞内未标出因放电产生的0价Cu原子。
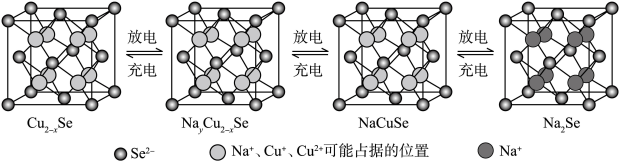
1mol 晶胞含
晶胞含_______ mol  。放电时,若正极上
。放电时,若正极上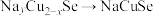 ,则该正极反应为
,则该正极反应为_______ 。
 纳米晶体作钠离子电池正极材料。某科研团队以某矿石(主要成分是
纳米晶体作钠离子电池正极材料。某科研团队以某矿石(主要成分是 、
、 ,含少量CaS、
,含少量CaS、 等杂质)开发一种合成介孔
等杂质)开发一种合成介孔 的路线如图所示:
的路线如图所示:
已知:有机相中
 溶解度与
溶解度与 浓度的关系如图所示;萃取剂密度为0.86
浓度的关系如图所示;萃取剂密度为0.86 。
。
回答下列问题:
(1)纯净物试剂X是
(2)
 和硫酸铁溶液反应的离子方程式为
和硫酸铁溶液反应的离子方程式为(3)使用物理方法从浸渣中提取硫黄的操作包括溶于
 、
、A.
 B.
B. C.
C. D.
D.
(4)获取“去离子水”的方法是将含
 、
、 、
、 、
、 、
、 、
、 等离子的自来水,依次通过阳离子交换树脂生成
等离子的自来水,依次通过阳离子交换树脂生成 、阴离子交换树脂生成
、阴离子交换树脂生成 ,最终得到去离子水。如果先通过阴离子交换树脂,会产生的沉淀有
,最终得到去离子水。如果先通过阴离子交换树脂,会产生的沉淀有(5)“生物浸出”中金属浸出率与温度关系如图。简述温度高于a点,浸出率降低的可能原因是

(6)
 是一种钠离子电池正极材料,充放电过程中正极材料立方晶胞(示意图)的组成变化如图所示,晶胞内未标出因放电产生的0价Cu原子。
是一种钠离子电池正极材料,充放电过程中正极材料立方晶胞(示意图)的组成变化如图所示,晶胞内未标出因放电产生的0价Cu原子。
1mol
 晶胞含
晶胞含 。放电时,若正极上
。放电时,若正极上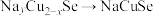 ,则该正极反应为
,则该正极反应为
您最近一年使用:0次
名校
3 . 亚硫酰氯( )和硫酰氯(
)和硫酰氯( )都是重要的化工原料,均易水解
)都是重要的化工原料,均易水解
I.亚硫酰氯( )又名氯化亚钒,熔点为-105℃,沸点为77℃,遇水剧烈反应,产生大量白雾,并生成刺激性气味的气体。
)又名氯化亚钒,熔点为-105℃,沸点为77℃,遇水剧烈反应,产生大量白雾,并生成刺激性气味的气体。
(1)用硫磺、液氯和 为原料,在一定条件下合成
为原料,在一定条件下合成 ,原子利用率可达100%,则三者的物质的量之比为
,原子利用率可达100%,则三者的物质的量之比为_______ 。
(2) 水解后无残留物,是较好的脱水剂。某同学设计实验将
水解后无残留物,是较好的脱水剂。某同学设计实验将 和
和 混合物加热来制取无水
混合物加热来制取无水 。
。
① 在该实验中作脱水剂的作用是
在该实验中作脱水剂的作用是_______ (写出两点)。
②实验室常用NaOH溶液吸收 ,该反应的离子方程式是
,该反应的离子方程式是_______ 。
II.硫酰氯( )的熔点为-54.1℃,沸点为69.1℃,在空气中遇水蒸气发生剧烈反应,并产生大量白雾,100℃以上分解生成
)的熔点为-54.1℃,沸点为69.1℃,在空气中遇水蒸气发生剧烈反应,并产生大量白雾,100℃以上分解生成 和
和 ,实验室合成
,实验室合成 的原理:
的原理:
 ,实验装置如图所示(部分夹持装置略去),请回答下列问题:
,实验装置如图所示(部分夹持装置略去),请回答下列问题:

(3)A、B干燥管中盛有的物质可以分别是下列_______(填标号)。
(4)去除丙装置可能会发生的副反应是_______ (用化学方程式表示)。
(5)为了测定 产品纯度(杂质不参与反应),称取m g
产品纯度(杂质不参与反应),称取m g  产品于锥形瓶中,加入足量蒸馏水,充分反应。滴加几滴指示剂,用c
产品于锥形瓶中,加入足量蒸馏水,充分反应。滴加几滴指示剂,用c 
 溶液滴定反应后的溶液中
溶液滴定反应后的溶液中 的含量,终点时消耗
的含量,终点时消耗 溶液的平均体积为V mL。已知:
溶液的平均体积为V mL。已知:
①根据上表中各种物质的 ,该实验应选择的指示剂为
,该实验应选择的指示剂为_______ (从下列选项中选择,填标号),滴定终点的现象是_______ 。
A. B.
B. C.
C. D.KBr
D.KBr
②该 产品的纯度为
产品的纯度为_______ %。
 )和硫酰氯(
)和硫酰氯( )都是重要的化工原料,均易水解
)都是重要的化工原料,均易水解I.亚硫酰氯(
 )又名氯化亚钒,熔点为-105℃,沸点为77℃,遇水剧烈反应,产生大量白雾,并生成刺激性气味的气体。
)又名氯化亚钒,熔点为-105℃,沸点为77℃,遇水剧烈反应,产生大量白雾,并生成刺激性气味的气体。(1)用硫磺、液氯和
 为原料,在一定条件下合成
为原料,在一定条件下合成 ,原子利用率可达100%,则三者的物质的量之比为
,原子利用率可达100%,则三者的物质的量之比为(2)
 水解后无残留物,是较好的脱水剂。某同学设计实验将
水解后无残留物,是较好的脱水剂。某同学设计实验将 和
和 混合物加热来制取无水
混合物加热来制取无水 。
。①
 在该实验中作脱水剂的作用是
在该实验中作脱水剂的作用是②实验室常用NaOH溶液吸收
 ,该反应的离子方程式是
,该反应的离子方程式是II.硫酰氯(
 )的熔点为-54.1℃,沸点为69.1℃,在空气中遇水蒸气发生剧烈反应,并产生大量白雾,100℃以上分解生成
)的熔点为-54.1℃,沸点为69.1℃,在空气中遇水蒸气发生剧烈反应,并产生大量白雾,100℃以上分解生成 和
和 ,实验室合成
,实验室合成 的原理:
的原理:
 ,实验装置如图所示(部分夹持装置略去),请回答下列问题:
,实验装置如图所示(部分夹持装置略去),请回答下列问题:
(3)A、B干燥管中盛有的物质可以分别是下列_______(填标号)。
| A.碱石灰、浓硫酸 | B.氯化钙、碱石灰 | C.碱石灰、五氧化二磷 | D.碱石灰、碱石灰 |
(5)为了测定
 产品纯度(杂质不参与反应),称取m g
产品纯度(杂质不参与反应),称取m g  产品于锥形瓶中,加入足量蒸馏水,充分反应。滴加几滴指示剂,用c
产品于锥形瓶中,加入足量蒸馏水,充分反应。滴加几滴指示剂,用c 
 溶液滴定反应后的溶液中
溶液滴定反应后的溶液中 的含量,终点时消耗
的含量,终点时消耗 溶液的平均体积为V mL。已知:
溶液的平均体积为V mL。已知:| 物质 |  | AgCl |  |  | AgBr |
 | 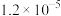 |  |  | 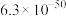 |  |
| 颜色 | 白色 | 白色 | 砖红色 | 黑色 | 浅黄色 |
 ,该实验应选择的指示剂为
,该实验应选择的指示剂为A.
 B.
B. C.
C. D.KBr
D.KBr②该
 产品的纯度为
产品的纯度为
您最近一年使用:0次
2022-11-08更新
|
492次组卷
|
3卷引用:湖南省长沙市长郡中学2022-2023学年高三第三次月考化学试题
4 . 碲是一种重要的战略稀缺元素,被誉为“现代工业的维生素”,是制造光电、半导体、制冷等元件不可缺少的关键材料。有色金属冶炼厂以电解精炼铜的阳极泥为原料,设计了如图新工艺提取、回收并制备高纯碲:
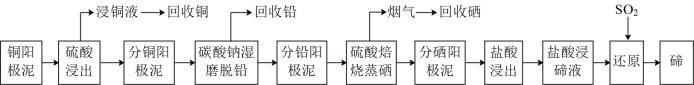
[25℃时,PbSO4和PbCO3的Ksp分别为1.6×10-5(mol·L-1)2、7.4×10-14(mol·L-1)2]
(1)写出冶炼厂电解精炼铜的阴极电极反应式:___ 。
(2)分铜阳极泥(含PbSO4)与Na2CO3混合“湿法球磨”,PbSO4可转化为PbCO3,此反应的化学方程式为___ 。若在1LPbSO4饱和溶液中加入10.6gNa2CO3固体(溶液体积变化忽略不计),则此时溶液中SO 的物质的量浓度为
的物质的量浓度为___ mol/L。
(3)分铅阳极泥经硫酸化焙烧蒸硒,产生的烟气中含SeO2与SO2,烟气在低温区用水吸收可回收硒,此过程中氧化产物和还原产物的物质的量之比为___ 。
(4)分硒阳极泥盐酸浸出液中Te4+用SO2还原可以得到单质碲,发生反应的方程式为:SO2+H2O=H2SO3,___ 。研究表明,Cl-离子浓度为0.1mol·L-1时的活化能比Cl-离子浓度为0.3mol·L-1时的活化能大,说明较高浓度Cl-可作该反应的__ 。
(5)整个工艺路线中可以循环利用的物质有(填化学式)___ 、__ 。

[25℃时,PbSO4和PbCO3的Ksp分别为1.6×10-5(mol·L-1)2、7.4×10-14(mol·L-1)2]
(1)写出冶炼厂电解精炼铜的阴极电极反应式:
(2)分铜阳极泥(含PbSO4)与Na2CO3混合“湿法球磨”,PbSO4可转化为PbCO3,此反应的化学方程式为
 的物质的量浓度为
的物质的量浓度为(3)分铅阳极泥经硫酸化焙烧蒸硒,产生的烟气中含SeO2与SO2,烟气在低温区用水吸收可回收硒,此过程中氧化产物和还原产物的物质的量之比为
(4)分硒阳极泥盐酸浸出液中Te4+用SO2还原可以得到单质碲,发生反应的方程式为:SO2+H2O=H2SO3,
(5)整个工艺路线中可以循环利用的物质有(填化学式)
您最近一年使用:0次
名校
解题方法
5 . 新能源汽车工业飞速发展依赖于锂离子电池的新型电极材料的研究取得的重大成果。 可以实现海水中
可以实现海水中 的富集,对锂离子电池的研究作出重要贡献。以软锰矿(含
的富集,对锂离子电池的研究作出重要贡献。以软锰矿(含 及少量
及少量 和
和 )为原料生产高纯
)为原料生产高纯 的工艺流程如图甲。
的工艺流程如图甲。
(1)“浸锰”时, 生成
生成 的离子方程式为
的离子方程式为___________ 。
(2)步骤Ⅱ中, 的萃取率与
的萃取率与 的关系如图乙,当
的关系如图乙,当 后,随
后,随 增大,
增大, 萃取率下降的原因是
萃取率下降的原因是___________ 。 ,若
,若 ,常温下调节
,常温下调节 范围应为
范围应为___________ {已知该条件下,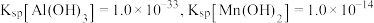 }。
}。
(4)海水中锂的总含量为陆地总含量的5000倍以上,但海水中锂的质量浓度仅为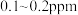 ,从海水中提取锂首先需要对低浓度的
,从海水中提取锂首先需要对低浓度的 进行选择性富集,而
进行选择性富集,而 能够嵌入高纯
能够嵌入高纯 并在一定条件下脱出,据此可以进行
并在一定条件下脱出,据此可以进行 的富集。
的富集。
①以 和高纯
和高纯 为原料,充分混合后在720℃下煅烧
为原料,充分混合后在720℃下煅烧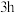 ,冷却至室温后即可得到复合氧化物
,冷却至室温后即可得到复合氧化物 。用
。用 的盐酸在60℃下处理
的盐酸在60℃下处理 ,将其中所有
,将其中所有 置换后得到
置换后得到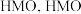 可以和
可以和 反应再生成
反应再生成 ,然后
,然后 与酸作用脱出
与酸作用脱出 从而实现
从而实现 的富集。如此循环处理。合成
的富集。如此循环处理。合成 的化学方程式为
的化学方程式为___________ ;
②用酸处理 时,除离子交换反应之外,也会发生一个副反应,该副反应导致固体中M的平均化合价有所提高,则副反应的生成物中含
时,除离子交换反应之外,也会发生一个副反应,该副反应导致固体中M的平均化合价有所提高,则副反应的生成物中含 元素的微粒是
元素的微粒是___________ 。这一副反应对再生后的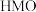 的锂富集性能的影响是
的锂富集性能的影响是___________ 。
(5)利用高纯 实施电化学富集锂是行之有效的方法。电化学系统(如图丙所示)的工作步骤如下:
实施电化学富集锂是行之有效的方法。电化学系统(如图丙所示)的工作步骤如下:
步骤1:向 所在的腔室通入海水,启动电源1,使海水中的
所在的腔室通入海水,启动电源1,使海水中的 进入
进入 结构而形成
结构而形成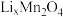 ;
;
步骤2:关闭电源1和海水通道,启动电源2,同时向电极2上通入空气,使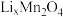 中的
中的 脱出进入腔室2。
脱出进入腔室2。 对
对 的富集效果,将
的富集效果,将 的
的 溶液通入
溶液通入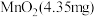 所在腔室,启动电源1,使电流恒定在
所在腔室,启动电源1,使电流恒定在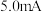 ,累计工作
,累计工作 后发现
后发现 的电极电势快速下降,则
的电极电势快速下降,则 中的
中的
___________ (已知 电子的电量为
电子的电量为 。电流效率为
。电流效率为 )。
)。
②电源2工作时, 电极上发生的电极反应为
电极上发生的电极反应为___________ 。
 可以实现海水中
可以实现海水中 的富集,对锂离子电池的研究作出重要贡献。以软锰矿(含
的富集,对锂离子电池的研究作出重要贡献。以软锰矿(含 及少量
及少量 和
和 )为原料生产高纯
)为原料生产高纯 的工艺流程如图甲。
的工艺流程如图甲。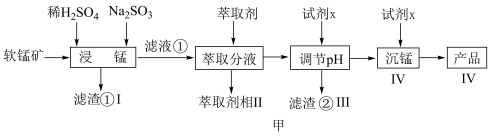
(1)“浸锰”时,
 生成
生成 的离子方程式为
的离子方程式为(2)步骤Ⅱ中,
 的萃取率与
的萃取率与 的关系如图乙,当
的关系如图乙,当 后,随
后,随 增大,
增大, 萃取率下降的原因是
萃取率下降的原因是
 ,若
,若 ,常温下调节
,常温下调节 范围应为
范围应为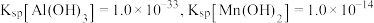 }。
}。(4)海水中锂的总含量为陆地总含量的5000倍以上,但海水中锂的质量浓度仅为
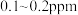 ,从海水中提取锂首先需要对低浓度的
,从海水中提取锂首先需要对低浓度的 进行选择性富集,而
进行选择性富集,而 能够嵌入高纯
能够嵌入高纯 并在一定条件下脱出,据此可以进行
并在一定条件下脱出,据此可以进行 的富集。
的富集。①以
 和高纯
和高纯 为原料,充分混合后在720℃下煅烧
为原料,充分混合后在720℃下煅烧 ,冷却至室温后即可得到复合氧化物
,冷却至室温后即可得到复合氧化物 。用
。用 的盐酸在60℃下处理
的盐酸在60℃下处理 ,将其中所有
,将其中所有 置换后得到
置换后得到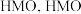 可以和
可以和 反应再生成
反应再生成 ,然后
,然后 与酸作用脱出
与酸作用脱出 从而实现
从而实现 的富集。如此循环处理。合成
的富集。如此循环处理。合成 的化学方程式为
的化学方程式为②用酸处理
 时,除离子交换反应之外,也会发生一个副反应,该副反应导致固体中M的平均化合价有所提高,则副反应的生成物中含
时,除离子交换反应之外,也会发生一个副反应,该副反应导致固体中M的平均化合价有所提高,则副反应的生成物中含 元素的微粒是
元素的微粒是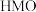 的锂富集性能的影响是
的锂富集性能的影响是(5)利用高纯
 实施电化学富集锂是行之有效的方法。电化学系统(如图丙所示)的工作步骤如下:
实施电化学富集锂是行之有效的方法。电化学系统(如图丙所示)的工作步骤如下:步骤1:向
 所在的腔室通入海水,启动电源1,使海水中的
所在的腔室通入海水,启动电源1,使海水中的 进入
进入 结构而形成
结构而形成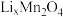 ;
;步骤2:关闭电源1和海水通道,启动电源2,同时向电极2上通入空气,使
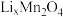 中的
中的 脱出进入腔室2。
脱出进入腔室2。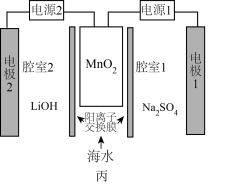
 对
对 的富集效果,将
的富集效果,将 的
的 溶液通入
溶液通入 所在腔室,启动电源1,使电流恒定在
所在腔室,启动电源1,使电流恒定在 ,累计工作
,累计工作 后发现
后发现 的电极电势快速下降,则
的电极电势快速下降,则 中的
中的
 电子的电量为
电子的电量为 。电流效率为
。电流效率为 )。
)。②电源2工作时,
 电极上发生的电极反应为
电极上发生的电极反应为
您最近一年使用:0次
2024-05-14更新
|
165次组卷
|
2卷引用:湖南省长沙市一中2024届高三下学期高考适应性演练(三)化学试题
6 . 碳酸锰可用作脱硫的催化剂,是合成二氧化锰和制造其他锰盐的原料。工业上从锰泥(主要含 和少量
和少量 、
、 、
、 等)中回收
等)中回收 的流程如图所示:
的流程如图所示:

回答下列问题:
(1)滤渣1中的主要成分为 ,其中Pb元素的化合价是
,其中Pb元素的化合价是__________ 。
(2) 能将
能将 还原为
还原为 ,写出该反应的离子方程式:
,写出该反应的离子方程式:__________ 。为检验 是否被氧化,可往滤液1中加入
是否被氧化,可往滤液1中加入__________ 溶液(填化学式)。
(3)常温下,已知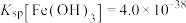 ,通入
,通入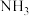 调
调 时,溶液中
时,溶液中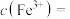
__________ 。
(4)写出加入氨水和过量 生成
生成 沉淀的离子方程式:
沉淀的离子方程式:__________ 。
(5)处理锰泥时, 、
、 混合溶液中
混合溶液中 比值不宜过大,请从节约药品的角度分析,原因是
比值不宜过大,请从节约药品的角度分析,原因是__________ 。
 和少量
和少量 、
、 、
、 等)中回收
等)中回收 的流程如图所示:
的流程如图所示:
回答下列问题:
(1)滤渣1中的主要成分为
 ,其中Pb元素的化合价是
,其中Pb元素的化合价是(2)
 能将
能将 还原为
还原为 ,写出该反应的离子方程式:
,写出该反应的离子方程式: 是否被氧化,可往滤液1中加入
是否被氧化,可往滤液1中加入(3)常温下,已知
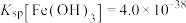 ,通入
,通入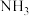 调
调 时,溶液中
时,溶液中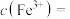
(4)写出加入氨水和过量
 生成
生成 沉淀的离子方程式:
沉淀的离子方程式:(5)处理锰泥时,
 、
、 混合溶液中
混合溶液中 比值不宜过大,请从节约药品的角度分析,原因是
比值不宜过大,请从节约药品的角度分析,原因是
您最近一年使用:0次
解题方法
7 . 亚硝酰氯(NOCl)为红褐色液体或黄色气体,其熔点为-64.5℃,沸点为-5.5℃,具有刺鼻恶臭味,遇水剧烈水解,易溶于浓硫酸。常可用于合成清洁剂、触媒剂及中间体等。实验室可由氯气与一氧化氮在常温、常压下合成。其制备装置如图所示。

(1)①用图甲中装置制备纯净干燥的原料气,试写出该装置制备氯气的离子方程式:_______ 。
②其中导管A的作用是_______ 。
(2)将制得的NO和Cl2通入图乙对应装置制备NOCl。
①装置连接顺序为a→_______ (按气流自左向右方向,用小写字母表示)。
②装置Ⅶ装无水CaCl2的仪器名称是_______ 。
③装置Ⅳ、Ⅴ的相同作用是(写两点)________ 、________ 。
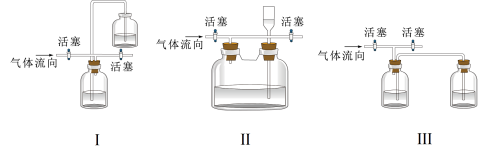
(3)实验开始时,先通入氯气,再通入NO,原因是________ 。
(4)有同学认为多余的氯气可以通过下列装置暂时储存然后再利用,下列可以用作氯气的储气装置的是________ (填序号)。
(5)制得的NOCl中可能含有少量N2O4杂质,为测定产品纯度进行如下实验:称取8.600g样品溶于NaOH配制成500.00mL溶液,用移液管取25.00mL溶液,加入几滴K2CrO4溶液作指示剂,用足量硝酸酸化的0.020mol/LAgNO3溶液进行滴定,消耗AgNO3溶液25.00mL。
已知:AgCl为白色沉淀溶解度1.34×10-6mol/L,Ksp(AgCl)=1.8×10-10;Ag2CrO4为砖红色沉淀溶解度6.5×10-5mol/L,Ksp(Ag2CrO4)=1.2×10-12。
①滴定终点的现象是________ 。
②样品的纯度为________ %(保留1位小数)。

(1)①用图甲中装置制备纯净干燥的原料气,试写出该装置制备氯气的离子方程式:
②其中导管A的作用是
(2)将制得的NO和Cl2通入图乙对应装置制备NOCl。
①装置连接顺序为a→
②装置Ⅶ装无水CaCl2的仪器名称是
③装置Ⅳ、Ⅴ的相同作用是(写两点)
(3)实验开始时,先通入氯气,再通入NO,原因是
(4)有同学认为多余的氯气可以通过下列装置暂时储存然后再利用,下列可以用作氯气的储气装置的是

(5)制得的NOCl中可能含有少量N2O4杂质,为测定产品纯度进行如下实验:称取8.600g样品溶于NaOH配制成500.00mL溶液,用移液管取25.00mL溶液,加入几滴K2CrO4溶液作指示剂,用足量硝酸酸化的0.020mol/LAgNO3溶液进行滴定,消耗AgNO3溶液25.00mL。
已知:AgCl为白色沉淀溶解度1.34×10-6mol/L,Ksp(AgCl)=1.8×10-10;Ag2CrO4为砖红色沉淀溶解度6.5×10-5mol/L,Ksp(Ag2CrO4)=1.2×10-12。
①滴定终点的现象是
②样品的纯度为
您最近一年使用:0次
8 . 一种废镍催化剂中含有Ni、Al、Cr、Cu、FeS及碳粉,以其为原料制备环烷酸镍[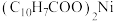 ,常温下为难溶于水的液体]的工艺流程如图所示:
,常温下为难溶于水的液体]的工艺流程如图所示:
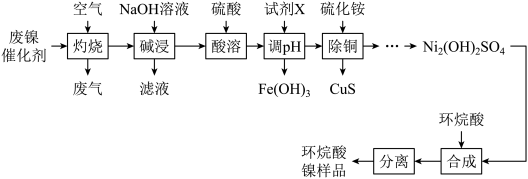
该工艺条件下,溶液中金属离子开始沉淀和完全沉淀的pH如表所示:
回答下列问题:
(1)“灼烧”后Cr转化为 ,已知
,已知 与
与 性质相似,则滤液中阴离子有
性质相似,则滤液中阴离子有 、
、___________ 。基态Cr原子的价层电子排布式为___________ 。
(2)“酸溶”时,先加入一定量的水,然后分次加入浓硫酸,与直接用稀硫酸溶解相比,其优点是___________ 。
(3)“调pH”时,溶液pH的范围为___________ 。
(4)常温下,CuS的 极小,用
极小,用 可将
可将 完全沉淀。CuS晶胞中
完全沉淀。CuS晶胞中 的位置如图1所示,
的位置如图1所示, 位于
位于 所构成的四面体中心,晶胞侧视图如图2所示。
所构成的四面体中心,晶胞侧视图如图2所示。
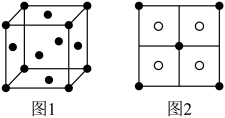
①与 距离最近的
距离最近的 数目为
数目为___________ 。
②CuS的晶胞参数为apm,阿伏加德罗常数的值为 ,则CuS晶体的密度为
,则CuS晶体的密度为___________  。
。
(5)环烷酸的化学式为 ,写出“合成”反应的化学方程式:
,写出“合成”反应的化学方程式:___________ 。
 ,常温下为难溶于水的液体]的工艺流程如图所示:
,常温下为难溶于水的液体]的工艺流程如图所示:
该工艺条件下,溶液中金属离子开始沉淀和完全沉淀的pH如表所示:
| 金属离子 |  |  |  |  |
| 开始沉淀的pH | 1.9 | 7.0 | 6.4 | 5.4 |
| 完全沉淀的pH | 3.2 | 9.0 | 8.4 | 6.7 |
(1)“灼烧”后Cr转化为
 ,已知
,已知 与
与 性质相似,则滤液中阴离子有
性质相似,则滤液中阴离子有 、
、(2)“酸溶”时,先加入一定量的水,然后分次加入浓硫酸,与直接用稀硫酸溶解相比,其优点是
(3)“调pH”时,溶液pH的范围为
(4)常温下,CuS的
 极小,用
极小,用 可将
可将 完全沉淀。CuS晶胞中
完全沉淀。CuS晶胞中 的位置如图1所示,
的位置如图1所示, 位于
位于 所构成的四面体中心,晶胞侧视图如图2所示。
所构成的四面体中心,晶胞侧视图如图2所示。
①与
 距离最近的
距离最近的 数目为
数目为②CuS的晶胞参数为apm,阿伏加德罗常数的值为
 ,则CuS晶体的密度为
,则CuS晶体的密度为 。
。(5)环烷酸的化学式为
 ,写出“合成”反应的化学方程式:
,写出“合成”反应的化学方程式:
您最近一年使用:0次
2023-10-16更新
|
241次组卷
|
2卷引用:湖南省长沙市第一中学2023-2024学年高三上学期月考卷(三)化学试题
9 . 铬是人体必需的微量元素,其在肌体的糖代谢和脂代谢中发挥着特殊作用,铬缺乏会造成葡萄糖耐量受损,可能伴随高血糖、尿糖等。而在工业中铬及其化合物在无机合成和有机合成中均有着重要作用。
Ⅰ.工业上以铬铁矿 为原料生产铬酸钠
为原料生产铬酸钠 ,实际操作是将铬铁矿和纯碱置于坩埚中,在空气中加热,得到
,实际操作是将铬铁矿和纯碱置于坩埚中,在空气中加热,得到 。
。
Ⅱ.市售的 为深绿色晶体,实验室中可用甲醇在酸性条件下还原
为深绿色晶体,实验室中可用甲醇在酸性条件下还原 制备
制备 (装置如图A所示):
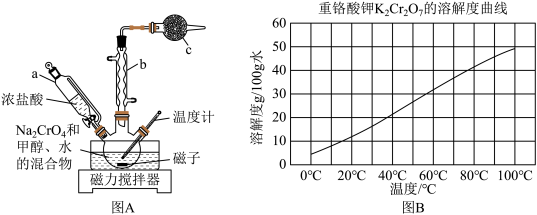
(装置如图A所示):
①将一定量铬酸钠、甲醇与水的混合物加入三颈烧瓶中;②升温至120℃时,缓慢滴加足量浓盐酸,保持100℃反应3h;③冷却,用NaOH溶液调节pH为6.5~7.5,得到 沉淀;④洗净
沉淀;④洗净 沉淀后,加入过量盐酸溶解,通过结晶法得到
沉淀后,加入过量盐酸溶解,通过结晶法得到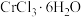 晶体。
晶体。
已知: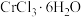 易溶于水、乙醇,易水解。
易溶于水、乙醇,易水解。
Ⅲ.重铬酸钾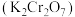 俗称红矾,是一种重要的化工产品,可向
俗称红矾,是一种重要的化工产品,可向 溶液中加酸,使
溶液中加酸,使 转化为
转化为 ,再向
,再向 溶液中加入KCl,升高温度,经过一系列操作后可获得
溶液中加入KCl,升高温度,经过一系列操作后可获得 晶体。已知
晶体。已知 的溶解度随温度变化的曲线如图B所示。
的溶解度随温度变化的曲线如图B所示。
回答下列问题:
(1)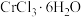 是配位化合物,由于内界配体不同而有不同的颜色,呈深绿色的晶体为
是配位化合物,由于内界配体不同而有不同的颜色,呈深绿色的晶体为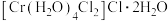 ,该配合物的配体为
,该配合物的配体为___________ 、___________ (填化学式)。
(2)在Ⅱ中制备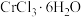 晶体时,步骤④中“加入过量盐酸”的目的是
晶体时,步骤④中“加入过量盐酸”的目的是___________ 。
(3)装置图A中,仪器c的名称为___________ ,仪器b的作用是___________ 。
(4)已知步骤Ⅱ中有 产生,则三颈烧瓶中甲醇还原铬酸钠的离子方程式为
产生,则三颈烧瓶中甲醇还原铬酸钠的离子方程式为___________ 。
(5)往 溶液中加入KCl,升高温度能获得
溶液中加入KCl,升高温度能获得 。获得晶体的一系列操作包括:趁热过滤、
。获得晶体的一系列操作包括:趁热过滤、___________ 、过滤、洗涤、干燥。其中“洗涤”步骤选用的洗涤剂为丙酮,其原因是___________ 。
Ⅰ.工业上以铬铁矿
 为原料生产铬酸钠
为原料生产铬酸钠 ,实际操作是将铬铁矿和纯碱置于坩埚中,在空气中加热,得到
,实际操作是将铬铁矿和纯碱置于坩埚中,在空气中加热,得到 。
。Ⅱ.市售的
 为深绿色晶体,实验室中可用甲醇在酸性条件下还原
为深绿色晶体,实验室中可用甲醇在酸性条件下还原 制备
制备 (装置如图A所示):
(装置如图A所示):
①将一定量铬酸钠、甲醇与水的混合物加入三颈烧瓶中;②升温至120℃时,缓慢滴加足量浓盐酸,保持100℃反应3h;③冷却,用NaOH溶液调节pH为6.5~7.5,得到
 沉淀;④洗净
沉淀;④洗净 沉淀后,加入过量盐酸溶解,通过结晶法得到
沉淀后,加入过量盐酸溶解,通过结晶法得到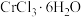 晶体。
晶体。已知:
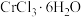 易溶于水、乙醇,易水解。
易溶于水、乙醇,易水解。Ⅲ.重铬酸钾
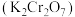 俗称红矾,是一种重要的化工产品,可向
俗称红矾,是一种重要的化工产品,可向 溶液中加酸,使
溶液中加酸,使 转化为
转化为 ,再向
,再向 溶液中加入KCl,升高温度,经过一系列操作后可获得
溶液中加入KCl,升高温度,经过一系列操作后可获得 晶体。已知
晶体。已知 的溶解度随温度变化的曲线如图B所示。
的溶解度随温度变化的曲线如图B所示。回答下列问题:
(1)
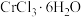 是配位化合物,由于内界配体不同而有不同的颜色,呈深绿色的晶体为
是配位化合物,由于内界配体不同而有不同的颜色,呈深绿色的晶体为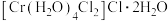 ,该配合物的配体为
,该配合物的配体为(2)在Ⅱ中制备
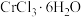 晶体时,步骤④中“加入过量盐酸”的目的是
晶体时,步骤④中“加入过量盐酸”的目的是(3)装置图A中,仪器c的名称为
(4)已知步骤Ⅱ中有
 产生,则三颈烧瓶中甲醇还原铬酸钠的离子方程式为
产生,则三颈烧瓶中甲醇还原铬酸钠的离子方程式为(5)往
 溶液中加入KCl,升高温度能获得
溶液中加入KCl,升高温度能获得 。获得晶体的一系列操作包括:趁热过滤、
。获得晶体的一系列操作包括:趁热过滤、
您最近一年使用:0次
名校
10 . Ni(OH)2作为合成镍钴锰三元电极材料的原料,工业上可用红土镍矿(主要成分为NiO、FeO、Fe2O3、MgO和SiO2)制备,工艺流程如图所示。
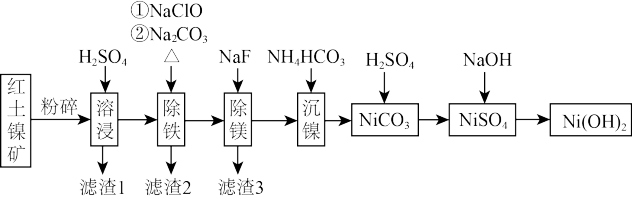
下列说法正确的是

下列说法正确的是
| A.“溶浸”时,为加快反应速率,可以选用98%的浓硫酸 |
| B.“滤渣1”的成分为H2SiO3 |
| C.为了证明加入NaClO已足量,可在溶液中加入KSCN溶液和氯水来检验 |
D.“沉镍”的离子方程式为:Ni2++2 HCO =NiCO3↓+CO2↑+H2O =NiCO3↓+CO2↑+H2O |
您最近一年使用:0次
2021-11-04更新
|
318次组卷
|
2卷引用:湖南省长沙市第一中学2021-2022学年高三上学期月考化学试题