解题方法
1 . (1)工业上可以用CO和H2为原料来合成甲醇,该反应的热化学方程式为:CO(g)+2H2(g) CH3OH(g) △H1=-116 kJ·mol-1。
CH3OH(g) △H1=-116 kJ·mol-1。
①下列措施中有利于提高CO平衡转化率的是___________ 。
A.随时将CH3OH与反应混合物分离 B.适当升高反应体系温度
C.增大体系压强 D.使用高效催化剂
②已知:CO(g)+ O2(g)=CO2(g) △H2=-283 kJ·mol-1
O2(g)=CO2(g) △H2=-283 kJ·mol-1
H2(g)+ O2(g)=H2O(g) △H3=-242 kJ·mol-1
O2(g)=H2O(g) △H3=-242 kJ·mol-1
则表示气态甲醇完全燃烧生成CO2和水蒸气时的热化学方程式为___________ 。
(2)t℃时,水溶液中c(H+)和c(OH-)的关系如图所示,a点离子积KW=___________ ;该温度下,pH=12的NaOH溶液与pH=2的H2SO4溶液等体积混合,溶液呈___________ 性。

(3)已知常温下,Ksp(BaCO3)=2.6×10-9,Ksp(BaSO4)=1.1×10-10。
①现将浓度为2×10-4 mol·L-1 Na2CO3溶液与某BaCl2溶液等体积混合(忽略溶液体积的变化),则生成BaCO3沉淀所需原BaCl2溶液的最小浓度为___________ mol·L-1。
②向含有BaSO4固体的溶液中滴加BaCO3溶液,当有BaCO3沉淀生成时,溶液中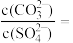
___________ (保留三位有效数字)。
 CH3OH(g) △H1=-116 kJ·mol-1。
CH3OH(g) △H1=-116 kJ·mol-1。①下列措施中有利于提高CO平衡转化率的是
A.随时将CH3OH与反应混合物分离 B.适当升高反应体系温度
C.增大体系压强 D.使用高效催化剂
②已知:CO(g)+
 O2(g)=CO2(g) △H2=-283 kJ·mol-1
O2(g)=CO2(g) △H2=-283 kJ·mol-1H2(g)+
 O2(g)=H2O(g) △H3=-242 kJ·mol-1
O2(g)=H2O(g) △H3=-242 kJ·mol-1则表示气态甲醇完全燃烧生成CO2和水蒸气时的热化学方程式为
(2)t℃时,水溶液中c(H+)和c(OH-)的关系如图所示,a点离子积KW=

(3)已知常温下,Ksp(BaCO3)=2.6×10-9,Ksp(BaSO4)=1.1×10-10。
①现将浓度为2×10-4 mol·L-1 Na2CO3溶液与某BaCl2溶液等体积混合(忽略溶液体积的变化),则生成BaCO3沉淀所需原BaCl2溶液的最小浓度为
②向含有BaSO4固体的溶液中滴加BaCO3溶液,当有BaCO3沉淀生成时,溶液中
您最近一年使用:0次
名校
2 . 以钛铁矿(主要成分为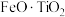 ,还含有MgO、CaO、
,还含有MgO、CaO、 等杂质)为原料合成锂离子电池的电极材料钛酸锂(
等杂质)为原料合成锂离子电池的电极材料钛酸锂( )和磷酸亚铁锂(
)和磷酸亚铁锂( )的工艺流程如下:
)的工艺流程如下:
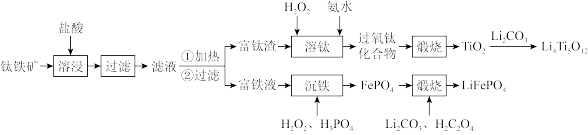
回答下列问题:
(1)“溶浸”后溶液中的主要金属阳离子包括 ,
, ,
,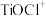 ,其中钛元素的化合价为
,其中钛元素的化合价为_______ 。“滤液”经加热水解后转化为富钛渣(钛元素主要以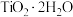 形式存在),写出上述转变的离子方程式:
形式存在),写出上述转变的离子方程式:_______ 。
(2)“溶钛”过程反应温度不能太高,其原因是_______ 。
(3)“沉铁”步骤中氧化剂和还原剂物质的量之比为_______ ,“沉铁”后的滤液经处理后可返回_______ 工序循环利用。
(4)“煅烧”制备 的化学方程式为
的化学方程式为_______ 。
(5)从废旧 电极中可回收锂元素。用盐酸充分溶浸废旧
电极中可回收锂元素。用盐酸充分溶浸废旧 电极,测得1L浸取液中
电极,测得1L浸取液中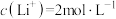 ,加入等体积的碳酸钠溶液将
,加入等体积的碳酸钠溶液将 转化为
转化为 沉淀,若沉淀中的锂元素占浸取液中锂元素总量的90%,则加入的碳酸钠溶液浓度为
沉淀,若沉淀中的锂元素占浸取液中锂元素总量的90%,则加入的碳酸钠溶液浓度为_______  [已知
[已知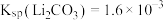 ,假设反应后溶液体积为反应前两溶液之和]。
,假设反应后溶液体积为反应前两溶液之和]。
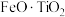 ,还含有MgO、CaO、
,还含有MgO、CaO、 等杂质)为原料合成锂离子电池的电极材料钛酸锂(
等杂质)为原料合成锂离子电池的电极材料钛酸锂( )和磷酸亚铁锂(
)和磷酸亚铁锂( )的工艺流程如下:
)的工艺流程如下:
回答下列问题:
(1)“溶浸”后溶液中的主要金属阳离子包括
 ,
, ,
,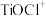 ,其中钛元素的化合价为
,其中钛元素的化合价为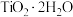 形式存在),写出上述转变的离子方程式:
形式存在),写出上述转变的离子方程式:(2)“溶钛”过程反应温度不能太高,其原因是
(3)“沉铁”步骤中氧化剂和还原剂物质的量之比为
(4)“煅烧”制备
 的化学方程式为
的化学方程式为(5)从废旧
 电极中可回收锂元素。用盐酸充分溶浸废旧
电极中可回收锂元素。用盐酸充分溶浸废旧 电极,测得1L浸取液中
电极,测得1L浸取液中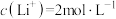 ,加入等体积的碳酸钠溶液将
,加入等体积的碳酸钠溶液将 转化为
转化为 沉淀,若沉淀中的锂元素占浸取液中锂元素总量的90%,则加入的碳酸钠溶液浓度为
沉淀,若沉淀中的锂元素占浸取液中锂元素总量的90%,则加入的碳酸钠溶液浓度为 [已知
[已知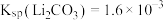 ,假设反应后溶液体积为反应前两溶液之和]。
,假设反应后溶液体积为反应前两溶液之和]。
您最近一年使用:0次
2022-04-01更新
|
335次组卷
|
2卷引用:湖南省郴州市第一中学2022届高三下学期期中考试化学试题
名校
解题方法
3 .  是锂离子电池的活性材料。某小组以含锰矿料(主要成分是
是锂离子电池的活性材料。某小组以含锰矿料(主要成分是 ,含少量
,含少量 、
、 、FeO、CoO和
、FeO、CoO和 )为原料制备
)为原料制备 的流程如图所示(部分条件和产物省略)。
的流程如图所示(部分条件和产物省略)。

已知几种金属氢氧化物沉淀的pH如表所示:
请回答下列问题:
(1)写出一条提高“酸浸”速率的措施:_______ 。
(2)“除杂1”时,加入 的作用是
的作用是_______ (用离子方程式表示)。
(3)“固体1”中除了含有 外,还只含有另外一种固体,其化学式为
外,还只含有另外一种固体,其化学式为_______ ,则“除杂1”过程调节pH范围为_______ 。
(4)在高温下“合成” ,反应的化学方程式为
,反应的化学方程式为_______ 。
(5)已知:常温下,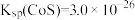 。为了使残液中
。为了使残液中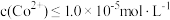 ,必须控制
,必须控制 ≥
≥_______ mol/L。
(6)“浸渣”中含少量锰元素,其测定方法如下:
第1步:称取W g“浸渣”,加酸将锰元素以 形式全部溶出,过滤,将滤液加入250mL容量瓶中,定容;
形式全部溶出,过滤,将滤液加入250mL容量瓶中,定容;
第2步:取25.00mL上述定容后的溶液于锥形瓶中,加入少量催化剂和过量 溶液,加热,充分反应后,煮沸溶液;
溶液,加热,充分反应后,煮沸溶液;
第3步:用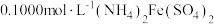 溶液滴定至终点,消耗滴定液V mL,使
溶液滴定至终点,消耗滴定液V mL,使 重新变为
重新变为 。
。
已知: 具有强氧化性,受热易分解。
具有强氧化性,受热易分解。
①“浸渣”中锰元素的质量分数为_______ (用含W、V的代数式表示)。
②如果省略第2步“煮沸溶液”,测得结果将_______ (填“偏高”、“偏低”或“无影响”)。
 是锂离子电池的活性材料。某小组以含锰矿料(主要成分是
是锂离子电池的活性材料。某小组以含锰矿料(主要成分是 ,含少量
,含少量 、
、 、FeO、CoO和
、FeO、CoO和 )为原料制备
)为原料制备 的流程如图所示(部分条件和产物省略)。
的流程如图所示(部分条件和产物省略)。
已知几种金属氢氧化物沉淀的pH如表所示:
| 金属氢氧化物 |  |  |  |  |
| 开始沉淀的pH | 2.7 | 7.6 | 7.6 | 7.7 |
| 完全沉淀的pH | 3.7 | 9.1 | 9.1 | 9.2 |
请回答下列问题:
(1)写出一条提高“酸浸”速率的措施:
(2)“除杂1”时,加入
 的作用是
的作用是(3)“固体1”中除了含有
 外,还只含有另外一种固体,其化学式为
外,还只含有另外一种固体,其化学式为(4)在高温下“合成”
 ,反应的化学方程式为
,反应的化学方程式为(5)已知:常温下,
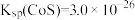 。为了使残液中
。为了使残液中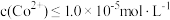 ,必须控制
,必须控制 ≥
≥(6)“浸渣”中含少量锰元素,其测定方法如下:
第1步:称取W g“浸渣”,加酸将锰元素以
 形式全部溶出,过滤,将滤液加入250mL容量瓶中,定容;
形式全部溶出,过滤,将滤液加入250mL容量瓶中,定容;第2步:取25.00mL上述定容后的溶液于锥形瓶中,加入少量催化剂和过量
 溶液,加热,充分反应后,煮沸溶液;
溶液,加热,充分反应后,煮沸溶液;第3步:用
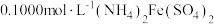 溶液滴定至终点,消耗滴定液V mL,使
溶液滴定至终点,消耗滴定液V mL,使 重新变为
重新变为 。
。已知:
 具有强氧化性,受热易分解。
具有强氧化性,受热易分解。①“浸渣”中锰元素的质量分数为
②如果省略第2步“煮沸溶液”,测得结果将
您最近一年使用:0次
2022-04-18更新
|
350次组卷
|
4卷引用:湖南省湘西自治州2022届高三下学期4月第三次模拟考试化学试题
名校
解题方法
4 . Ⅰ.高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺如图所示。

已知:①“滤渣1”含有S和SiO2;
②相关金属离子初始浓度c(Mn+)=0.1mol·L-1形成氢氧化物沉淀的pH范围如表:
回答下列问题:
(1)“溶浸”过程中,提高浸出率的措施有___ (写一条即可)。
(2)“氧化”中添加适量的MnO2的作用是___ 。
(3)“除杂1”的目的是除去Zn2+和Ni2+,“滤渣3”的主要成分是____ 。
(4)“调pH”的目的是除铁和铝,则溶液的pH范围应调节为___ ~6之间。
(5)“沉锰”时会产生无色无味的一种气体,写出“沉猛”的离子方程式___ 。
Ⅱ.我国规定生活用水中铅排放的最大允许浓度为0.0100mg·L-1。常温下常见铅盐的溶度积常数如表所示:
(6)根据表格,为达到饮用水标准最佳的沉淀试剂应选择下列物质中的____ 。
A.Na2SO4 B.KI C.Na2CO3 D.K2CrO4 E.Na2S
(7)按以上选择的试剂,使1.00L饮用水达到国家排放标准,至少应该调节溶液中该沉淀试剂的阴离子浓度保持在___ 之上。

已知:①“滤渣1”含有S和SiO2;
②相关金属离子初始浓度c(Mn+)=0.1mol·L-1形成氢氧化物沉淀的pH范围如表:
| 金属离子 | Mn2+ | Fe2+ | Fe3+ | Al3+ | Mg2+ | Zn2+ | Ni2+ |
| 开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 | 6.9 |
| 沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 | 8.9 |
(1)“溶浸”过程中,提高浸出率的措施有
(2)“氧化”中添加适量的MnO2的作用是
(3)“除杂1”的目的是除去Zn2+和Ni2+,“滤渣3”的主要成分是
(4)“调pH”的目的是除铁和铝,则溶液的pH范围应调节为
(5)“沉锰”时会产生无色无味的一种气体,写出“沉猛”的离子方程式
Ⅱ.我国规定生活用水中铅排放的最大允许浓度为0.0100mg·L-1。常温下常见铅盐的溶度积常数如表所示:
| 化学式 | PbSO4 | PbI2 | PbCO3 | PbCrO4 | PbS |
| Ksp | 1.80×10-8 | 8.50×10-9 | 1.50×10-13 | 1.80×10-14 | 9.00×10-29 |
A.Na2SO4 B.KI C.Na2CO3 D.K2CrO4 E.Na2S
(7)按以上选择的试剂,使1.00L饮用水达到国家排放标准,至少应该调节溶液中该沉淀试剂的阴离子浓度保持在
您最近一年使用:0次
2022-04-04更新
|
404次组卷
|
3卷引用:湖南省邵东市第三中学2023-2024学年高二上学期1月期末考试化学试卷
5 . 高纯硫酸锰是合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺如图所示。
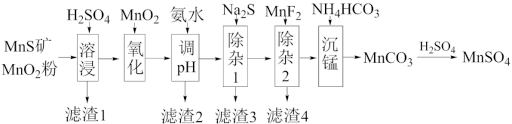
已知:①“滤渣1”含有S和SiO2;
②相关金属离子形成氢氧化物沉淀的pH范围如下:
回答下列问题:
(1)“氧化”中添加适量MnO2的作用是_______ 。
(2)“除杂1”的目的是除去Zn2+和Ni2+,则“滤渣3”的主要成分是_______ (写化学式)。
(3)“除杂2”的目的是除去Mg2+。若1L溶液中Mg2+的初始浓度为0.1mol/L,现欲将Mg2+沉淀完全(即剩余离子浓度小于1×10-5mol/L),则至少需要加入MnF2固体_______ mol(忽略加入固体时溶液体积的变化)。(已知:Ksp(MgF2)=4.0×10-9;MnF2为易溶的强电解质。)
(4)写出“沉锰”的离子方程式_______ 。
II.一定量的CO2与足量的碳在体积可变的恒压(P0)密闭容器中反应:C(s)+CO2(g) 2CO(g),平衡时,体系中气体体积分数与温度的关系如图所示:
2CO(g),平衡时,体系中气体体积分数与温度的关系如图所示:

(5)650°C时,反应达平衡后CO2的转化率为_______ 。
(6)T°C时该反应的平衡常数Kp=_______ (Kp是以分压表示的平衡常数,分压=总压×体积分数)

已知:①“滤渣1”含有S和SiO2;
②相关金属离子形成氢氧化物沉淀的pH范围如下:
| 金属离子 | Mn2+ | Fe2+ | Fe3+ | Al3+ | Mg2+ | Zn2+ | Ni2+ |
| 开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 | 6.9 |
| 沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 | 8.9 |
(1)“氧化”中添加适量MnO2的作用是
(2)“除杂1”的目的是除去Zn2+和Ni2+,则“滤渣3”的主要成分是
(3)“除杂2”的目的是除去Mg2+。若1L溶液中Mg2+的初始浓度为0.1mol/L,现欲将Mg2+沉淀完全(即剩余离子浓度小于1×10-5mol/L),则至少需要加入MnF2固体
(4)写出“沉锰”的离子方程式
II.一定量的CO2与足量的碳在体积可变的恒压(P0)密闭容器中反应:C(s)+CO2(g)
 2CO(g),平衡时,体系中气体体积分数与温度的关系如图所示:
2CO(g),平衡时,体系中气体体积分数与温度的关系如图所示:
(5)650°C时,反应达平衡后CO2的转化率为
(6)T°C时该反应的平衡常数Kp=
您最近一年使用:0次
解题方法
6 . 铍有“超级金属”之称,是航天、航空、电子和核工业等领域不可替代的材料。以绿柱石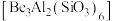 为原料制备金属铍的工艺如下:
为原料制备金属铍的工艺如下:
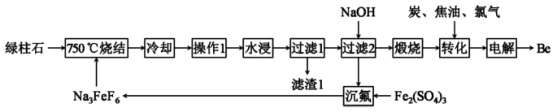
已知: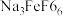 难溶于水,
难溶于水, 可与过量NaOH结合成
可与过量NaOH结合成 。回答下列问题:
。回答下列问题:
(1)“操作1”的目的是使烧结的固体在水浸过程有较大的接触面积,则其名称是_______ 。
(2)烧结时,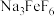 与绿柱石作用除生成易溶于水的
与绿柱石作用除生成易溶于水的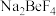 外,还有铁、铝、硅的氧化物,该反应的化学方程式为
外,还有铁、铝、硅的氧化物,该反应的化学方程式为_______ 。“滤渣1”中的碱性氧化物是_______ 。
(3)“过滤1”的滤液中需加入适量NaOH生成 沉淀,但NaOH不能过量,原因是
沉淀,但NaOH不能过量,原因是_______ (用离子方程式表示)。当滤液中的 恰好完全沉淀时,该溶液的pH=
恰好完全沉淀时,该溶液的pH=_______ 。(此时溶液中 浓度为
浓度为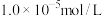 。已知:
。已知: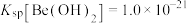 )
)
(4)“沉氟”过程中的离子方程式:_______ 。
(5) 在熔融状态下不能导电,工业上用电解
在熔融状态下不能导电,工业上用电解 熔融混合物制备金属铍,可选用镍电极作电解槽的
熔融混合物制备金属铍,可选用镍电极作电解槽的_______ (填“阳极”或“阴极”)材料,电解总反应的化学方程式为_______ ;加入NaCl的主要目的是_______ 。
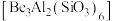 为原料制备金属铍的工艺如下:
为原料制备金属铍的工艺如下:
已知:
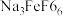 难溶于水,
难溶于水, 可与过量NaOH结合成
可与过量NaOH结合成 。回答下列问题:
。回答下列问题:(1)“操作1”的目的是使烧结的固体在水浸过程有较大的接触面积,则其名称是
(2)烧结时,
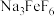 与绿柱石作用除生成易溶于水的
与绿柱石作用除生成易溶于水的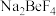 外,还有铁、铝、硅的氧化物,该反应的化学方程式为
外,还有铁、铝、硅的氧化物,该反应的化学方程式为(3)“过滤1”的滤液中需加入适量NaOH生成
 沉淀,但NaOH不能过量,原因是
沉淀,但NaOH不能过量,原因是 恰好完全沉淀时,该溶液的pH=
恰好完全沉淀时,该溶液的pH= 浓度为
浓度为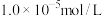 。已知:
。已知: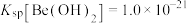 )
)(4)“沉氟”过程中的离子方程式:
(5)
 在熔融状态下不能导电,工业上用电解
在熔融状态下不能导电,工业上用电解 熔融混合物制备金属铍,可选用镍电极作电解槽的
熔融混合物制备金属铍,可选用镍电极作电解槽的
您最近一年使用:0次
名校
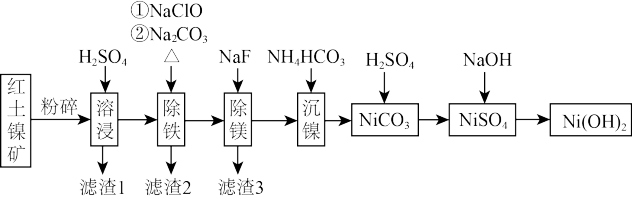
7 . Ni(OH)2作为合成镍钴锰三元电极材料的原料,工业上可用红土镍矿(主要成分为NiO、FeO、Fe2O3、MgO和SiO2)制备,工艺流程如图所示。
下列说法正确的是

下列说法正确的是
| A.“溶浸”时,为加快反应速率,可以选用98%的浓硫酸 |
| B.“滤渣1”的成分为H2SiO3 |
| C.为了证明加入NaClO已足量,可在溶液中加入KSCN溶液和氯水来检验 |
D.“沉镍”的离子方程式为:Ni2++2 HCO =NiCO3↓+CO2↑+H2O =NiCO3↓+CO2↑+H2O |
您最近一年使用:0次
2021-11-04更新
|
318次组卷
|
2卷引用:湖南省长沙市第一中学2021-2022学年高三上学期月考化学试题
名校
解题方法
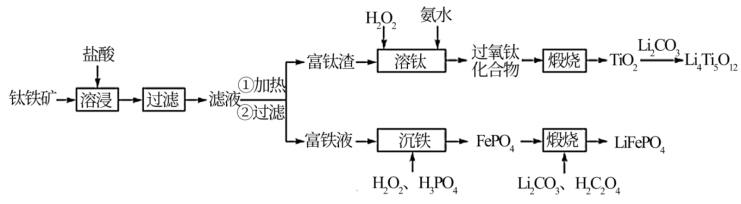
8 . 以钛铁矿(主要成分为FeO·TiO2,还含有MgO、CaO、SiO2等杂质)为原料合成锂离子电池的电极材料钛酸锂(Li4Ti5O12)和磷酸亚铁锂(LiFePO4)的工艺流程如下:
回答下列问题:
(1)“溶浸”后溶液中的金属阳离子主要包括Mg2+、TiOCl+___________ 。“滤液”经加热水解后转化为富钛渣(钛元素主要以TiO2·2H2O形式存在),写出上述转变的离子方程式:___________ 。
(2)“溶钛”过程反应温度不能太高,其原因是___________ 。
(3)“沉铁”步骤反应的化学方程式为___________ ,“沉铁”后的滤液经处理后可返回___________ 工序循环利用。
(4)“煅烧”制备LiFePO4过程中,Li2CO3和H2C2O4的理论投入量的物质的量之比为___________ 。
(5)以Li4Ti5O12和LiFePO4作电极组成电池,充电时发生反应:Li4Ti5O12+LiFePO4=Li4+xTi5O12+Li1-xFePO4(0<x<1),阳极的电极反应式为___________ 。
(6)从废旧LiFePO4电极中可回收锂元素。用硝酸充分溶浸废旧LiFePO4电极,测得浸取液中c(Li+)=4mol·L-1,加入等体积的碳酸钠溶液将Li+转化为Li2CO3沉淀 ,若沉淀中的锂元素占浸取液中锂元素总量的90%,则反应后的溶液中CO 的浓度为
的浓度为___________ mol·L-1[已知Ksp(Li2CO3)=1.6×10-3,假设反应后溶液体积为反应前两溶液之和]。

回答下列问题:
(1)“溶浸”后溶液中的金属阳离子主要包括Mg2+、TiOCl+
(2)“溶钛”过程反应温度不能太高,其原因是
(3)“沉铁”步骤反应的化学方程式为
(4)“煅烧”制备LiFePO4过程中,Li2CO3和H2C2O4的理论投入量的物质的量之比为
(5)以Li4Ti5O12和LiFePO4作电极组成电池,充电时发生反应:Li4Ti5O12+LiFePO4=Li4+xTi5O12+Li1-xFePO4(0<x<1),阳极的电极反应式为
(6)从废旧LiFePO4电极中可回收锂元素。用硝酸充分溶浸废旧LiFePO4电极,测得浸取液中c(Li+)=4mol·L-1,加入等体积的碳酸钠溶液将Li+转化为Li2CO3沉淀 ,若沉淀中的锂元素占浸取液中锂元素总量的90%,则反应后的溶液中CO
 的浓度为
的浓度为
您最近一年使用:0次
2021-08-06更新
|
1486次组卷
|
4卷引用:湖南省株洲市第八中学021-2022学年高三下学期5月月考化学试题
湖南省株洲市第八中学021-2022学年高三下学期5月月考化学试题九师联盟2021届高三下学期5月“考前练兵”联考理综化学试题宁夏回族自治区银川一中2022届高三二模理科综合化学试题(已下线)专题01 工艺流程专题-【大题精做】冲刺2023年高考化学大题突破+限时集训(新高考专用)
解题方法
9 . 铍有“超级金属”之称,是航天、航空、电子和核工业等领域不可替代的材料。以绿柱石[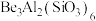 ]为原料制备金属铍的工艺如下:
]为原料制备金属铍的工艺如下:

已知: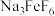 难溶于水,
难溶于水, 可与过量
可与过量 结合成
结合成 。
。
回答下列问题:
(1)“操作1”的目的是使烧结的固体在水浸过程有较大的接触面积,则其名称是___________ 。
(2)烧结时;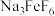 与绿柱石作用除生成易溶于水的
与绿柱石作用除生成易溶于水的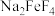 外,还有铁、铝、硅的氧化物,该反应的化学方程式为
外,还有铁、铝、硅的氧化物,该反应的化学方程式为___________ 。“滤渣1”中的酸性氧化物是___________ 。
(3)“过滤1”的滤液中需加入适量NaOH生成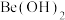 沉淀,但NaOH不能过量,原因是
沉淀,但NaOH不能过量,原因是___________ (用离子方程式表示)。
(4)已知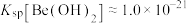 ,室温下
,室温下 恰好完全沉淀时[此时
恰好完全沉淀时[此时 浓度为
浓度为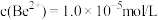 ]的
]的
___________ 。
(5) 在熔融状态下不能导电,工业上用电解
在熔融状态下不能导电,工业上用电解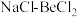 熔融混合物制备金属铍,可选用镍坩埚作电解槽的
熔融混合物制备金属铍,可选用镍坩埚作电解槽的___________ (填“阳极”或“阴极”)材料,电解总反应的化学方程式为___________ ;加入NaCl的主要目的是___________ 。
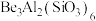 ]为原料制备金属铍的工艺如下:
]为原料制备金属铍的工艺如下:
已知:
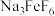 难溶于水,
难溶于水, 可与过量
可与过量 结合成
结合成 。
。回答下列问题:
(1)“操作1”的目的是使烧结的固体在水浸过程有较大的接触面积,则其名称是
(2)烧结时;
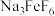 与绿柱石作用除生成易溶于水的
与绿柱石作用除生成易溶于水的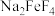 外,还有铁、铝、硅的氧化物,该反应的化学方程式为
外,还有铁、铝、硅的氧化物,该反应的化学方程式为(3)“过滤1”的滤液中需加入适量NaOH生成
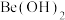 沉淀,但NaOH不能过量,原因是
沉淀,但NaOH不能过量,原因是(4)已知
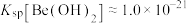 ,室温下
,室温下 恰好完全沉淀时[此时
恰好完全沉淀时[此时 浓度为
浓度为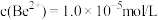 ]的
]的
(5)
 在熔融状态下不能导电,工业上用电解
在熔融状态下不能导电,工业上用电解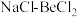 熔融混合物制备金属铍,可选用镍坩埚作电解槽的
熔融混合物制备金属铍,可选用镍坩埚作电解槽的
您最近一年使用:0次
2021-05-15更新
|
402次组卷
|
2卷引用:湖南省长沙同升湖实验学校2021-2022学年高三上学期第二次月考化学试题
名校
解题方法
10 . 铍是航天、航空、电子和核工业等领域不可替代的材料,有“超级金属”之称。以绿柱石[Be3Al2(SiO3)6]为原料制备金属铍的工艺如下: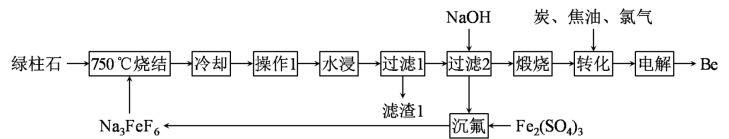
已知:“滤渣1”中含有铁、铝、硅的氧化物,Na3FeF6难溶于水,Be2+可与过量OH-结合成Be(OH) 。回答下列问题:
。回答下列问题:
(1)“操作1”的名称是_______ 。
(2)750℃烧结时,Na3FeF6与绿柱石作用生成易溶于水的Na2BeF4,该反应的化学方程式为_______ 。
(3)“过滤1”的滤液中需加入适量NaOH生成Be(OH)2沉淀,但NaOH不能过量,原因是_______ (用离子方程式表示)。
(4)已知Ksp[Be(OH)2]=4.0×10-21,室温时0.40 mol•L-1 Be2+开始沉淀时的pH=_______ 。
(5)“沉氟”反应的离子方程式为_______ 。
(6)已知镍在稀酸中缓慢溶解。工业上电解NaCl-BeCl2熔融混合物制备金属铍,可选用镍坩埚作电解槽的_______ (填“阳极”或“阴极”)材料,电解总反应的化学方程式为_______ ;加入NaCl的主要目的是_______ 。
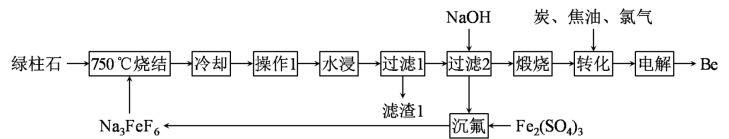
已知:“滤渣1”中含有铁、铝、硅的氧化物,Na3FeF6难溶于水,Be2+可与过量OH-结合成Be(OH)
 。回答下列问题:
。回答下列问题:(1)“操作1”的名称是
(2)750℃烧结时,Na3FeF6与绿柱石作用生成易溶于水的Na2BeF4,该反应的化学方程式为
(3)“过滤1”的滤液中需加入适量NaOH生成Be(OH)2沉淀,但NaOH不能过量,原因是
(4)已知Ksp[Be(OH)2]=4.0×10-21,室温时0.40 mol•L-1 Be2+开始沉淀时的pH=
(5)“沉氟”反应的离子方程式为
(6)已知镍在稀酸中缓慢溶解。工业上电解NaCl-BeCl2熔融混合物制备金属铍,可选用镍坩埚作电解槽的
您最近一年使用:0次
2021-03-07更新
|
830次组卷
|
4卷引用:湖南省永州市第四中学2022届高三第三次调研考试化学试题
湖南省永州市第四中学2022届高三第三次调研考试化学试题重庆市强基联合体2021届高三下学期质量检测化学试题(已下线)重点8 工艺流程综合题-2021年高考化学【热点·重点·难点】专练(山东专用)河南省实验中学2021届高三5月第四次模拟考试理综化学试题



