名校
解题方法
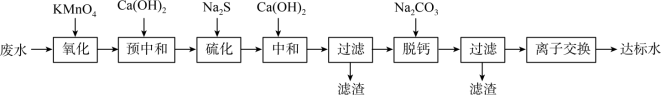
1 . 湿法炼锌的工业废水中主要阳离子有Zn2+、H+、Tl+、Tl3+,废水除铊的工艺流程如图。 能够在pH为0~14的范围内以离子态稳定存在,不易与
能够在pH为0~14的范围内以离子态稳定存在,不易与 形成沉淀。
形成沉淀。
②部分物质的 如表:
如表:
③排放标准:Tl的含量低于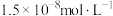 。
。
回答下列问题:
(1)Tl的原子序数为81,在元素周期表中的位置为___________ ,价电子排布式为___________ 。
(2)已知“氧化”步骤中 被还原为
被还原为 ,请写出该反应的离子方程式:
,请写出该反应的离子方程式:___________ ,反应后仍存在少量的 。
。
(3)“预中和”步骤中加入 至溶液的pH约为7,可减少“硫化”步骤中
至溶液的pH约为7,可减少“硫化”步骤中 的使用量,还能减少
的使用量,还能减少___________ (填化学式)污染物的生成。
(4)“硫化”步骤的主要目的是除去___________ (填离子符号)。
(5)在“中和”步骤中,若要使溶液中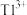 的含量低于排放标准,请根据
的含量低于排放标准,请根据 计算溶液的pH应大于
计算溶液的pH应大于___________ 。
(6)“离子交换”步骤中可用普鲁士蓝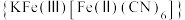 (其摩尔质量为
(其摩尔质量为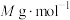 )中的
)中的 与残余铊离子进行离子交换,进一步实现废水中铊的去除。普鲁士蓝晶胞的如下[
与残余铊离子进行离子交换,进一步实现废水中铊的去除。普鲁士蓝晶胞的如下[ 未标出,其占据四个互不相邻的小立方体(晶胞的部分)的体心]。若该晶体的密度为
未标出,其占据四个互不相邻的小立方体(晶胞的部分)的体心]。若该晶体的密度为 ,则
,则 和
和 的最短距离为
的最短距离为___________ cm(设 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
 能够在pH为0~14的范围内以离子态稳定存在,不易与
能够在pH为0~14的范围内以离子态稳定存在,不易与 形成沉淀。
形成沉淀。②部分物质的
 如表:
如表:| 物质 |  | 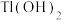 | ZnS |  |
 | 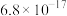 |  |  |  |
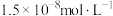 。
。回答下列问题:
(1)Tl的原子序数为81,在元素周期表中的位置为
(2)已知“氧化”步骤中
 被还原为
被还原为 ,请写出该反应的离子方程式:
,请写出该反应的离子方程式: 。
。(3)“预中和”步骤中加入
 至溶液的pH约为7,可减少“硫化”步骤中
至溶液的pH约为7,可减少“硫化”步骤中 的使用量,还能减少
的使用量,还能减少(4)“硫化”步骤的主要目的是除去
(5)在“中和”步骤中,若要使溶液中
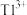 的含量低于排放标准,请根据
的含量低于排放标准,请根据 计算溶液的pH应大于
计算溶液的pH应大于(6)“离子交换”步骤中可用普鲁士蓝
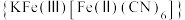 (其摩尔质量为
(其摩尔质量为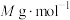 )中的
)中的 与残余铊离子进行离子交换,进一步实现废水中铊的去除。普鲁士蓝晶胞的如下[
与残余铊离子进行离子交换,进一步实现废水中铊的去除。普鲁士蓝晶胞的如下[ 未标出,其占据四个互不相邻的小立方体(晶胞的部分)的体心]。若该晶体的密度为
未标出,其占据四个互不相邻的小立方体(晶胞的部分)的体心]。若该晶体的密度为 ,则
,则 和
和 的最短距离为
的最短距离为 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。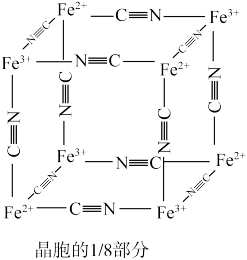
您最近一年使用:0次
2 . 铊(Tl)本身是一种剧毒物质,为毒性最大的金属元素之一,但是铊在工业中的用途非常广泛,主要存在于一些矿物和工业废水中,也可以从含铊的合金中提取.从某铅锌厂的富铊灰(主要成分为 、
、 、
、 、
、 、
、 )中回收铊的工艺流程如图所示:
)中回收铊的工艺流程如图所示:
①在氯化物-硫酸水溶液中,铊元素以 形式存在;
形式存在;
(2)萃取过程的反应原理为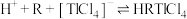 .
.
请回答下列问题:
(1)基态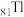 原子核外电子的运动状态有
原子核外电子的运动状态有________ 种.
(2)“浸取I”过程中为提高铊的浸取速率,可采取的措施有________________ (写出两条).
(3)写出“浸取I”中 发生反应的化学方程式:
发生反应的化学方程式:________________ ,“滤渣”的主要成分是________ (填化学式).
(4)请从化学平衡的角度解释“反萃取”过程中加入 溶液的原因:
溶液的原因:________________ .
(5)写出“还原氯化沉淀”中反应的离子方程式:________________ .
(6)通过沉淀法也可以去除工业废水中的 和
和 .
.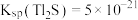 ,某地区规定工业污水中铊的污染物排放限值为
,某地区规定工业污水中铊的污染物排放限值为 ,若铊的含量符合国家排放限值,则处理后的废水中
,若铊的含量符合国家排放限值,则处理后的废水中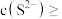
________  (假设污水中铊全部以
(假设污水中铊全部以 形式存在).
形式存在).
②向含铊废水中加入溴水,使 充分氧化成
充分氧化成 ,调节溶液pH,沉淀去除铊元素.若pH过大,铊元素去除率下降的原因是
,调节溶液pH,沉淀去除铊元素.若pH过大,铊元素去除率下降的原因是________________ .
 、
、 、
、 、
、 、
、 )中回收铊的工艺流程如图所示:
)中回收铊的工艺流程如图所示: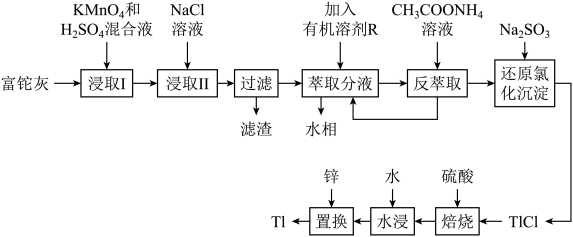
①在氯化物-硫酸水溶液中,铊元素以
 形式存在;
形式存在;(2)萃取过程的反应原理为
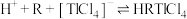 .
.请回答下列问题:
(1)基态
 原子核外电子的运动状态有
原子核外电子的运动状态有(2)“浸取I”过程中为提高铊的浸取速率,可采取的措施有
(3)写出“浸取I”中
 发生反应的化学方程式:
发生反应的化学方程式:(4)请从化学平衡的角度解释“反萃取”过程中加入
 溶液的原因:
溶液的原因:(5)写出“还原氯化沉淀”中反应的离子方程式:
(6)通过沉淀法也可以去除工业废水中的
 和
和 .
.
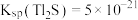 ,某地区规定工业污水中铊的污染物排放限值为
,某地区规定工业污水中铊的污染物排放限值为 ,若铊的含量符合国家排放限值,则处理后的废水中
,若铊的含量符合国家排放限值,则处理后的废水中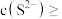
 (假设污水中铊全部以
(假设污水中铊全部以 形式存在).
形式存在).②向含铊废水中加入溴水,使
 充分氧化成
充分氧化成 ,调节溶液pH,沉淀去除铊元素.若pH过大,铊元素去除率下降的原因是
,调节溶液pH,沉淀去除铊元素.若pH过大,铊元素去除率下降的原因是
您最近一年使用:0次
名校
解题方法
3 . 银作为一种战略金属,在电子、化工、医药等行业广泛使用。某铅锌矿(含有PbCO3、ZnCO3、ZnO等)中含有低品位的辉银矿(Ag2S与自然Ag共生),可以采用NaCN溶液氰化法提取出银,能耗低,生产工艺简便。其炼制工艺简介如图:
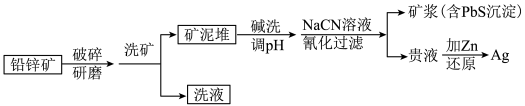
已知:①HCN是一种弱酸,易挥发,有毒性,Ka=6.2×10-10。
②ZnCO3、ZnO易溶解于NaCN溶液中,且NaCN对游离态和化合态的银均能以[Ag(CN)2]-形式浸出。
③调pH过程中,PbCO3已经溶解为Pb(OH) 。
。
(1)NaCN的电子式为_______ 。
(2)铅锌矿破碎研磨的目的是_______ 。
(3)“碱洗”后需调pH,使pH>12,方可进行NaCN溶液喷淋,其目的是_______ 。
(4)“氰化”过程中Ag2S与NaCN溶液反应的化学方程式为_______ ,调pH后不经过“过滤”操作直接加NaCN溶液“氰化”的理由是_______ 。
(5)矿泥堆要有良好的渗透性和孔隙度,其原因是_______ 。
(6)“氰化法”中最终矿浆需要用NaClO溶液消毒处理,发生的离子反应方程式为_______ ,处理100m3含NaCN10.3mg/L的废水,实际至少需NaClO_______ g(实际用量应为理论值的4倍),才能使NaCN含量低于0.5mg/L,达到排放标准。

已知:①HCN是一种弱酸,易挥发,有毒性,Ka=6.2×10-10。
②ZnCO3、ZnO易溶解于NaCN溶液中,且NaCN对游离态和化合态的银均能以[Ag(CN)2]-形式浸出。
③调pH过程中,PbCO3已经溶解为Pb(OH)
 。
。(1)NaCN的电子式为
(2)铅锌矿破碎研磨的目的是
(3)“碱洗”后需调pH,使pH>12,方可进行NaCN溶液喷淋,其目的是
(4)“氰化”过程中Ag2S与NaCN溶液反应的化学方程式为
(5)矿泥堆要有良好的渗透性和孔隙度,其原因是
(6)“氰化法”中最终矿浆需要用NaClO溶液消毒处理,发生的离子反应方程式为
您最近一年使用:0次
解题方法
4 . 地壳中铈占稀土总量的28%,居第一位。铈主要存在于独居石和氟碳铈矿中,其中氧化焙烧—萃取法冶炼氟碳铈矿(含CeFCO3、BaO、SiO2等)制取CeO2的一种工艺流程如图所示:
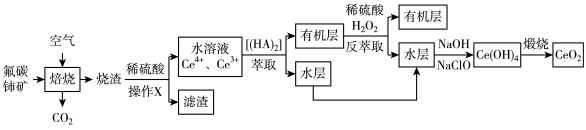
资料:在硫酸体系中,Ce4+在[(HA)2]中的溶解度大于其在水中的溶解度,Ce3+与之相反。回答下列问题:
(1)氟碳铈中元素的化合价为____ ,焙烧过程中,为加快反应速率可采取的措施有____ (答出一条即可)。
(2)操作X的名称为____ ,实验室中进行操作X需要用到的玻璃仪器有烧杯、____ 和____ 。
(3)反萃取中的离子方程式为____ 。
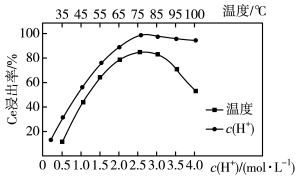
(4)烧渣中加入稀硫酸浸出,Ce的浸出率与c(H+)、温度的关系如图所示,从c(H+)角度考虑应选择的最佳条件为____ 。
(5)常温下,向水层中加入NaOH溶液来调节溶液的pH,当溶液pH=8时,Ce3+____ (填“是”或“否”)沉淀完全。{已知离子浓度小于1.0×10-5mol·L-1时,认为沉淀完全,Ksp[Ce(OH)3]=1.0×10-20)。
(6)取上述流程中得到的CeO2产品0.9200g,加酸溶解后,向其中加入150.0mL0.1mol·L-1FeSO4溶液使Ce4+全部被还原成Ce3+,再用0.1000mol·L-1的酸性KMnO4标准溶液滴定上述溶液,至终点时,消耗20.00mL标准溶液。则该产品中CeO2的质量分数为____ %(保留两位小数)(已知氧化性:Ce4+>KMnO4)。

资料:在硫酸体系中,Ce4+在[(HA)2]中的溶解度大于其在水中的溶解度,Ce3+与之相反。回答下列问题:
(1)氟碳铈中元素的化合价为
(2)操作X的名称为
(3)反萃取中的离子方程式为
(4)烧渣中加入稀硫酸浸出,Ce的浸出率与c(H+)、温度的关系如图所示,从c(H+)角度考虑应选择的最佳条件为

(5)常温下,向水层中加入NaOH溶液来调节溶液的pH,当溶液pH=8时,Ce3+
(6)取上述流程中得到的CeO2产品0.9200g,加酸溶解后,向其中加入150.0mL0.1mol·L-1FeSO4溶液使Ce4+全部被还原成Ce3+,再用0.1000mol·L-1的酸性KMnO4标准溶液滴定上述溶液,至终点时,消耗20.00mL标准溶液。则该产品中CeO2的质量分数为
您最近一年使用:0次
名校
解题方法
5 . 将铜锌合金溶解后与足量 溶液反应(
溶液反应( 不与
不与 反应),生成的
反应),生成的 用
用 标准溶液滴定,根据消耗的
标准溶液滴定,根据消耗的 溶液体积可测算合金中铜的含量.实验过程如下:
溶液体积可测算合金中铜的含量.实验过程如下:
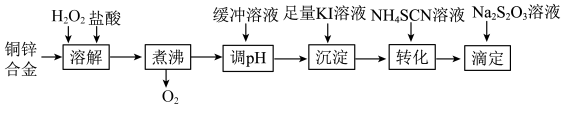
(1) 的电子式为
的电子式为______________ ,“溶解”步骤中铜发生反应的离子方程式是______________ ,“煮沸”步骤的目的是______________ .
(2)“缓冲溶液”是浓度均为 的
的 和
和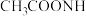 的混合溶液.
的混合溶液. 时,缓冲溶液中各种离子浓度由大到小的顺序为
时,缓冲溶液中各种离子浓度由大到小的顺序为______________ .[ 时,
时, ]
]
(3)“调 步骤将溶液
步骤将溶液 由1.调到6,如果缺少这一步,对实验的影响为
由1.调到6,如果缺少这一步,对实验的影响为______________ .
(4)“沉淀”步骤中有 沉淀产生,反应的离子方程式为
沉淀产生,反应的离子方程式为______________ .
(5)“转化”步骤中, 转化为
转化为 .沉淀完全转化后,溶液中
.沉淀完全转化后,溶液中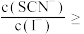
______________ [已知: ;
;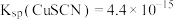 ]
]
 溶液反应(
溶液反应( 不与
不与 反应),生成的
反应),生成的 用
用 标准溶液滴定,根据消耗的
标准溶液滴定,根据消耗的 溶液体积可测算合金中铜的含量.实验过程如下:
溶液体积可测算合金中铜的含量.实验过程如下:
(1)
 的电子式为
的电子式为(2)“缓冲溶液”是浓度均为
 的
的 和
和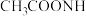 的混合溶液.
的混合溶液. 时,缓冲溶液中各种离子浓度由大到小的顺序为
时,缓冲溶液中各种离子浓度由大到小的顺序为 时,
时, ]
](3)“调
 步骤将溶液
步骤将溶液 由1.调到6,如果缺少这一步,对实验的影响为
由1.调到6,如果缺少这一步,对实验的影响为(4)“沉淀”步骤中有
 沉淀产生,反应的离子方程式为
沉淀产生,反应的离子方程式为(5)“转化”步骤中,
 转化为
转化为 .沉淀完全转化后,溶液中
.沉淀完全转化后,溶液中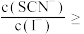
 ;
;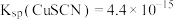 ]
]
您最近一年使用:0次
2023-09-08更新
|
108次组卷
|
2卷引用:湖南省衡阳市衡阳县第二中学2023-2024学年高二上学期期中考试化学试题
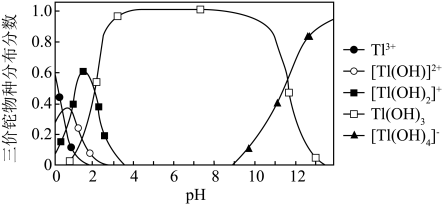
6 . 湿法炼锌工业废水中主要阳离子有 。废水除铊的工艺流程如下。
。废水除铊的工艺流程如下。
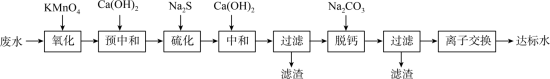
已知:① 能够在pH为0~14的范围内以离子态稳定存在,不易与OH-形成沉淀
能够在pH为0~14的范围内以离子态稳定存在,不易与OH-形成沉淀
② 易与废水中的有机物分子形成稳定的配合物,为了简便,通常用
易与废水中的有机物分子形成稳定的配合物,为了简便,通常用 表示
表示
③部分物质的
④排放标准:Tl的含量低于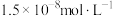
(1)已知“氧化”步骤中 被还原为
被还原为 且
且 氧化不彻底,请写出该反应的离子方程式:
氧化不彻底,请写出该反应的离子方程式:_______ 。
(2)“预中和”步骤,加 至溶液的
至溶液的 约为7,可减少“硫化”步骤中
约为7,可减少“硫化”步骤中 的使用量,还能减少
的使用量,还能减少_______ (填化学式)污染物的生成。
(3)“硫化”步骤的主要目的是除去_______ (填离子符号)。
(4)根据 计算,若使溶液中
计算,若使溶液中 的含量低于排放标准,溶液的
的含量低于排放标准,溶液的 应大于
应大于_______ ,但是实际工艺流程需在“中和”步骤加 至溶液的
至溶液的 约为9,此时仍只有
约为9,此时仍只有 左右的铊离子能得到去除,其可能原因是
左右的铊离子能得到去除,其可能原因是_______ 。
(5)“离子交换”步骤中可用普鲁士蓝{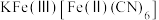 }(其摩尔质量为
}(其摩尔质量为 )中的
)中的 与残余铊离子进行离子交换,进一步实现废水中铊的去除。普鲁士蓝晶胞的
与残余铊离子进行离子交换,进一步实现废水中铊的去除。普鲁士蓝晶胞的 如下[
如下[ 未标出,占据四个互不相邻的小立方体(晶胞的
未标出,占据四个互不相邻的小立方体(晶胞的 部分)的体心]。
部分)的体心]。
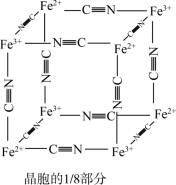
①普鲁士蓝晶胞中,Fe2+的配位数为_______ 。
②若该晶体的密度为 ,则
,则 和
和 的最短距离为
的最短距离为_______  (设
(设 为阿伏伽德罗常数的值)。
为阿伏伽德罗常数的值)。
 。废水除铊的工艺流程如下。
。废水除铊的工艺流程如下。
已知:①
 能够在pH为0~14的范围内以离子态稳定存在,不易与OH-形成沉淀
能够在pH为0~14的范围内以离子态稳定存在,不易与OH-形成沉淀②
 易与废水中的有机物分子形成稳定的配合物,为了简便,通常用
易与废水中的有机物分子形成稳定的配合物,为了简便,通常用 表示
表示③部分物质的

| 物质 |  |  |  |  |
 | 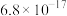 |  |  |  |
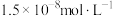
(1)已知“氧化”步骤中
 被还原为
被还原为 且
且 氧化不彻底,请写出该反应的离子方程式:
氧化不彻底,请写出该反应的离子方程式:(2)“预中和”步骤,加
 至溶液的
至溶液的 约为7,可减少“硫化”步骤中
约为7,可减少“硫化”步骤中 的使用量,还能减少
的使用量,还能减少(3)“硫化”步骤的主要目的是除去
(4)根据
 计算,若使溶液中
计算,若使溶液中 的含量低于排放标准,溶液的
的含量低于排放标准,溶液的 应大于
应大于 至溶液的
至溶液的 约为9,此时仍只有
约为9,此时仍只有 左右的铊离子能得到去除,其可能原因是
左右的铊离子能得到去除,其可能原因是(5)“离子交换”步骤中可用普鲁士蓝{
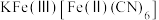 }(其摩尔质量为
}(其摩尔质量为 )中的
)中的 与残余铊离子进行离子交换,进一步实现废水中铊的去除。普鲁士蓝晶胞的
与残余铊离子进行离子交换,进一步实现废水中铊的去除。普鲁士蓝晶胞的 如下[
如下[ 未标出,占据四个互不相邻的小立方体(晶胞的
未标出,占据四个互不相邻的小立方体(晶胞的 部分)的体心]。
部分)的体心]。
①普鲁士蓝晶胞中,Fe2+的配位数为
②若该晶体的密度为
 ,则
,则 和
和 的最短距离为
的最短距离为 (设
(设 为阿伏伽德罗常数的值)。
为阿伏伽德罗常数的值)。
您最近一年使用:0次
名校
解题方法
7 . 一种制取电池级二氧化锰的工艺流程如下图:
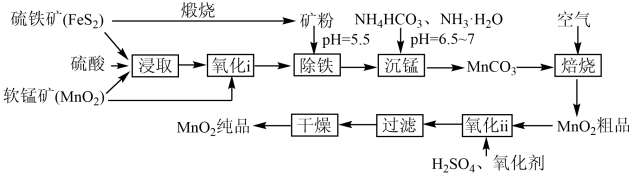
回答下列问题:
(1)“浸取”过程有硫单质生成,写出该过程中主要反应的化学方程式_______ 。
(2)“氧化ⅰ”过程软锰矿的作用是_______ 。“氧化ⅱ”过程中,将Mn(Ⅱ)转化为Mn(Ⅳ)的最适宜氧化剂是_______ (填标号)。
a. b.
b. c.
c.
(3)工业上煅烧硫铁矿产生的 气体可以用石灰乳吸收。常温下,测得
气体可以用石灰乳吸收。常温下,测得 与水形成的浊液pH为9,若忽略
与水形成的浊液pH为9,若忽略 的第二步水解,则
的第二步水解,则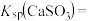
_______ (保留三位有效数字)[已知:室温下亚硫酸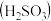 的电离平衡常数
的电离平衡常数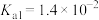 ,
, ]
]
(4)“沉锰”过程 转化为
转化为 的离子方程式为
的离子方程式为_______ 。在一定空气流速下,相同时间内“焙烧” ,产物中不同价态Mn的占比随热解温度的变化如图。“焙烧”过程中涉及如下化学反应:
,产物中不同价态Mn的占比随热解温度的变化如图。“焙烧”过程中涉及如下化学反应:
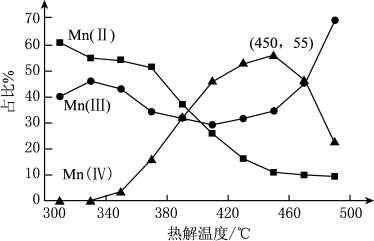
①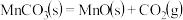
②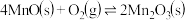

③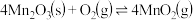

为了增大产物中 的占比,可以采用的措施是
的占比,可以采用的措施是_______ (答出两条)。将制备获得的电池级二氧化锰用于构建水系锌锰电池,其工作原理为: ,放电时正极的电极反应式为
,放电时正极的电极反应式为_______ 。
(5)用氧化还原法测定 纯品纯度(杂质不参与下列反应):称取
纯品纯度(杂质不参与下列反应):称取 样品0.1000g,试样经过过氧化钠碱熔后,得到
样品0.1000g,试样经过过氧化钠碱熔后,得到 溶液,配成溶液经加热煮沸除去过氧化物,酸化溶液,此时
溶液,配成溶液经加热煮沸除去过氧化物,酸化溶液,此时 歧化为
歧化为 和
和 ,过滤除去
,过滤除去 ,用
,用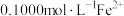 标准溶液滴定
标准溶液滴定 ,用去37.00mL,则样品中
,用去37.00mL,则样品中 的质量分数为
的质量分数为_______ (保留3位有效数字)。

回答下列问题:
(1)“浸取”过程有硫单质生成,写出该过程中主要反应的化学方程式
(2)“氧化ⅰ”过程软锰矿的作用是
a.
 b.
b. c.
c.
(3)工业上煅烧硫铁矿产生的
 气体可以用石灰乳吸收。常温下,测得
气体可以用石灰乳吸收。常温下,测得 与水形成的浊液pH为9,若忽略
与水形成的浊液pH为9,若忽略 的第二步水解,则
的第二步水解,则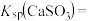
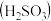 的电离平衡常数
的电离平衡常数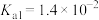 ,
, ]
](4)“沉锰”过程
 转化为
转化为 的离子方程式为
的离子方程式为 ,产物中不同价态Mn的占比随热解温度的变化如图。“焙烧”过程中涉及如下化学反应:
,产物中不同价态Mn的占比随热解温度的变化如图。“焙烧”过程中涉及如下化学反应:
①
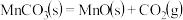
②
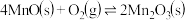

③
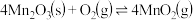

为了增大产物中
 的占比,可以采用的措施是
的占比,可以采用的措施是 ,放电时正极的电极反应式为
,放电时正极的电极反应式为(5)用氧化还原法测定
 纯品纯度(杂质不参与下列反应):称取
纯品纯度(杂质不参与下列反应):称取 样品0.1000g,试样经过过氧化钠碱熔后,得到
样品0.1000g,试样经过过氧化钠碱熔后,得到 溶液,配成溶液经加热煮沸除去过氧化物,酸化溶液,此时
溶液,配成溶液经加热煮沸除去过氧化物,酸化溶液,此时 歧化为
歧化为 和
和 ,过滤除去
,过滤除去 ,用
,用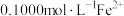 标准溶液滴定
标准溶液滴定 ,用去37.00mL,则样品中
,用去37.00mL,则样品中 的质量分数为
的质量分数为
您最近一年使用:0次
2022-04-29更新
|
1224次组卷
|
4卷引用:湖南省长沙市长沙县第一中学2021-2022学年高三下学期期中考试化学试题
湖南省长沙市长沙县第一中学2021-2022学年高三下学期期中考试化学试题山东省济宁市2022届高三第二次模拟考试化学试题湖北省武汉市第二中学2022届高三5月全仿真模拟考试(一)化学试题(已下线)微专题17 热点金属及其化合物制备流程(V、Cr、Mn、Co、Ni)-备战2023年高考化学一轮复习考点微专题
解题方法
8 . 合理利用废旧铅蓄电池可缓解铅资源短缺,同时减少污染。
Ⅰ.一种从废旧铅蓄电池的铅膏中回收铅的生产流程如图所示(部分产物已略去):

已知:①25℃时: ,
,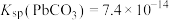 ;
;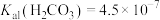 ,
,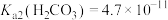 ;
;
② 和
和 均为能溶于水的强电解质。
均为能溶于水的强电解质。
(1)过程i中,物质a可以为_______ 和 的混合溶液(填标号)。
的混合溶液(填标号)。
A. B.
B. C.
C.
(2)25℃时,若过程ii发生反应后的母液中 ,
,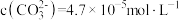 ,试通过计算判断“
,试通过计算判断“ ”中
”中_______ (填“有”或“无”) 固体,此溶液的pH约为
固体,此溶液的pH约为_______ 。
(3)过程iii发生反应的离子方程式为_______ 。
(4)过程iv阴极的电极反应式为_______ 。
Ⅱ.工业上用 、
、 混合溶液作电解液,用电解法实现粗铅(主要杂质为Cu、Ag、Fe、Zn,杂质总质量分数约为4%)提纯,装置示意图如图所示。
混合溶液作电解液,用电解法实现粗铅(主要杂质为Cu、Ag、Fe、Zn,杂质总质量分数约为4%)提纯,装置示意图如图所示。
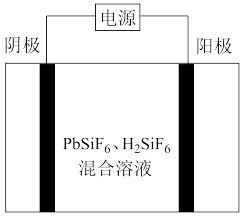
(5)电解产生的阳极泥的主要成分为_______ ,工作一段时间后,溶液中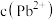
_______ (填“增大”“减小”或“不变”)。
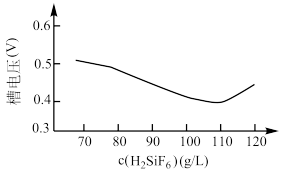
(6)铅的电解精炼需要调控好电解液中的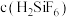 。其他条件相同时,测得槽电压(槽电压越小,对应铅产率越高)随起始时溶液中
。其他条件相同时,测得槽电压(槽电压越小,对应铅产率越高)随起始时溶液中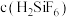 的变化趋势如图所示。由图可推知,随
的变化趋势如图所示。由图可推知,随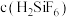 增大,铅产率先增大后减小,减小的原因可能是
增大,铅产率先增大后减小,减小的原因可能是_______ 。
Ⅰ.一种从废旧铅蓄电池的铅膏中回收铅的生产流程如图所示(部分产物已略去):

已知:①25℃时:
 ,
,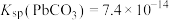 ;
;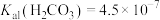 ,
,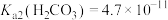 ;
;②
 和
和 均为能溶于水的强电解质。
均为能溶于水的强电解质。(1)过程i中,物质a可以为
 的混合溶液(填标号)。
的混合溶液(填标号)。A.
 B.
B. C.
C.
(2)25℃时,若过程ii发生反应后的母液中
 ,
,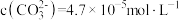 ,试通过计算判断“
,试通过计算判断“ ”中
”中 固体,此溶液的pH约为
固体,此溶液的pH约为(3)过程iii发生反应的离子方程式为
(4)过程iv阴极的电极反应式为
Ⅱ.工业上用
 、
、 混合溶液作电解液,用电解法实现粗铅(主要杂质为Cu、Ag、Fe、Zn,杂质总质量分数约为4%)提纯,装置示意图如图所示。
混合溶液作电解液,用电解法实现粗铅(主要杂质为Cu、Ag、Fe、Zn,杂质总质量分数约为4%)提纯,装置示意图如图所示。
(5)电解产生的阳极泥的主要成分为
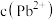
(6)铅的电解精炼需要调控好电解液中的
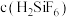 。其他条件相同时,测得槽电压(槽电压越小,对应铅产率越高)随起始时溶液中
。其他条件相同时,测得槽电压(槽电压越小,对应铅产率越高)随起始时溶液中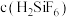 的变化趋势如图所示。由图可推知,随
的变化趋势如图所示。由图可推知,随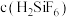 增大,铅产率先增大后减小,减小的原因可能是
增大,铅产率先增大后减小,减小的原因可能是
您最近一年使用:0次
名校
解题方法
9 . 湿法炼锌工业废水中主要阳离子有 。废水除铊的工艺流程如下。
。废水除铊的工艺流程如下。
① 能够在
能够在 为
为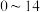 的范围内以离子态稳定存在,不易与
的范围内以离子态稳定存在,不易与 形成沉淀
形成沉淀
② 易与废水中的有机物分子形成稳定的配合物,为了简便,通常用
易与废水中的有机物分子形成稳定的配合物,为了简便,通常用 表示
表示
③部分物质的
④排放标准:Tl的含量低于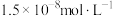
(1)已知“氧化”步骤中 被还原为
被还原为 且
且 氧化不彻底,请写出该反应的离子方程式:
氧化不彻底,请写出该反应的离子方程式:___________ 。
(2)“预中和”步骤,加 至溶液的
至溶液的 约为7,可减少“硫化”步骤中
约为7,可减少“硫化”步骤中 的使用量,还能减少
的使用量,还能减少___________ (填化学式)污染物的生成。
(3)“硫化”步骤的主要目的是除去___________ (填离子符号)。
(4)根据 计算,若使溶液中
计算,若使溶液中 的含量低于排放标准,溶液的
的含量低于排放标准,溶液的 应大于
应大于___________ ,但是实际工艺流程需在“中和”步骤加 至溶液的
至溶液的 约为9,此时仍只有
约为9,此时仍只有 左右的铊离子能得到去除,其可能原因是
左右的铊离子能得到去除,其可能原因是___________ 。
(5)“脱钙”步骤的目的是___________ 。
(6)“离子交换”步骤中可用普鲁士蓝{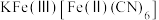 }(其摩尔质量为
}(其摩尔质量为 )中的
)中的 与残余铊离子进行离子交换,进一步实现废水中铊的去除。普鲁士蓝晶胞的
与残余铊离子进行离子交换,进一步实现废水中铊的去除。普鲁士蓝晶胞的 如下[
如下[ 未标出,占据四个互不相邻的小立方体(晶胞的
未标出,占据四个互不相邻的小立方体(晶胞的 部分)的体心]。若该晶体的密度为
部分)的体心]。若该晶体的密度为 ,则
,则 和
和 的最短距离为
的最短距离为___________  (设
(设 为阿伏伽德罗常数的值)。
为阿伏伽德罗常数的值)。
 。废水除铊的工艺流程如下。
。废水除铊的工艺流程如下。
①
 能够在
能够在 为
为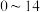 的范围内以离子态稳定存在,不易与
的范围内以离子态稳定存在,不易与 形成沉淀
形成沉淀②
 易与废水中的有机物分子形成稳定的配合物,为了简便,通常用
易与废水中的有机物分子形成稳定的配合物,为了简便,通常用 表示
表示③部分物质的

| 物质 |  |  |  |  |
 | 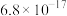 |  |  |  |
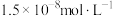
(1)已知“氧化”步骤中
 被还原为
被还原为 且
且 氧化不彻底,请写出该反应的离子方程式:
氧化不彻底,请写出该反应的离子方程式:(2)“预中和”步骤,加
 至溶液的
至溶液的 约为7,可减少“硫化”步骤中
约为7,可减少“硫化”步骤中 的使用量,还能减少
的使用量,还能减少(3)“硫化”步骤的主要目的是除去
(4)根据
 计算,若使溶液中
计算,若使溶液中 的含量低于排放标准,溶液的
的含量低于排放标准,溶液的 应大于
应大于 至溶液的
至溶液的 约为9,此时仍只有
约为9,此时仍只有 左右的铊离子能得到去除,其可能原因是
左右的铊离子能得到去除,其可能原因是(5)“脱钙”步骤的目的是
(6)“离子交换”步骤中可用普鲁士蓝{
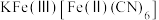 }(其摩尔质量为
}(其摩尔质量为 )中的
)中的 与残余铊离子进行离子交换,进一步实现废水中铊的去除。普鲁士蓝晶胞的
与残余铊离子进行离子交换,进一步实现废水中铊的去除。普鲁士蓝晶胞的 如下[
如下[ 未标出,占据四个互不相邻的小立方体(晶胞的
未标出,占据四个互不相邻的小立方体(晶胞的 部分)的体心]。若该晶体的密度为
部分)的体心]。若该晶体的密度为 ,则
,则 和
和 的最短距离为
的最短距离为 (设
(设 为阿伏伽德罗常数的值)。
为阿伏伽德罗常数的值)。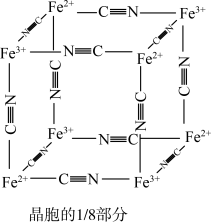
您最近一年使用:0次
2023-07-12更新
|
2338次组卷
|
6卷引用:湖南省长沙市长郡中学2024届高三高考适应性考试(二)化学试题
名校
解题方法
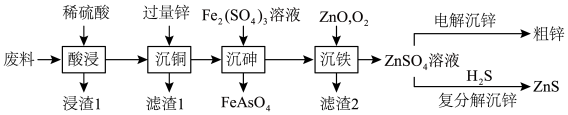
10 . ZnS常用于制造白色颜料、发光粉和发光油漆等。以火法炼铜的废料(主要成分是ZnO、CuO,含少量PbO、As2O3、SiO2等)为原料制备粗锌和硫化锌的流程如图:
请回答下列问题:
(1)“浸渣1”的主要成分是____ (填化学式)。
(2)从“滤渣1”中提取粗铜的操作是将滤渣1____ 、过滤、洗涤、干燥,得到粗铜。
(3)“沉铁”中O2的作用是____ (用离子方程式表示)。
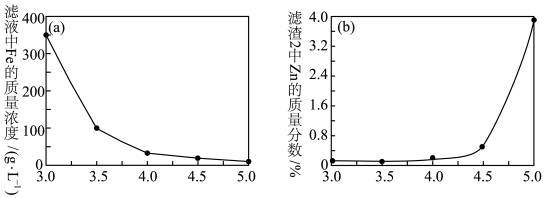
(4)加入ZnO调节溶液pH,滤液中Fe的质量浓度、滤渣2中Zn的质量分数与pH关系如图所示。最适宜的pH为____ 。
(5)以惰性材料为电极,“电解沉锌”的阳极反应式为____ 。
(6)“复分解沉锌”中,Zn2++H2S ZnS↓+2H+的平衡常数K=
ZnS↓+2H+的平衡常数K=____ 。[已知:常温下,Ksp(ZnS)=3.0×10-25,H2S的电离常数Ka1=9.0×10-8,Ka2=1.0×10-15]

请回答下列问题:
(1)“浸渣1”的主要成分是
(2)从“滤渣1”中提取粗铜的操作是将滤渣1
(3)“沉铁”中O2的作用是
(4)加入ZnO调节溶液pH,滤液中Fe的质量浓度、滤渣2中Zn的质量分数与pH关系如图所示。最适宜的pH为

(5)以惰性材料为电极,“电解沉锌”的阳极反应式为
(6)“复分解沉锌”中,Zn2++H2S
 ZnS↓+2H+的平衡常数K=
ZnS↓+2H+的平衡常数K=
您最近一年使用:0次



