名校
1 . 工业上用磷铁渣(主要含FeP、Fe2P,以及少量Fe2O3、SiO2等杂质)制备FePO4(磷酸铁)。
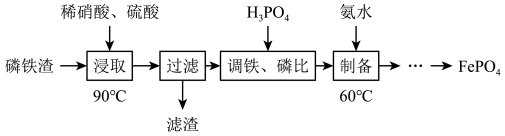
已知:FePO4难溶于水,能溶于无机强酸。
(1)“浸取”时为加速溶解,可以采取的措施有_____ (任写一种):加入硫酸的目的是_____ ;滤渣的主要成分是_____ 。
(2)“浸取”时Fe2P发生反应的离子方程式为______ 。
(3)“制备”过程中溶液的pH对磷酸铁产品中铁和磷的含量及n(Fe)/n(P)比值的影响如图所示[考虑到微量金属杂质,在pH=1时,n(Fe)/n(P)为0.973最接近理论值]。
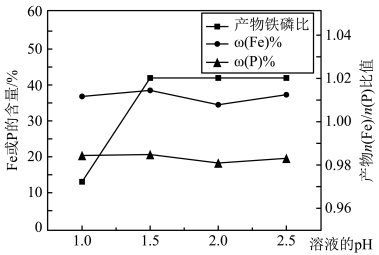
在pH范围为1~1.5时,随pH增大,n(Fe)/n(P)明显增大,其原因是_______ 。
(4)工业上也可以用电解磷铁渣的方法制备FePO4。
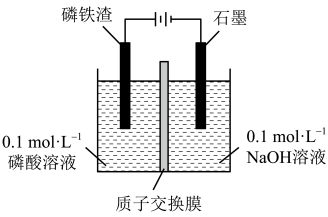
①FeP在阳极放电的电极反应式为_______ 。
②常温电解一段时间,测得溶液中Fe3+浓度约为0.32mol∙L-1,为了避免生成Fe(OH)3沉淀,应控制溶液的pH不大于_______ (已知:Ksp[Fe(OH)3]=4×10-38,lg2=0.3)。

已知:FePO4难溶于水,能溶于无机强酸。
(1)“浸取”时为加速溶解,可以采取的措施有
(2)“浸取”时Fe2P发生反应的离子方程式为
(3)“制备”过程中溶液的pH对磷酸铁产品中铁和磷的含量及n(Fe)/n(P)比值的影响如图所示[考虑到微量金属杂质,在pH=1时,n(Fe)/n(P)为0.973最接近理论值]。

在pH范围为1~1.5时,随pH增大,n(Fe)/n(P)明显增大,其原因是
(4)工业上也可以用电解磷铁渣的方法制备FePO4。

①FeP在阳极放电的电极反应式为
②常温电解一段时间,测得溶液中Fe3+浓度约为0.32mol∙L-1,为了避免生成Fe(OH)3沉淀,应控制溶液的pH不大于
您最近一年使用:0次
2022-04-12更新
|
240次组卷
|
2卷引用:湖南省湘潭市第一中学2022-2023学年高二下学期第一次月考化学试题
名校
解题方法
2 . 五氧化二钒( )广泛用于冶金、化工等行业,用作合金添加剂、生产硫酸或石油精炼用的催化剂等。从废钒催化剂(含有
)广泛用于冶金、化工等行业,用作合金添加剂、生产硫酸或石油精炼用的催化剂等。从废钒催化剂(含有 、
、 、
、 、
、 、
、 、
、 等)中回收钒,既能避免对环境的污染,又能节约宝贵的资源,回收工艺流程如下:
等)中回收钒,既能避免对环境的污染,又能节约宝贵的资源,回收工艺流程如下:
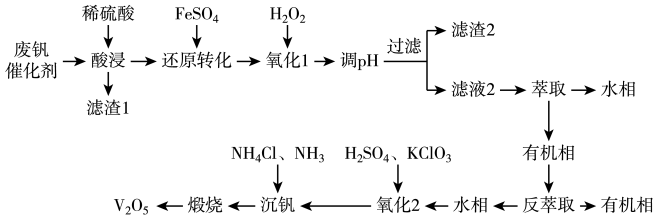
已知:
①“酸浸”时 和
和 与稀硫酸反应分别生成
与稀硫酸反应分别生成 和
和 。
。
②溶液中 与
与 可相互转化:
可相互转化: ,且
,且 为沉淀。
为沉淀。
(1)“酸浸”前,需对废钒催化剂进行粉碎预处理,其目的是___________ 。
(2)“还原转化”中加入 的目的是将
的目的是将 转化为
转化为 ,写出反应的离子方程式:
,写出反应的离子方程式:___________ 。
(3)加入 的目的是将过量的
的目的是将过量的 转化为
转化为 。“氧化1”后,溶液中含有的金属阳离子主要有
。“氧化1”后,溶液中含有的金属阳离子主要有 、
、 、
、 ,调节
,调节 使离子沉淀,若溶液中
使离子沉淀,若溶液中 ,则调节溶液的
,则调节溶液的 最小值为
最小值为___________ 可使 沉淀完全(离子浓度≤
沉淀完全(离子浓度≤ 时沉淀完全),此时
时沉淀完全),此时___________ (填“有”或“无”) 沉淀生成。{假设溶液体积不变,
沉淀生成。{假设溶液体积不变, ,
, ,
, }
}
(4)“氧化2”过程中发生反应的离子方程式为___________ 。
(5)“沉钒”时,通入氨气的作用是___________ 。
(6)若该废钒催化剂中 的含量为10%(原料中所有的钒已换算成
的含量为10%(原料中所有的钒已换算成 )。取100g待处理样品,按照上述流程进行实验。当加入
)。取100g待处理样品,按照上述流程进行实验。当加入 溶液时,溶液中的钒元素恰好完全反应,则该工艺中钒的回收率是
溶液时,溶液中的钒元素恰好完全反应,则该工艺中钒的回收率是___________ %(假设与 反应后的操作步骤中钒元素无损失)。
反应后的操作步骤中钒元素无损失)。
 )广泛用于冶金、化工等行业,用作合金添加剂、生产硫酸或石油精炼用的催化剂等。从废钒催化剂(含有
)广泛用于冶金、化工等行业,用作合金添加剂、生产硫酸或石油精炼用的催化剂等。从废钒催化剂(含有 、
、 、
、 、
、 、
、 、
、 等)中回收钒,既能避免对环境的污染,又能节约宝贵的资源,回收工艺流程如下:
等)中回收钒,既能避免对环境的污染,又能节约宝贵的资源,回收工艺流程如下:
已知:
①“酸浸”时
 和
和 与稀硫酸反应分别生成
与稀硫酸反应分别生成 和
和 。
。②溶液中
 与
与 可相互转化:
可相互转化: ,且
,且 为沉淀。
为沉淀。(1)“酸浸”前,需对废钒催化剂进行粉碎预处理,其目的是
(2)“还原转化”中加入
 的目的是将
的目的是将 转化为
转化为 ,写出反应的离子方程式:
,写出反应的离子方程式:(3)加入
 的目的是将过量的
的目的是将过量的 转化为
转化为 。“氧化1”后,溶液中含有的金属阳离子主要有
。“氧化1”后,溶液中含有的金属阳离子主要有 、
、 、
、 ,调节
,调节 使离子沉淀,若溶液中
使离子沉淀,若溶液中 ,则调节溶液的
,则调节溶液的 最小值为
最小值为 沉淀完全(离子浓度≤
沉淀完全(离子浓度≤ 时沉淀完全),此时
时沉淀完全),此时 沉淀生成。{假设溶液体积不变,
沉淀生成。{假设溶液体积不变, ,
, ,
, }
}(4)“氧化2”过程中发生反应的离子方程式为
(5)“沉钒”时,通入氨气的作用是
(6)若该废钒催化剂中
 的含量为10%(原料中所有的钒已换算成
的含量为10%(原料中所有的钒已换算成 )。取100g待处理样品,按照上述流程进行实验。当加入
)。取100g待处理样品,按照上述流程进行实验。当加入 溶液时,溶液中的钒元素恰好完全反应,则该工艺中钒的回收率是
溶液时,溶液中的钒元素恰好完全反应,则该工艺中钒的回收率是 反应后的操作步骤中钒元素无损失)。
反应后的操作步骤中钒元素无损失)。
您最近一年使用:0次
2022-03-22更新
|
1371次组卷
|
8卷引用:湖南省百所学校2021-2022学年高三3月联考化学试题
2022·江苏南通·模拟预测
名校
解题方法
3 . 实验小组以某铜渣(主要成分 、
、 ,含少量
,含少量 和
和 )为原料先制备硫酸铜,再由硫酸铜制备碱式碳酸铜[
)为原料先制备硫酸铜,再由硫酸铜制备碱式碳酸铜[ ]。实验包括如下过程:
]。实验包括如下过程:
(1)浸取。
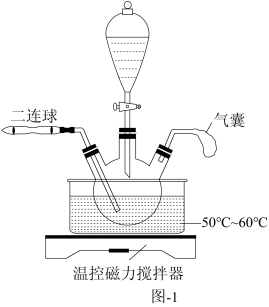
将一定量的铜渣粉碎后加入到如图-1所示的三颈烧瓶中,再通过分液漏斗分批滴入稀硝酸和稀硫酸混合溶液,滴加液体的间隔利用二连球鼓入O2,铜渣充分反应后,向溶液中加入少量 ,过滤。
,过滤。
①已知浸取时无S和SO2生成,写出浸取时 所发生反应的离子方程式:
所发生反应的离子方程式:_______ 。
②滴加液体的间隔向三颈烧瓶内鼓入O2的目的是_______ 。
③当观察到_______ ,可以停止鼓入O2。
④加入 的目的是
的目的是_______ 。[已知 ]
]
(2)制取 。
。
向滤液中加入 溶液调节
溶液调节 范围为
范围为_______ ,过滤;向滤渣中加入稀硫酸至滤渣恰好完全溶解,得 溶液。{设
溶液。{设 、
、 开始沉淀时
开始沉淀时 ,沉淀完全时
,沉淀完全时 。
。 ,
, }
}
(3)制 。
。
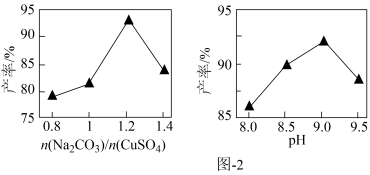
已知 的产率{
的产率{ }随起始
}随起始 与
与 的比值和溶液pH的关系如图2所示。
的比值和溶液pH的关系如图2所示。
①补充完整制取 的实验方案:向烧杯中加入
的实验方案:向烧杯中加入 溶液,将烧杯置于70℃的水浴中,
溶液,将烧杯置于70℃的水浴中,_______ ,低温烘干,得到 。(实验中可选用的试剂或仪器:
。(实验中可选用的试剂或仪器: 溶液、
溶液、 溶液、
溶液、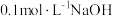 溶液、
溶液、 盐酸、pH计)
盐酸、pH计)
②实验时发现,若反应时溶液pH过大,所得 的产率偏低,但Cu元素含量偏大,原因是
的产率偏低,但Cu元素含量偏大,原因是_______ 。
 、
、 ,含少量
,含少量 和
和 )为原料先制备硫酸铜,再由硫酸铜制备碱式碳酸铜[
)为原料先制备硫酸铜,再由硫酸铜制备碱式碳酸铜[ ]。实验包括如下过程:
]。实验包括如下过程:(1)浸取。
将一定量的铜渣粉碎后加入到如图-1所示的三颈烧瓶中,再通过分液漏斗分批滴入稀硝酸和稀硫酸混合溶液,滴加液体的间隔利用二连球鼓入O2,铜渣充分反应后,向溶液中加入少量
 ,过滤。
,过滤。
①已知浸取时无S和SO2生成,写出浸取时
 所发生反应的离子方程式:
所发生反应的离子方程式:②滴加液体的间隔向三颈烧瓶内鼓入O2的目的是
③当观察到
④加入
 的目的是
的目的是 ]
](2)制取
 。
。向滤液中加入
 溶液调节
溶液调节 范围为
范围为 溶液。{设
溶液。{设 、
、 开始沉淀时
开始沉淀时 ,沉淀完全时
,沉淀完全时 。
。 ,
, }
}(3)制
 。
。已知
 的产率{
的产率{ }随起始
}随起始 与
与 的比值和溶液pH的关系如图2所示。
的比值和溶液pH的关系如图2所示。
①补充完整制取
 的实验方案:向烧杯中加入
的实验方案:向烧杯中加入 溶液,将烧杯置于70℃的水浴中,
溶液,将烧杯置于70℃的水浴中, 。(实验中可选用的试剂或仪器:
。(实验中可选用的试剂或仪器: 溶液、
溶液、 溶液、
溶液、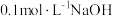 溶液、
溶液、 盐酸、pH计)
盐酸、pH计)②实验时发现,若反应时溶液pH过大,所得
 的产率偏低,但Cu元素含量偏大,原因是
的产率偏低,但Cu元素含量偏大,原因是
您最近一年使用:0次
2022-04-21更新
|
1251次组卷
|
3卷引用:湖南省常德市汉寿县第一中学2021-2022学年高三下学期4月月考化学试题
湖南省常德市汉寿县第一中学2021-2022学年高三下学期4月月考化学试题(已下线)江苏省南通市如皋市2021-2022学年高三下学期 4月适应性考试(二)化学试题江苏省响水中学2021-2022学年高二下学期第二次学情分析考试化学试题
名校
解题方法
4 . 第VA族元素在生产、生活中有重要用途。回答下列问题:
(1)三聚磷酸钠(俗称“五钠”常用于食品生产中,作水分保持剂、品质改良剂等。
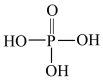
①磷酸的结构式如图所示,其主要的电离方程式为______________ 。
②三聚磷酸是三分子磷酸脱去两分子水后的产物,三聚磷酸钠的化学式为_______________ 。
(2)在碱性条件下,次磷酸盐(H2PO2-)可用于化学镀银,写出其反应的离子方程式______________ 。(氧化产物与还原产物物质的量之比为1:4)
(3)由工业白磷(含少量砷、铁、镁等)制备高纯白磷(熔点44℃,沸点280℃),主要生产流程如下:

①除砷过程在75 ℃下进行,其合理的原因是____________ (填字母代号)。
a,使白磷熔化,并溶于水 b.降低白磷的毒性
c.温度不宜过高,防止硝酸分解 d.适当提高温度,增大反应速率
②硝酸氧化除砷时被还原为NO,写出砷转化为亚砷酸的化学方程式:______________________________ 。
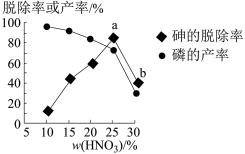
③某条件下,用一定量的硝酸处理一定量的工业白磷,砷的脱除率及磷的产率随硝酸质量分数的变化如图所示,砷的脱除率从a点到b点降低的原因是__________________ 。
(4)常温下银氨溶液中存在平衡:Ag+(aq) + 2NH3(aq) Ag(NH3)2+(aq),K=l.10×107 ;已知常温下Ksp(AgCl)=1.45×10-10计算可逆反应AgCl(s) +2NH3(aq)
Ag(NH3)2+(aq),K=l.10×107 ;已知常温下Ksp(AgCl)=1.45×10-10计算可逆反应AgCl(s) +2NH3(aq) Ag(NH3)2+(aq)+Cl-(aq)的化学平衡常数K=
Ag(NH3)2+(aq)+Cl-(aq)的化学平衡常数K=_________ (保留2位有效数字)。1L1mol/L氨水中最多可以溶解AgCl ______ mol(保留1位有效数字)。
(1)三聚磷酸钠(俗称“五钠”常用于食品生产中,作水分保持剂、品质改良剂等。
①磷酸的结构式如图所示,其主要的电离方程式为

②三聚磷酸是三分子磷酸脱去两分子水后的产物,三聚磷酸钠的化学式为
(2)在碱性条件下,次磷酸盐(H2PO2-)可用于化学镀银,写出其反应的离子方程式
(3)由工业白磷(含少量砷、铁、镁等)制备高纯白磷(熔点44℃,沸点280℃),主要生产流程如下:

①除砷过程在75 ℃下进行,其合理的原因是
a,使白磷熔化,并溶于水 b.降低白磷的毒性
c.温度不宜过高,防止硝酸分解 d.适当提高温度,增大反应速率
②硝酸氧化除砷时被还原为NO,写出砷转化为亚砷酸的化学方程式:
③某条件下,用一定量的硝酸处理一定量的工业白磷,砷的脱除率及磷的产率随硝酸质量分数的变化如图所示,砷的脱除率从a点到b点降低的原因是

(4)常温下银氨溶液中存在平衡:Ag+(aq) + 2NH3(aq)
 Ag(NH3)2+(aq),K=l.10×107 ;已知常温下Ksp(AgCl)=1.45×10-10计算可逆反应AgCl(s) +2NH3(aq)
Ag(NH3)2+(aq),K=l.10×107 ;已知常温下Ksp(AgCl)=1.45×10-10计算可逆反应AgCl(s) +2NH3(aq) Ag(NH3)2+(aq)+Cl-(aq)的化学平衡常数K=
Ag(NH3)2+(aq)+Cl-(aq)的化学平衡常数K=
您最近一年使用:0次
解题方法
5 . 钪( )是地壳中含量极少的稀土元素,在照明、合金和催化剂等领域有重要应用。钛铁矿的主要成分为
)是地壳中含量极少的稀土元素,在照明、合金和催化剂等领域有重要应用。钛铁矿的主要成分为 (可表示为
(可表示为 ),还含有少量
),还含有少量 等氧化物,从钛铁矿中提取
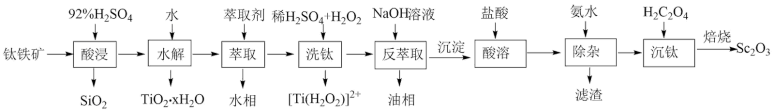
等氧化物,从钛铁矿中提取 的流程如下:
的流程如下:
已知:①当离子浓度减小至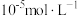 时可认为沉淀完全
时可认为沉淀完全
②室温下,溶液中离子沉淀完全的 如下表所示:
如下表所示:
③ ,
,
回答下列问题:
(1)“酸浸”后 元素转化为
元素转化为 ,其水解反应的化学方程式是
,其水解反应的化学方程式是___________ 。
(2)“萃取”时,使用 煤油作为萃取剂,一定条件下萃取率
煤油作为萃取剂,一定条件下萃取率 受振荡时间的影响如图,萃取时选择最佳的振荡时间为
受振荡时间的影响如图,萃取时选择最佳的振荡时间为___________  。
。
(3)“洗钛”所得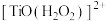 为橘黄色的稳定离子,
为橘黄色的稳定离子, 的作用是
的作用是___________ 。(写出两点)
(4)“酸溶”后滤液中存在的阳离子 浓度均小于
浓度均小于 “除杂”过程中应控制的
“除杂”过程中应控制的 范围是
范围是___________ 。
(5)“沉钪”后得到五水草酸钪,焙烧生成四种氧化物。其反应的化学方程式为___________ 。
 )是地壳中含量极少的稀土元素,在照明、合金和催化剂等领域有重要应用。钛铁矿的主要成分为
)是地壳中含量极少的稀土元素,在照明、合金和催化剂等领域有重要应用。钛铁矿的主要成分为 (可表示为
(可表示为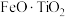 ),还含有少量
),还含有少量 等氧化物,从钛铁矿中提取
等氧化物,从钛铁矿中提取 的流程如下:
的流程如下:
已知:①当离子浓度减小至
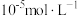 时可认为沉淀完全
时可认为沉淀完全②室温下,溶液中离子沉淀完全的
 如下表所示:
如下表所示:| 离子 |  |  |  |
沉淀完全的 | 3.2 | 9.0 | 1.05 |
 ,
,回答下列问题:
(1)“酸浸”后
 元素转化为
元素转化为 ,其水解反应的化学方程式是
,其水解反应的化学方程式是(2)“萃取”时,使用
 煤油作为萃取剂,一定条件下萃取率
煤油作为萃取剂,一定条件下萃取率 受振荡时间的影响如图,萃取时选择最佳的振荡时间为
受振荡时间的影响如图,萃取时选择最佳的振荡时间为 。
。
(3)“洗钛”所得
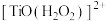 为橘黄色的稳定离子,
为橘黄色的稳定离子, 的作用是
的作用是(4)“酸溶”后滤液中存在的阳离子
 浓度均小于
浓度均小于 “除杂”过程中应控制的
“除杂”过程中应控制的 范围是
范围是(5)“沉钪”后得到五水草酸钪,焙烧生成四种氧化物。其反应的化学方程式为
您最近一年使用:0次
名校
解题方法
6 . 请回答下列问题。
(1)用重铬酸钾法(一种氧化还原滴定法)可测定产物Fe3O4中的二价铁含量。若需配制浓度为0.01000mol•L-1的K2Cr2O7标准溶液240mL,应准确称取K2Cr2O7的质量是___________ g[保留4位有效数字,已知M(K2Cr2O7)=294.0g•mol-1]。
(2)金属表面处理、皮革鞣制、印染等都可能造成铬污染。六价铬比三价铬毒性高,更易被人体吸收且在体内蓄积。工业上处理酸性含Cr2O 废水的方法如下:
废水的方法如下:
①向含Cr2O 的酸性废水中加入FeSO4溶液,使Cr2O
的酸性废水中加入FeSO4溶液,使Cr2O 全部转化为Cr3+。写出该反应的离子方程式:
全部转化为Cr3+。写出该反应的离子方程式:___________ 。
②调节溶液的pH,使Cr3+完全沉淀。实验室粗略测定溶液pH的方法为___________ ;25℃,若调节溶液的pH=8,则溶液中残余Cr3+的物质的量浓度为___________ mol/L。(已知25℃时,Ksp[Cr(OH)3]=6.3×10-31)
(3)Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定。
测定产品(Na2S2O3•5H2O)纯度
准确称取Wg产品,用适量蒸馏水溶解,以淀粉做指示剂,用0.1000mol/L碘的标准溶液滴定,反应原理为:2S2O +I2=S4O
+I2=S4O +2I-。
+2I-。
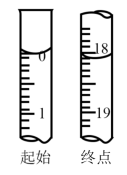
①滴定至终点时,溶液颜色的变化:由___________ 色变为___________ 色。
②滴定起始和终点的液面位置如图,则消耗点的标准溶液体积为18.10mL,产品的纯度为(设Na2S2O3•5H2O的相对分子质量为M)___________ 。
(1)用重铬酸钾法(一种氧化还原滴定法)可测定产物Fe3O4中的二价铁含量。若需配制浓度为0.01000mol•L-1的K2Cr2O7标准溶液240mL,应准确称取K2Cr2O7的质量是
(2)金属表面处理、皮革鞣制、印染等都可能造成铬污染。六价铬比三价铬毒性高,更易被人体吸收且在体内蓄积。工业上处理酸性含Cr2O
 废水的方法如下:
废水的方法如下:①向含Cr2O
 的酸性废水中加入FeSO4溶液,使Cr2O
的酸性废水中加入FeSO4溶液,使Cr2O 全部转化为Cr3+。写出该反应的离子方程式:
全部转化为Cr3+。写出该反应的离子方程式:②调节溶液的pH,使Cr3+完全沉淀。实验室粗略测定溶液pH的方法为
(3)Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定。
测定产品(Na2S2O3•5H2O)纯度
准确称取Wg产品,用适量蒸馏水溶解,以淀粉做指示剂,用0.1000mol/L碘的标准溶液滴定,反应原理为:2S2O
 +I2=S4O
+I2=S4O +2I-。
+2I-。
①滴定至终点时,溶液颜色的变化:由
②滴定起始和终点的液面位置如图,则消耗点的标准溶液体积为18.10mL,产品的纯度为(设Na2S2O3•5H2O的相对分子质量为M)
您最近一年使用:0次
7 . 磷化镉(Cd3P2)常用作杀虫剂。一种以镉铁矿(主要成分为CdO2,Fe2O3、FeO,还有少量的Al2O3和SiO2)为原料制备Cd3P2的工艺流程如图:

已知:25℃时,0.1mol·L-1相关金属离子形成氢氧化物沉淀的pH范围如表:
回答下列问题:
(1)镉铁矿“粉碎”的目的是___ 。
(2)“还原镉”时,产生能使澄清石灰水变浑浊的气体,发生反应的离子方程式为___ 。
(3)加入H2O2溶液的目的是___ 。
(4)“滤渣2”所含物质的化学式是____ 。
(5)工业生产中,有时采用阳离子交换树脂法来测定“聚沉”后溶液中Cd2+的含量,其原理是:Cd2++2NaR=2Na++CdR2,其中NaR为阳离子交换树脂。常温下,将“聚沉”后的溶液经过阳离子交换树脂后,测得溶液中的Na+比交换前增加了0.1104g·L-1,若该条件下Cd(OH)2的Ksp=2.4×10-15,此时“聚沉”后溶液的pH=__ 。
(6)电解制取Cd,Cd在____ (填“阳极”或“阴极”)析出,阳极反应式为___ 。

已知:25℃时,0.1mol·L-1相关金属离子形成氢氧化物沉淀的pH范围如表:
| 金属离子 | Fe3+ | Fe2+ | Al3+ | Cd2+ |
| 开始沉淀的pH | 1.7 | 6.3 | 3.1 | >7.0 |
| 沉淀完全的pH | 3.3 | 8.3 | 4.7 |
(1)镉铁矿“粉碎”的目的是
(2)“还原镉”时,产生能使澄清石灰水变浑浊的气体,发生反应的离子方程式为
(3)加入H2O2溶液的目的是
(4)“滤渣2”所含物质的化学式是
(5)工业生产中,有时采用阳离子交换树脂法来测定“聚沉”后溶液中Cd2+的含量,其原理是:Cd2++2NaR=2Na++CdR2,其中NaR为阳离子交换树脂。常温下,将“聚沉”后的溶液经过阳离子交换树脂后,测得溶液中的Na+比交换前增加了0.1104g·L-1,若该条件下Cd(OH)2的Ksp=2.4×10-15,此时“聚沉”后溶液的pH=
(6)电解制取Cd,Cd在
您最近一年使用:0次
名校
解题方法
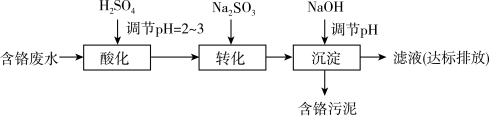
8 . 含铬电镀废水的主要成分如下表,常用“ 沉淀法”和“药剂还原沉淀法”进行处理。
沉淀法”和“药剂还原沉淀法”进行处理。
Ⅰ.“ 沉淀法”工艺流程如下图。
沉淀法”工艺流程如下图。
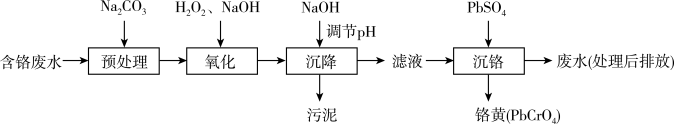
金属离子沉淀完全时( )及沉淀开始溶解时的pH如下。
)及沉淀开始溶解时的pH如下。
(1)“氧化”过程中 转化为
转化为 的离子方程式为
的离子方程式为_______ 。
(2)“沉降”过程中应调节pH范围是_______ ~10.5。
(3)已知25℃时 、
、 ;
;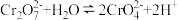 。“沉铬”过程中:
。“沉铬”过程中:
①生成铬黄的离子方程式为_______ 。
②从平衡角度分析pH对沉铬率的影响_______ 。
Ⅱ.“药剂还原沉淀法”工艺流程如下图。
(4)“还原”过程中, 被Cr(Ⅵ)氧化为
被Cr(Ⅵ)氧化为_______ 。
(5)比较“ 沉淀法”和“药剂还原沉淀法”工艺的优劣
沉淀法”和“药剂还原沉淀法”工艺的优劣_______ (写出一条即可)。
 沉淀法”和“药剂还原沉淀法”进行处理。
沉淀法”和“药剂还原沉淀法”进行处理。| 离子 | Cr(Ⅵ) |  |  |  |  |
含量/ | 28.38 | 12.92 | 0.34 | 0.069 | 0.014 |
Ⅰ.“
 沉淀法”工艺流程如下图。
沉淀法”工艺流程如下图。
金属离子沉淀完全时(
 )及沉淀开始溶解时的pH如下。
)及沉淀开始溶解时的pH如下。| 金属离子 |  |  |  |  |  | |
| pH | 沉淀完全 | 6.7 | 8.3 | 2.8 | 8.2 | 5.6 |
| 沉淀开始溶解 | - | 13.5 | 14.0 | 10.5 | 12.0 | |
(1)“氧化”过程中
 转化为
转化为 的离子方程式为
的离子方程式为(2)“沉降”过程中应调节pH范围是
(3)已知25℃时
 、
、 ;
;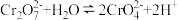 。“沉铬”过程中:
。“沉铬”过程中:①生成铬黄的离子方程式为
②从平衡角度分析pH对沉铬率的影响
Ⅱ.“药剂还原沉淀法”工艺流程如下图。

(4)“还原”过程中,
 被Cr(Ⅵ)氧化为
被Cr(Ⅵ)氧化为(5)比较“
 沉淀法”和“药剂还原沉淀法”工艺的优劣
沉淀法”和“药剂还原沉淀法”工艺的优劣
您最近一年使用:0次
2022-04-02更新
|
473次组卷
|
2卷引用:湖南省常德市澧县第一中学2021-2022学年高三下学期期中考试化学试题
名校
解题方法
9 . 从印刷电路板的腐蚀废液(主要含CuCl2、FeCl3、FeCl2等)中回收FeCl3、制备CuSO4·5H2O的流程如下。_______ 。
(2)粗品的主要成分是硫酸铜晶体,而不是硝酸铜晶体,分析有两种可能的原因:
①相对于Cu2+,粗液中 浓度过小,原因是
浓度过小,原因是_______ (用离子方程式表示),不能得到硝酸铜晶体。
②粗液中 浓度较大,但由于
浓度较大,但由于_______ ,不能得到硝酸铜晶体。
(3)测量粗品 中铁(含
中铁(含 、
、 )的含量,评定纯度等级。
)的含量,评定纯度等级。
Ⅰ.用水溶解一定质量粗品,加入稀 和
和 溶液,加热。
溶液,加热。
Ⅱ.待溶液冷却后,加入试剂X至溶液 。过滤、洗涤,得到红褐色沉淀。
。过滤、洗涤,得到红褐色沉淀。
Ⅲ.用稀 溶解红褐色沉淀,滴入
溶解红褐色沉淀,滴入 溶液,稀释至一定体积。将溶液红色的深浅与标准色阶对照,确定含量。
溶液,稀释至一定体积。将溶液红色的深浅与标准色阶对照,确定含量。
已知: 完全沉淀的pH为6.7,
完全沉淀的pH为6.7, 完全沉淀的pH为2.8
完全沉淀的pH为2.8
①Ⅰ中将 氧化为
氧化为 的离子方程式是
的离子方程式是_______ 。
②试剂X是_______ 。
(4)电解:在不同电压、不同pH(pH<7)条件下电解 溶液,研究
溶液,研究 溶液的再生条件。
溶液的再生条件。
( ,
, )
)
①iii中产生 的原因有
的原因有 、
、_______ 。
② 溶液再生的合适条件是
溶液再生的合适条件是_______ (填实验序号)。
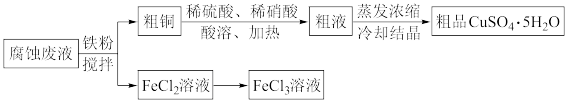
(2)粗品的主要成分是硫酸铜晶体,而不是硝酸铜晶体,分析有两种可能的原因:
①相对于Cu2+,粗液中
 浓度过小,原因是
浓度过小,原因是②粗液中
 浓度较大,但由于
浓度较大,但由于(3)测量粗品
 中铁(含
中铁(含 、
、 )的含量,评定纯度等级。
)的含量,评定纯度等级。Ⅰ.用水溶解一定质量粗品,加入稀
 和
和 溶液,加热。
溶液,加热。Ⅱ.待溶液冷却后,加入试剂X至溶液
 。过滤、洗涤,得到红褐色沉淀。
。过滤、洗涤,得到红褐色沉淀。Ⅲ.用稀
 溶解红褐色沉淀,滴入
溶解红褐色沉淀,滴入 溶液,稀释至一定体积。将溶液红色的深浅与标准色阶对照,确定含量。
溶液,稀释至一定体积。将溶液红色的深浅与标准色阶对照,确定含量。已知:
 完全沉淀的pH为6.7,
完全沉淀的pH为6.7, 完全沉淀的pH为2.8
完全沉淀的pH为2.8①Ⅰ中将
 氧化为
氧化为 的离子方程式是
的离子方程式是②试剂X是
(4)电解:在不同电压、不同pH(pH<7)条件下电解
 溶液,研究
溶液,研究 溶液的再生条件。
溶液的再生条件。| 序号 | 电压 |  | 阴极现象 | 阳极产物 |
| i |  | a | 无气泡,少量金属析出 | 无 ,有 ,有 |
| ii |  | b | 较多气泡,极少量金属析出 | 无 ,有 ,有 |
| iii |  | a | 少量气泡,少量金属析出, | 有 ,有 ,有 |
 ,
, )
)①iii中产生
 的原因有
的原因有 、
、②
 溶液再生的合适条件是
溶液再生的合适条件是
您最近一年使用:0次
2022-04-01更新
|
522次组卷
|
5卷引用:湖南省邵阳市新宁县第一中学2021-2022学年高三下学期期中考试化学试题
湖南省邵阳市新宁县第一中学2021-2022学年高三下学期期中考试化学试题北京市朝阳区2022届高三一模化学试题(已下线)三轮冲刺卷3-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(北京专用)福建省福州高级中学2023-2024学年高三第二次阶段考试化学试题北京市广渠门中学2023-2024学年高二下学期期中考试化学试题
10 . 电位滴定法是指在化学计量点附近,离子浓度发生突跃,指示电极电位也产生了突跃,进而确定滴定终点的方法。现用已知浓度的硝酸银标准溶液测定某工业纯碱样品中杂质NaCl(假设只此一种杂质)含量的滴定曲线如图所示。下列说法错误的是
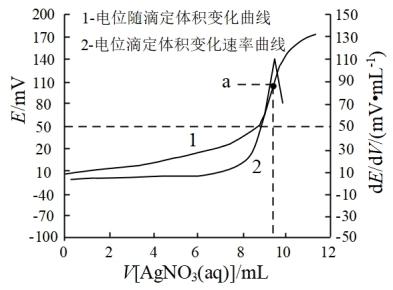

| A.a点是溶液中c(Ag+ )发生了突跃 |
B.Na2CO3溶液中存在:c( Na+) =c( HCO ) +c(CO ) +c(CO ) +c( H2CO3) ) +c( H2CO3) |
| C.a点后Ksp(AgCl)逐渐增大 |
| D.若样品质量已知,则可求得杂质NaCl的含量 |
您最近一年使用:0次



