名校
解题方法
1 . 请回答下列问题。
(1)用重铬酸钾法(一种氧化还原滴定法)可测定产物Fe3O4中的二价铁含量。若需配制浓度为0.01000mol•L-1的K2Cr2O7标准溶液240mL,应准确称取K2Cr2O7的质量是___________ g[保留4位有效数字,已知M(K2Cr2O7)=294.0g•mol-1]。
(2)金属表面处理、皮革鞣制、印染等都可能造成铬污染。六价铬比三价铬毒性高,更易被人体吸收且在体内蓄积。工业上处理酸性含Cr2O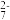 废水的方法如下:
废水的方法如下:
①向含Cr2O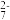 的酸性废水中加入FeSO4溶液,使Cr2O
的酸性废水中加入FeSO4溶液,使Cr2O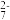 全部转化为Cr3+。写出该反应的离子方程式:
全部转化为Cr3+。写出该反应的离子方程式:___________ 。
②调节溶液的pH,使Cr3+完全沉淀。实验室粗略测定溶液pH的方法为___________ ;25℃,若调节溶液的pH=8,则溶液中残余Cr3+的物质的量浓度为___________ mol/L。(已知25℃时,Ksp[Cr(OH)3]=6.3×10-31)
(3)Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定。
测定产品(Na2S2O3•5H2O)纯度
准确称取Wg产品,用适量蒸馏水溶解,以淀粉做指示剂,用0.1000mol/L碘的标准溶液滴定,反应原理为:2S2O +I2=S4O
+I2=S4O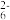 +2I-。
+2I-。
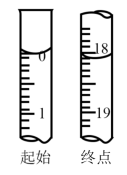
①滴定至终点时,溶液颜色的变化:由___________ 色变为___________ 色。
②滴定起始和终点的液面位置如图,则消耗点的标准溶液体积为18.10mL,产品的纯度为(设Na2S2O3•5H2O的相对分子质量为M)___________ 。
(1)用重铬酸钾法(一种氧化还原滴定法)可测定产物Fe3O4中的二价铁含量。若需配制浓度为0.01000mol•L-1的K2Cr2O7标准溶液240mL,应准确称取K2Cr2O7的质量是
(2)金属表面处理、皮革鞣制、印染等都可能造成铬污染。六价铬比三价铬毒性高,更易被人体吸收且在体内蓄积。工业上处理酸性含Cr2O
 废水的方法如下:
废水的方法如下:①向含Cr2O
 的酸性废水中加入FeSO4溶液,使Cr2O
的酸性废水中加入FeSO4溶液,使Cr2O 全部转化为Cr3+。写出该反应的离子方程式:
全部转化为Cr3+。写出该反应的离子方程式:②调节溶液的pH,使Cr3+完全沉淀。实验室粗略测定溶液pH的方法为
(3)Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定。
测定产品(Na2S2O3•5H2O)纯度
准确称取Wg产品,用适量蒸馏水溶解,以淀粉做指示剂,用0.1000mol/L碘的标准溶液滴定,反应原理为:2S2O
 +I2=S4O
+I2=S4O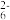 +2I-。
+2I-。
①滴定至终点时,溶液颜色的变化:由
②滴定起始和终点的液面位置如图,则消耗点的标准溶液体积为18.10mL,产品的纯度为(设Na2S2O3•5H2O的相对分子质量为M)
您最近一年使用:0次
解题方法
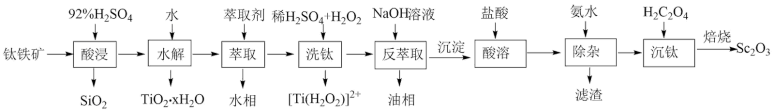
2 . 钪(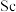 )是地壳中含量极少的稀土元素,在照明、合金和催化剂等领域有重要应用。钛铁矿的主要成分为
)是地壳中含量极少的稀土元素,在照明、合金和催化剂等领域有重要应用。钛铁矿的主要成分为 (可表示为
(可表示为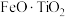 ),还含有少量
),还含有少量 等氧化物,从钛铁矿中提取
等氧化物,从钛铁矿中提取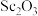 的流程如下:
的流程如下:
已知:①当离子浓度减小至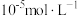 时可认为沉淀完全
时可认为沉淀完全
②室温下,溶液中离子沉淀完全的 如下表所示:
如下表所示:
③ ,
,
回答下列问题:
(1)“酸浸”后 元素转化为
元素转化为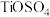 ,其水解反应的化学方程式是
,其水解反应的化学方程式是___________ 。
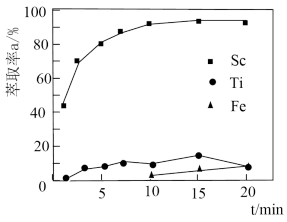
(2)“萃取”时,使用 煤油作为萃取剂,一定条件下萃取率
煤油作为萃取剂,一定条件下萃取率 受振荡时间的影响如图,萃取时选择最佳的振荡时间为
受振荡时间的影响如图,萃取时选择最佳的振荡时间为___________  。
。
(3)“洗钛”所得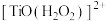 为橘黄色的稳定离子,
为橘黄色的稳定离子, 的作用是
的作用是___________ 。(写出两点)
(4)“酸溶”后滤液中存在的阳离子 浓度均小于
浓度均小于 “除杂”过程中应控制的
“除杂”过程中应控制的 范围是
范围是___________ 。
(5)“沉钪”后得到五水草酸钪,焙烧生成四种氧化物。其反应的化学方程式为___________ 。
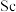 )是地壳中含量极少的稀土元素,在照明、合金和催化剂等领域有重要应用。钛铁矿的主要成分为
)是地壳中含量极少的稀土元素,在照明、合金和催化剂等领域有重要应用。钛铁矿的主要成分为 (可表示为
(可表示为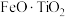 ),还含有少量
),还含有少量 等氧化物,从钛铁矿中提取
等氧化物,从钛铁矿中提取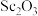 的流程如下:
的流程如下:
已知:①当离子浓度减小至
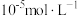 时可认为沉淀完全
时可认为沉淀完全②室温下,溶液中离子沉淀完全的
 如下表所示:
如下表所示:| 离子 |  |  |  |
沉淀完全的 | 3.2 | 9.0 | 1.05 |
 ,
,回答下列问题:
(1)“酸浸”后
 元素转化为
元素转化为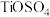 ,其水解反应的化学方程式是
,其水解反应的化学方程式是(2)“萃取”时,使用
 煤油作为萃取剂,一定条件下萃取率
煤油作为萃取剂,一定条件下萃取率 受振荡时间的影响如图,萃取时选择最佳的振荡时间为
受振荡时间的影响如图,萃取时选择最佳的振荡时间为 。
。
(3)“洗钛”所得
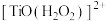 为橘黄色的稳定离子,
为橘黄色的稳定离子, 的作用是
的作用是(4)“酸溶”后滤液中存在的阳离子
 浓度均小于
浓度均小于 “除杂”过程中应控制的
“除杂”过程中应控制的 范围是
范围是(5)“沉钪”后得到五水草酸钪,焙烧生成四种氧化物。其反应的化学方程式为
您最近一年使用:0次
3 . 五氧化二钒常用于生产硫酸或石油精炼的催化剂。某化工厂从废钒催化剂中(含有K2SO4、V2O5、V2O4、SiO2、Fe2O3、Al2O3等)回收五氧化二钒和硫酸钾,既能避免环境污染,又能节约资源。回收工艺流程如下:

已知:①“酸浸”时V2O5和V2O4先与稀硫酸反应分别生成VO 和VO2+。
和VO2+。
②有机萃取剂萃取VO2+的能力比萃取VO 的能力强。
的能力强。
③溶液中VO 与VO
与VO 可相互转化:VO
可相互转化:VO +H2O
+H2O VO
VO +2H+。
+2H+。
(1)“酸浸”时,FeSO4的作用是___________ 。
(2)滤渣2的成分主要有___________ (填化学式)。
(3)“萃取”和“反萃取”时,将发生R2(SO4)n(水层)+2nHA(有机层) 2RAn(有机层)+nH2SO4(水层)(R表示VO2+,HA表示有机萃取剂),“反萃取”操作加入的试剂是
2RAn(有机层)+nH2SO4(水层)(R表示VO2+,HA表示有机萃取剂),“反萃取”操作加入的试剂是___________ (填化学式)。
(4)“氧化”过程中发生反应的离子方程式为___________ 。若该废钒催化剂中V2O5的含量为10%(原料中所有的钒已换算成V2O5)。该厂检验科实验室取100g待处理样品,按照上述流程进行实验。当加入150 mL 0.1 mol·L-1的KClO3溶液时,溶液中的钒元素恰好完全反应,则该工艺中钒的最大回收率是___________ %(假设与KClO3反应后的操作步骤中钒元素无损失)。
(5)沉钒率是回收钒的关键之一。
①“沉钒”时,钒元素主要以___________ 形式存在(填相应的离子符号)。
②实验发现,温度超过80℃以后沉钒率下降(如图),可能的原因是___________ 。


已知:①“酸浸”时V2O5和V2O4先与稀硫酸反应分别生成VO
 和VO2+。
和VO2+。②有机萃取剂萃取VO2+的能力比萃取VO
 的能力强。
的能力强。③溶液中VO
 与VO
与VO 可相互转化:VO
可相互转化:VO +H2O
+H2O VO
VO +2H+。
+2H+。(1)“酸浸”时,FeSO4的作用是
(2)滤渣2的成分主要有
(3)“萃取”和“反萃取”时,将发生R2(SO4)n(水层)+2nHA(有机层)
 2RAn(有机层)+nH2SO4(水层)(R表示VO2+,HA表示有机萃取剂),“反萃取”操作加入的试剂是
2RAn(有机层)+nH2SO4(水层)(R表示VO2+,HA表示有机萃取剂),“反萃取”操作加入的试剂是(4)“氧化”过程中发生反应的离子方程式为
(5)沉钒率是回收钒的关键之一。
①“沉钒”时,钒元素主要以
②实验发现,温度超过80℃以后沉钒率下降(如图),可能的原因是

您最近一年使用:0次
2021-05-11更新
|
276次组卷
|
3卷引用:湖南省株洲市九方中学2022届高三下学期第二次模拟考试化学试题
解题方法
4 . 如图为从预处理后的可充电电池粉末(主要为NiO、CdO、CoO和Fe2O3等)中回收重金属的工艺流程。

回答下列问题:
(1)“浸取”过程先加入NH4HCO3溶液,再通入NH3,滤液①中主要含[Cd(NH3)4]2+、[Ni(NH3)6]2+、[Co(NH3)6]2+及CO 。写出NiO浸取时发生反应的化学方程式:
。写出NiO浸取时发生反应的化学方程式:___ 。
(2)探究“催化氧化”步骤中[Co(NH3)6]2+氧化为[Co(NH3)6]3+的实验条件,向[Co(NH3)6]2+含量为0.48g·L-1的溶液中通入空气,待反应完全后,记录[Co(NH3)6]3+浓度数据如表:
由表中数据可得,[Co(NH3)6]2+氧化的最佳条件为___ 。
(3)已知Co(OH)3为强氧化剂,向Co(OH)3中加入浓盐酸发生“反应Ⅰ”,写出该反应的离子方程式:___ 。
(4)“反萃取”的原理为NiR有机+2H+ Ni2++2HR有机,需加入的试剂X为
Ni2++2HR有机,需加入的试剂X为___ ,分离有机相和水相的操作的名称为___ 。
(5)“水相①”的主要溶质为___ (填化学式)。
(6)生成CdCO3沉淀是利用反应[Cd(NH3)4]2++CO
 CdCO3↓+4NH3↑,常温下,该反应平衡常数K=2.0×105,[Cd(NH3)4]2+
CdCO3↓+4NH3↑,常温下,该反应平衡常数K=2.0×105,[Cd(NH3)4]2+ Cd2++4NH3的平衡常数K1= 4.0×10—5,则Ksp(CdCO3)=
Cd2++4NH3的平衡常数K1= 4.0×10—5,则Ksp(CdCO3)=___ 。

回答下列问题:
(1)“浸取”过程先加入NH4HCO3溶液,再通入NH3,滤液①中主要含[Cd(NH3)4]2+、[Ni(NH3)6]2+、[Co(NH3)6]2+及CO
 。写出NiO浸取时发生反应的化学方程式:
。写出NiO浸取时发生反应的化学方程式:(2)探究“催化氧化”步骤中[Co(NH3)6]2+氧化为[Co(NH3)6]3+的实验条件,向[Co(NH3)6]2+含量为0.48g·L-1的溶液中通入空气,待反应完全后,记录[Co(NH3)6]3+浓度数据如表:
| 反应时间 | [Co(NH3)6]3+/g·L-1 | |
| 25℃ | 50℃,石墨催化 | |
| 1.5h | 0.090 | 0.15 |
| 2.5h | 0.14 | 0.48 |
| 5h | 0.25 | 0.48 |
(3)已知Co(OH)3为强氧化剂,向Co(OH)3中加入浓盐酸发生“反应Ⅰ”,写出该反应的离子方程式:
(4)“反萃取”的原理为NiR有机+2H+
 Ni2++2HR有机,需加入的试剂X为
Ni2++2HR有机,需加入的试剂X为(5)“水相①”的主要溶质为
(6)生成CdCO3沉淀是利用反应[Cd(NH3)4]2++CO

 CdCO3↓+4NH3↑,常温下,该反应平衡常数K=2.0×105,[Cd(NH3)4]2+
CdCO3↓+4NH3↑,常温下,该反应平衡常数K=2.0×105,[Cd(NH3)4]2+ Cd2++4NH3的平衡常数K1= 4.0×10—5,则Ksp(CdCO3)=
Cd2++4NH3的平衡常数K1= 4.0×10—5,则Ksp(CdCO3)=
您最近一年使用:0次
名校
解题方法
5 . I.根据下列图象,进行分析:
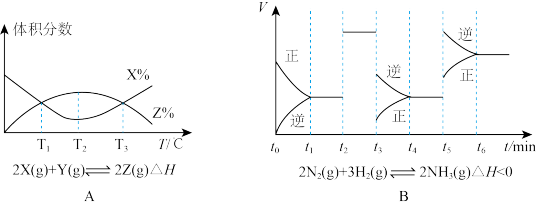
(1)由图A知,该反应的K值随温度的升高而_____ (填“增大”、“减小”或“不变”)。
(2)由图B知,t3时采取的措施为_____ ,t1~t6中,氨气的含量最低的是_____ 。
II.已知H2A在水中电离:H2A=HA-+H+,HA- A2-+H+。
A2-+H+。
(1)常温下NaHA溶液的pH__ (填序号)。
A.大于7 B.小于7 C.等于7 D.无法确定
(2)某温度下,若向0.1mol/L的NaHA溶液中逐滴滴加0.1mol/LKOH溶液至溶液呈中性(稀溶液体积可以加和),此时该混合溶液中的下列关系一定正确的是______ 。
A.c(H+)·c(OH-)=1×10-14 B.c(Na+)+c(K+)=c(HA-)+2c(A2-)
C.c(Na+)>c(K+) D.c(Na+)+c(K+)=0.05 mol/L
(3)已知常温下H2A的钙盐(CaA)的饱和溶液中存在以下平衡:CaA(s) Ca2+(aq)+A2-(aq)∆H>0。若要使该溶液中Ca2+浓度变小,可采取的措施有
Ca2+(aq)+A2-(aq)∆H>0。若要使该溶液中Ca2+浓度变小,可采取的措施有______ 。
A.升高温度 B.加入Na2A固体 C.加入NH4Cl晶体

(1)由图A知,该反应的K值随温度的升高而
(2)由图B知,t3时采取的措施为
II.已知H2A在水中电离:H2A=HA-+H+,HA-
 A2-+H+。
A2-+H+。(1)常温下NaHA溶液的pH
A.大于7 B.小于7 C.等于7 D.无法确定
(2)某温度下,若向0.1mol/L的NaHA溶液中逐滴滴加0.1mol/LKOH溶液至溶液呈中性(稀溶液体积可以加和),此时该混合溶液中的下列关系一定正确的是
A.c(H+)·c(OH-)=1×10-14 B.c(Na+)+c(K+)=c(HA-)+2c(A2-)
C.c(Na+)>c(K+) D.c(Na+)+c(K+)=0.05 mol/L
(3)已知常温下H2A的钙盐(CaA)的饱和溶液中存在以下平衡:CaA(s)
 Ca2+(aq)+A2-(aq)∆H>0。若要使该溶液中Ca2+浓度变小,可采取的措施有
Ca2+(aq)+A2-(aq)∆H>0。若要使该溶液中Ca2+浓度变小,可采取的措施有A.升高温度 B.加入Na2A固体 C.加入NH4Cl晶体
您最近一年使用:0次
解题方法
6 . 某工业废催化剂含有 SiO2、ZnO、CuS、ZnS、Fe3O4 等物质,为落实“节约资源,变 废为宝”的环保理念,某课外兴趣小组的同学取 20g 该物质进行实验,回收其中的 Cu 和 Zn,实验方案如下:

已知:ZnS 可与稀硫酸反应;CuS 不溶于稀硫酸,也不与其发生反应。 请回答下列问题:
(1)可用图装置进行第一次浸出,烧杯中盛放的是______ 溶液。

(2)滤液Ⅰ中的 Fe2+最好用______ 来检验。
a.氯水 b.双氧水 c.KSCN 溶液 d.K3[Fe(CN)6]溶液
(3)物质 A 是含有 X 元素的氧化物(XO),则 X 是______ (填元素符号),由滤液Ⅱ、Ⅳ滤液获得 ZnSO4•7H2O 的操作是______________ 。
(4)第二次浸出时的化学方程式为_______________ 。
(5)加 A 调节溶液的 pH 约为______ 时,可以完全除去其中的杂质离子。
(当溶液中离子浓度小于等于 10-5mol/L 时视为沉淀完全;实验条件下部分物质的溶度积常数为:Ksp[Fe(OH)3]=10-38,Ksp[Fe(OH)2]=10-17,Ksp[Zn(OH)2]=10-17,Ksp[Cu(OH)2]=10-20)
(6)实验最后获得了 5.74gZnSO4•7H2O 晶体(假设实验中没有损耗),但不能由此确定原催化剂中锌元素的质量分数,原因是_________________ 。

已知:ZnS 可与稀硫酸反应;CuS 不溶于稀硫酸,也不与其发生反应。 请回答下列问题:
(1)可用图装置进行第一次浸出,烧杯中盛放的是

(2)滤液Ⅰ中的 Fe2+最好用
a.氯水 b.双氧水 c.KSCN 溶液 d.K3[Fe(CN)6]溶液
(3)物质 A 是含有 X 元素的氧化物(XO),则 X 是
(4)第二次浸出时的化学方程式为
(5)加 A 调节溶液的 pH 约为
(当溶液中离子浓度小于等于 10-5mol/L 时视为沉淀完全;实验条件下部分物质的溶度积常数为:Ksp[Fe(OH)3]=10-38,Ksp[Fe(OH)2]=10-17,Ksp[Zn(OH)2]=10-17,Ksp[Cu(OH)2]=10-20)
(6)实验最后获得了 5.74gZnSO4•7H2O 晶体(假设实验中没有损耗),但不能由此确定原催化剂中锌元素的质量分数,原因是
您最近一年使用:0次
名校
解题方法
7 . 金属钛在航天、潜海和医疗方面应用广泛。以钛铁矿[主要成分为钛酸亚铁(FeTiO3),含少量Fe2O3]为原料制备钛的工艺流程如图所示。
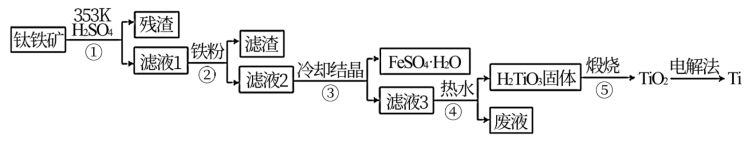
(1)步骤②、③、④中,均需进行的操作是_____________ (填操作名称)。
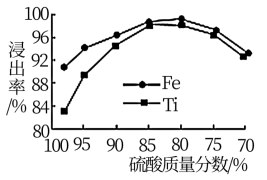
(2)滤液1中钛元素以TiO2+形式存在,步骤①中生成TiO2+的化学方程式为__________ ,硫酸质量分数对钛、铁浸出率的影响如图所示.据此判断,酸浸时所加硫酸的质量分数应为______ (填范围)。.
(3)请结合离子方程式解释步骤④中加热水的原因:__________ 。
(4)电解法制备Ti的装置是以石墨为阳极,TiO2为阴极,熔融CaO为电解质。Ti在_______ (填“阳极”或“阴极”)生成,____ (填“能”或“不能”)将熔融CaO换成石灰乳。
(5)以绿矾为原料,可以制备重要工业原料氧化铁,基本流程如下:

①绿矾溶液中离子浓度由大到小的顺序为__________ 。
②FeCO3达到沉淀溶解平衡时,室温下测得溶液的pH为8,c(Fe2+ )=1.0×10-5 mol·L-1。所得FeCO3中_____ (填“含”或“不含”)有Fe(OH)2。已知: {Ksp[Fe(OH)2]= 4.9×10-17}

(1)步骤②、③、④中,均需进行的操作是
(2)滤液1中钛元素以TiO2+形式存在,步骤①中生成TiO2+的化学方程式为

(3)请结合离子方程式解释步骤④中加热水的原因:
(4)电解法制备Ti的装置是以石墨为阳极,TiO2为阴极,熔融CaO为电解质。Ti在
(5)以绿矾为原料,可以制备重要工业原料氧化铁,基本流程如下:

①绿矾溶液中离子浓度由大到小的顺序为
②FeCO3达到沉淀溶解平衡时,室温下测得溶液的pH为8,c(Fe2+ )=1.0×10-5 mol·L-1。所得FeCO3中
您最近一年使用:0次
2020-03-25更新
|
511次组卷
|
5卷引用:湖南省2020年3月线上联考理科综合化学试题
名校
8 . 下列实验能达到预期目的的是
| 实验内容 | 实验目的 | |
| A | 把甲烷和乙烯分别在空气中点燃,乙烯火焰明亮且伴有黑烟 | 证明乙烯中碳的百分含量比甲烷高 |
| B | 向含有酚酞的Na2CO3溶液中加入少量BaC12固体,溶液红色变浅 | 证明Na2CO3溶液中存在水解平衡 |
| C | 向10mL0.2mol/LNaOH溶液中滴加2滴0.1mol/LMgCl2溶液,产生白色沉淀后,再滴加2滴0.1mol/LFeCl3溶液,又生成红褐色沉淀 | 证明在相同温度下的Ksp: Mg(OH)2>Fe(OH)3 |
| D | 分别测定室温下等物质的量浓度的Na2SO3与Na2CO3溶液的pH,后者较大 | 证明非金属性:S>C |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2021-09-15更新
|
280次组卷
|
4卷引用:湖南省邵阳市第二中学2021-2022学年高二上学期期中考试化学试题
名校
解题方法
9 . 稀土是一种重要的战略资源。氟碳铈矿主要化学成分为CeFCO3,它是提取铈等稀土元素的重要矿物原料。氟碳铈矿的冶炼工艺流程如下:
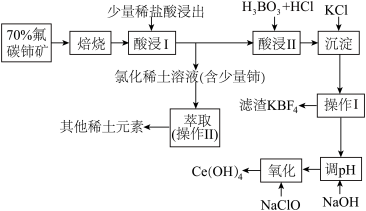
已知:铈的常见化合价为+3、+4。焙烧后铈元素转化成CeO2和CeF4。四价铈不易进入溶液,而三价稀土元素易进入溶液;
酸浸II中发生反应:
9CeO2+3CeF4+45HCl+3H3BO3=Ce(BF4)3↓+11CeCl3+6Cl2↑+27H2O;c(Ce3+)≤10-5 mol/L 时,完全沉淀。
请回答下列问题:
(1)①焙烧时先要将氟碳C矿粉碎,目的是___________ 。
②焙烧后产生的CeO2是汽车尾气净化催化剂的关键成分,它能在还原气氛中供氧,在氧化气氛中耗氧。在尾气消除过程中发生着CeO2 CeO2(1-x)+xO2↑的循环。写出CeO2消除CO尾气的化学方程式:
CeO2(1-x)+xO2↑的循环。写出CeO2消除CO尾气的化学方程式:________ 。
(2)在酸浸I中用盐酸浸出时,有少量铈进入滤液,且产生黄绿色气体。 少量铈由CeO2进入稀土溶液发生反应的离子方程式是_______ 。
(3)向Ce(BF4)3中加入KCl溶液的目的是_________ 。
(4)操作I的名称为_________ ,在实验室中进行操作II时所需要的硅酸盐仪器有_______ 。
(5)“操作I”后,向溶液中加入NaOH溶液来调节溶液的pH,以获得Ce(OH)3沉淀,常温下加入NaOH调节溶液的 pH应大于______ 即可认为Ce3+已完全沉淀。{已知:Ksp[Ce(OH)3]=1.0 ×10-20}
(6)取上述流程中得到的Ce(OH)4产品5.00g,加酸溶解后,向其中加入含0.033 00 mol FeSO4的FeSO4溶液使Ce4+全部被还原成Ce3+,再用0.100 0mol/L的酸性KMnO4标准溶液滴定至终点时,平均消耗20.00 mL标准溶液。则该产品中Ce(OH)4的质量分数为______ (保留2位小数,已知氧化性:Ce4+ >KMnO4;Ce(OH)4的相对分子质量为208)

已知:铈的常见化合价为+3、+4。焙烧后铈元素转化成CeO2和CeF4。四价铈不易进入溶液,而三价稀土元素易进入溶液;
酸浸II中发生反应:
9CeO2+3CeF4+45HCl+3H3BO3=Ce(BF4)3↓+11CeCl3+6Cl2↑+27H2O;c(Ce3+)≤10-5 mol/L 时,完全沉淀。
请回答下列问题:
(1)①焙烧时先要将氟碳C矿粉碎,目的是
②焙烧后产生的CeO2是汽车尾气净化催化剂的关键成分,它能在还原气氛中供氧,在氧化气氛中耗氧。在尾气消除过程中发生着CeO2
 CeO2(1-x)+xO2↑的循环。写出CeO2消除CO尾气的化学方程式:
CeO2(1-x)+xO2↑的循环。写出CeO2消除CO尾气的化学方程式:(2)在酸浸I中用盐酸浸出时,有少量铈进入滤液,且产生黄绿色气体。 少量铈由CeO2进入稀土溶液发生反应的离子方程式是
(3)向Ce(BF4)3中加入KCl溶液的目的是
(4)操作I的名称为
(5)“操作I”后,向溶液中加入NaOH溶液来调节溶液的pH,以获得Ce(OH)3沉淀,常温下加入NaOH调节溶液的 pH应大于
(6)取上述流程中得到的Ce(OH)4产品5.00g,加酸溶解后,向其中加入含0.033 00 mol FeSO4的FeSO4溶液使Ce4+全部被还原成Ce3+,再用0.100 0mol/L的酸性KMnO4标准溶液滴定至终点时,平均消耗20.00 mL标准溶液。则该产品中Ce(OH)4的质量分数为
您最近一年使用:0次
10 . 氯化钴是治疗障碍性贫血药物的主要成分之一。下面是从海绵钴(含有少量Fe、Ni)中制备氯化钴晶体的工艺流程:
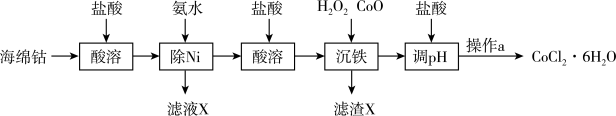
已知:①Co、Ni溶于盐酸均生成+2价金属阳离子;②Ni2+溶于氨水生成[Ni(NH3)6]2+离子。
回答下列问题:
(1)为提高海绵钴的溶浸率,可以采用的措施有_________ (写出一条即可)。
(2)写出“除Ni”时发生的离子反应方程式:__________ 。
(3)研究发现,“除Ni”步骤中,NH3·H2O用量对反应收率的影响有如下关系:
“除Ni”时,pH=_________ 时,效果最好。
(4)“沉铁”步骤中,加入H2O2时发生的离子反应为________ ;加入CoO的目的是_________ 。
(5)已知25℃时,若Ksp[Fe(OH)3]=1.0×10-38,离子浓度小于或等于1.0×10-5 mol/L时表示完全沉淀,则该温度下Fe3+完全沉淀时pH=______ 。
(6)操作a的实验步骤为________ 。
(7)将CoCl2·6H2O晶体在HCl氛围下加热,所得样品的固体残留率(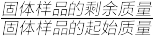 ×100%)随温度的变化如下图所示。
×100%)随温度的变化如下图所示。
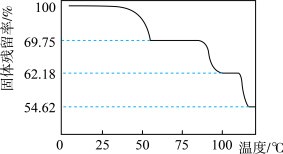
则当固体残留率为62.18%时,所得固体的化学式为_______ 。

已知:①Co、Ni溶于盐酸均生成+2价金属阳离子;②Ni2+溶于氨水生成[Ni(NH3)6]2+离子。
回答下列问题:
(1)为提高海绵钴的溶浸率,可以采用的措施有
(2)写出“除Ni”时发生的离子反应方程式:
(3)研究发现,“除Ni”步骤中,NH3·H2O用量对反应收率的影响有如下关系:
加入氨水,调节pH | 收率/% | Ni2+含量/% |
9 | 98.1 | 0.08 |
9.5 | 98 | 0.05 |
10 | 97.6 | 0.005 |
10.3 | 94 | 0.005 |
(4)“沉铁”步骤中,加入H2O2时发生的离子反应为
(5)已知25℃时,若Ksp[Fe(OH)3]=1.0×10-38,离子浓度小于或等于1.0×10-5 mol/L时表示完全沉淀,则该温度下Fe3+完全沉淀时pH=
(6)操作a的实验步骤为
(7)将CoCl2·6H2O晶体在HCl氛围下加热,所得样品的固体残留率(
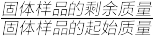 ×100%)随温度的变化如下图所示。
×100%)随温度的变化如下图所示。
则当固体残留率为62.18%时,所得固体的化学式为
您最近一年使用:0次



