1 . 银是一种贵金属,古代常用于制造钱币及装饰器皿,现代在电池和照明器材等领域亦有广泛应用。回答下列问题。
(1)久存的银制器皿表面会变黑,失去银白色的光泽,原因是_________ 。
(2)已知Ksp(AgCl)=1.8×10-10,若向50mL0.018mol·L-1的AgNO3溶液中加入50mL0.020mol·L-1的盐酸,混合后溶液中的Ag+的浓度为_________ mol·L-1,pH为_________ 。
(3)AgNO3溶液光照易分解,生成Ag和红棕色气体等物质,其光照分解的化学方程式为_________ 。
(4)右图所示原电池正极的反应式为_________ 。
(1)久存的银制器皿表面会变黑,失去银白色的光泽,原因是
(2)已知Ksp(AgCl)=1.8×10-10,若向50mL0.018mol·L-1的AgNO3溶液中加入50mL0.020mol·L-1的盐酸,混合后溶液中的Ag+的浓度为
(3)AgNO3溶液光照易分解,生成Ag和红棕色气体等物质,其光照分解的化学方程式为
(4)右图所示原电池正极的反应式为

您最近一年使用:0次
2019-01-30更新
|
1060次组卷
|
2卷引用:2015年全国普通高等学校招生统一考试理科综合能力测试化学(海南卷)
2 . 合金是建筑航空母舰的主体材料。
(1)航母升降机可由铝合金制造。
①铝元素在周期表中的位置是_______________________ 。工业炼铝的原料由铝土矿提取而得,提取过程中通入的气体为__________ 。
②Al—Mg合金焊接前用NaOH溶液处理Al2O3膜,其化学方程式为_________________________ 。焊接过程中使用的保护气为______ (填化学式)。
(2)航母舰体材料为合金钢。
①舰体在海水中发生的电化学腐蚀主要为________________________________ 。
②航母用钢可由低硅生铁冶炼而成,则在炼铁过程中为降低硅含量需加入的物质为_________________ 。
(3)航母螺旋桨主要用铜合金制造。
①80.0gCu-Al合金用酸完全溶解后,加入过量氨水,过滤得到白色沉淀39.0,则合金中Cu的质量分数为_________ 。
②为分析某铜合金的成分,用酸将其完全溶解后,用NaOH溶液调节pH,当pH=3.4时开始出现沉淀,分别在pH为7.0、8.0时过滤沉淀。结合如图信息推断该合金中除铜外一定含有_________ 。
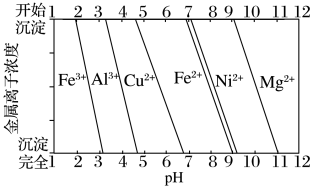
(1)航母升降机可由铝合金制造。
①铝元素在周期表中的位置是
②Al—Mg合金焊接前用NaOH溶液处理Al2O3膜,其化学方程式为
(2)航母舰体材料为合金钢。
①舰体在海水中发生的电化学腐蚀主要为
②航母用钢可由低硅生铁冶炼而成,则在炼铁过程中为降低硅含量需加入的物质为
(3)航母螺旋桨主要用铜合金制造。
①80.0gCu-Al合金用酸完全溶解后,加入过量氨水,过滤得到白色沉淀39.0,则合金中Cu的质量分数为
②为分析某铜合金的成分,用酸将其完全溶解后,用NaOH溶液调节pH,当pH=3.4时开始出现沉淀,分别在pH为7.0、8.0时过滤沉淀。结合如图信息推断该合金中除铜外一定含有

您最近一年使用:0次
2016-12-09更新
|
1205次组卷
|
5卷引用:2013年全国普通高等学校招生统一考试理科综合能力测试化学(重庆卷)
2013年全国普通高等学校招生统一考试理科综合能力测试化学(重庆卷)(已下线)2014届高考化学二轮复习必做训练 元素及其化合物练习卷2017届陕西省西安一中高三上期中化学试卷(已下线)2019高考热点题型和提分秘籍 第三章 金属及其化合物 第4讲 金属材料与矿物 铜及其化合物 (题型专练)(已下线)第5单元 常见的金属元素(A卷 基础过关检测)-2021年高考化学一轮复习单元滚动双测卷
3 . 二氧化氯(ClO2)是一种高效、广谱、安全的杀菌、消毒剂。
(1)氯化钠电解法是一种可靠的工业生产ClO2方法。
①用于电解的食盐水需先除去其中的Ca2+、Mg2+、SO42-等杂质。其次除杂操作时,往粗盐水中先加入过量的________ (填化学式),至沉淀不再产生后,再加入过量的Na2CO3和NaOH,充分反应后将沉淀一并滤去。经检测发现滤液中仍含有一定量的SO42-,其原因是___________ 【已知:Ksp(BaSO4)= 1.1 ×10-10 Ksp(BaCO3)= 5.1 ×10-9】
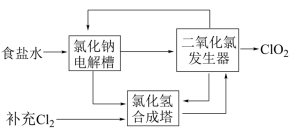
②该法工艺原理如右。其过程是将食盐水在特定条件下电解得到的氯酸钠(NaClO3)与盐酸反应生成ClO2。
工艺中可以利用的单质有____________ (填化学式),发生器中生成ClO2的化学方程式为___________ 。
(2)纤维素还原法制ClO2是一种新方法,其原理是:纤维素水解得到的最终产物D与NaClO3反应生成ClO2。完成反应的化学方程式:
□ (D) +24NaClO3+12H2SO4=□ClO2↑+□CO2↑+18H2O+□_________
(3)ClO2和Cl2均能将电镀废水中的CN-氧化为无毒的物质,自身被还原为Cl-。处理含CN-相同量得电镀废水,所需Cl2的物质的量是ClO2的_______ 倍
(1)氯化钠电解法是一种可靠的工业生产ClO2方法。
①用于电解的食盐水需先除去其中的Ca2+、Mg2+、SO42-等杂质。其次除杂操作时,往粗盐水中先加入过量的

②该法工艺原理如右。其过程是将食盐水在特定条件下电解得到的氯酸钠(NaClO3)与盐酸反应生成ClO2。
工艺中可以利用的单质有
(2)纤维素还原法制ClO2是一种新方法,其原理是:纤维素水解得到的最终产物D与NaClO3反应生成ClO2。完成反应的化学方程式:
□ (D) +24NaClO3+12H2SO4=□ClO2↑+□CO2↑+18H2O+□
(3)ClO2和Cl2均能将电镀废水中的CN-氧化为无毒的物质,自身被还原为Cl-。处理含CN-相同量得电镀废水,所需Cl2的物质的量是ClO2的
您最近一年使用:0次
2016-12-09更新
|
1350次组卷
|
3卷引用:2013年全国普通高等学校招生统一考试理科综合能力测试化学(福建卷)
2013年全国普通高等学校招生统一考试理科综合能力测试化学(福建卷)(已下线)练习9 电解池-2020-2021学年【补习教材·寒假作业】高二化学(人教版2019)湖南省邵阳市第二中学2022-2023学年高三上学期第五次月考化学试题
真题
名校
4 . 已知:I2+2S2O32-=S4O62-+2I-
相关物质的溶度积常数见下表:
(1)某酸性CuCl2溶液中含有少量的FeCl3 ,为得到纯净的CuCl2.H2O 晶体,加入______ ,调至pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=_______ 。过滤后,将所得滤液低温蒸发、浓缩结晶,可得到CuCl2.H2O晶体。
(2)在空气中直接加热CuCl2.H2O晶体得不到纯的无水CuCl2,原因是__________ (用化学方程式表示)。由CuCl2.H2O晶体得到纯的无水CuCl2的合理方法是_____________ 。
(3)某学习小组用“间接碘量法”测定含有CuCl2.H2O的试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下:取0.36g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀。用0.1000mol/LNa2S2O3标准溶液20.00mL。
①可选用______ 作滴定指示剂,滴定终点的现象是__________ 。
②CuCl2溶液与KI反应的离子方程式为__________ 。
③该试样中CuCl2·H2O的质量百分数为_______ 。
相关物质的溶度积常数见下表:
| 物质 | Cu(OH)2 | Fe(OH)3 | CuCl2 | CuI |
| Ksp | 2.2×10-20 | 2.6×10-39 | 1.7×10-7 | 1.3×10-12 |
(2)在空气中直接加热CuCl2.H2O晶体得不到纯的无水CuCl2,原因是
(3)某学习小组用“间接碘量法”测定含有CuCl2.H2O的试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下:取0.36g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀。用0.1000mol/LNa2S2O3标准溶液20.00mL。
①可选用
②CuCl2溶液与KI反应的离子方程式为
③该试样中CuCl2·H2O的质量百分数为
您最近一年使用:0次
2016-12-09更新
|
1463次组卷
|
6卷引用:2012年普通高等学校招生全国统一考试化学(浙江卷)
2012年普通高等学校招生全国统一考试化学(浙江卷)(已下线)2012-2013学年吉林省长春市十一高中高二上学期期末考试化学试卷2015-2016学年福建省泉州市四校高二上学期期末化学试卷辽宁省庄河市高级中学2017-2018学年高二上学期期中考试化学试题甘肃省镇原县二中2018-2019学年高二上学期期末考试化学试题(已下线)专题18.化学计算-十年(2012-2021)高考化学真题分项汇编(浙江专用)
真题
解题方法
5 . 羟基磷灰石[Ca5(PO4)3OH]是一种重要的生物无机材料。其常用的制备方法有两种:
方法A:用浓氨水分别调Ca(NO3)2和(NH4)2HPO4溶液的pH约为12;在剧烈搅拌下,将(NH4)2HPO4溶液缓慢滴入Ca(NO3)2溶液中。
方法B:剧烈搅拌下,将H3PO4溶液缓慢滴加到Ca(OH)2悬浊液中。
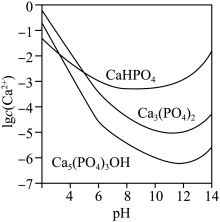
3种钙盐的溶解度随溶液pH的变化如上图所示(图中纵坐标是钙离子浓度的对数),回答下列问题:
(1)完成方法A和方法B中制备Ca5(PO4)3OH的化学反应方程式:
①5Ca(NO3)2+3(NH4)2HPO4+4NH3·H2O=Ca5(PO4)3OH↓+________ +________
②5Ca(OH)2+3H3PO4=________________________________________________
(2)与方法A相比,方法B的优点是______________________________________ 。
(3)方法B中,如果H3PO4溶液滴加过快,制得的产物不纯,其原因是
___________________________________________________________________________ 。
(4)图中所示3种钙盐在人体中最稳定的存在形式是______________ (填化学式)。
(5)糖沾附在牙齿上,在酶的作用下产生酸性物质,易造成龋齿。结合化学平衡移动原理,分析其原因________________________________________________________ 。
方法A:用浓氨水分别调Ca(NO3)2和(NH4)2HPO4溶液的pH约为12;在剧烈搅拌下,将(NH4)2HPO4溶液缓慢滴入Ca(NO3)2溶液中。
方法B:剧烈搅拌下,将H3PO4溶液缓慢滴加到Ca(OH)2悬浊液中。

3种钙盐的溶解度随溶液pH的变化如上图所示(图中纵坐标是钙离子浓度的对数),回答下列问题:
(1)完成方法A和方法B中制备Ca5(PO4)3OH的化学反应方程式:
①5Ca(NO3)2+3(NH4)2HPO4+4NH3·H2O=Ca5(PO4)3OH↓+
②5Ca(OH)2+3H3PO4=
(2)与方法A相比,方法B的优点是
(3)方法B中,如果H3PO4溶液滴加过快,制得的产物不纯,其原因是
(4)图中所示3种钙盐在人体中最稳定的存在形式是
(5)糖沾附在牙齿上,在酶的作用下产生酸性物质,易造成龋齿。结合化学平衡移动原理,分析其原因
您最近一年使用:0次
6 . 运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。
(1)合成氨反应反应N2(g)+3H2(g)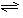 2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡
2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡_______ 移动(填“向左”“向右”或“不”);,使用催化剂_____ 反应的ΔH(填“增大”“减小”或“不改变”)。
(2)O2(g)= O+2(g)+e- H1=1175.7kJ·mol-1
H1=1175.7kJ·mol-1
PtF6(g)+ e-1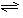 PtF6-(g)
PtF6-(g) H2= -771.1 kJ·mol-1
H2= -771.1 kJ·mol-1
O2+PtF6-(s)=O2+(g)+PtF6- H3=482.2 kJ·mol-1
H3=482.2 kJ·mol-1
则反应O2(g)+ PtF6 (g) = O2+PtF6- (s)的 H=
H=_____________ kJ·mol-1。
(3)在25℃下,向浓度均为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成__________ 沉淀(填化学式),生成该沉淀的离子方程式为____________ 。已知25℃时Ksp[Mg(OH)2]=1.8×10-11,KsP[Cu(OH)2]=2.2×10-20。
(4)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-),则溶液显_____________ 性(填“酸”“碱”或“中”);用含a的代数式表示NH3·H2O的电离常数Kb=__________ 。
(1)合成氨反应反应N2(g)+3H2(g)
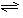 2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡
2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡(2)O2(g)= O+2(g)+e-
 H1=1175.7kJ·mol-1
H1=1175.7kJ·mol-1PtF6(g)+ e-1
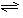 PtF6-(g)
PtF6-(g) H2= -771.1 kJ·mol-1
H2= -771.1 kJ·mol-1O2+PtF6-(s)=O2+(g)+PtF6-
 H3=482.2 kJ·mol-1
H3=482.2 kJ·mol-1则反应O2(g)+ PtF6 (g) = O2+PtF6- (s)的
 H=
H=(3)在25℃下,向浓度均为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成
(4)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-),则溶液显
您最近一年使用:0次
2016-12-09更新
|
1606次组卷
|
9卷引用:2009年普通高等学校招生统一考试理综试题化学部分(山东卷)
2009年普通高等学校招生统一考试理综试题化学部分(山东卷)(已下线)2009学年中山一中、翠园中学、宝安中学高三联考化学试题(已下线)2010—2011学年浙江省杭州二中高二下二学期期中考试化学试卷(已下线)2012届高考化学一轮复习《溶液中的离子反应》专题综合测试(苏教版)(已下线)2011-2012学年湖北省荆州中学高二上学期期中考试化学试卷(已下线)2011-2012学年吉林省长春二中高二上学期期末考试化学试卷2015-2016学年四川省彭州中学高二下2月月考化学试卷山西省朔州市怀仁一中2018-2019学年高二上学期第五次月考化学试题2020年安徽省全省教学质量检测统一考试(练习检测一)



