名校
1 . 室温下,相同体积、相同pH的氨水和氢氧化钠溶液加水稀释时的pH变化曲线如图所示,下列判断错误的是
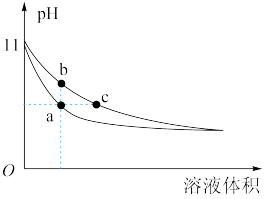

| A.a点所在曲线对应的是NaOH溶液 |
B.b点的 大于c点的 大于c点的 |
C.与同一浓度的盐酸完全反应时,消耗盐酸体积: |
D.a、c两点溶液中的 相等 相等 |
您最近一年使用:0次
2023-01-15更新
|
476次组卷
|
5卷引用:江苏省响水中学2022-2023学年高二下学期期中考试化学试题
2 . 25℃时,三种酸的电离平衡常数如表所示。
回答下列问题:
(1)浓度均为0.1mol/L的CH3COOH、HClO、H3PO3溶液中,c(H+)由大到小的排列是______ 。
(2)亚磷酸(H3PO3)为二元酸,具有较强的还原性Na2HPO3是___________ (填“酸式盐”“碱式盐”或“正盐”),此时亚磷酸的电离平衡常数表达式K=___________ 。
(3)常温下,0.1mol/L的CH3COOH溶液加水稀释的过程中,下列表达式的数值变大的是___________(填字母)。
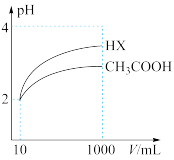
(4)体积为10mL、pH=2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程pH变化如图,则HX的电离平衡常数___________ (填“大于”“小于”或“等于”,下同)醋酸的电离平衡常数。稀释后,HX溶液中水电离出来的c(H+)___________ 醋酸溶液中水电离出来的c(H+)。
| 化学式 | CH3COOH | HClO | H3PO3 |
| 名称 | 醋酸 | 次氯酸 | 亚磷酸 |
| 电离平衡常数 | 1.8×10-5 | 3.0×10-8 | K1=8.3×10-3 K2=5.6×10-6 |
(1)浓度均为0.1mol/L的CH3COOH、HClO、H3PO3溶液中,c(H+)由大到小的排列是
(2)亚磷酸(H3PO3)为二元酸,具有较强的还原性Na2HPO3是
(3)常温下,0.1mol/L的CH3COOH溶液加水稀释的过程中,下列表达式的数值变大的是___________(填字母)。
| A.c(H+) | B. | C.c(CH3COO-) | D.c(CH3COOH) |

您最近一年使用:0次
解题方法
3 . 下列图示与对应的叙述不相符合的是


| A.图1表示相同温度下,向pH=10的氢氧化钠溶液和氨水中分别加水稀释时pH变化曲线,其中a表示氨水稀释时pH的变化曲线 |
| B.图3表示工业上用CO生产甲醇的反应CO(g)+2H2(g)⇌CH3OH(g),该反应的ΔH=-91kJ·mol-1 |
| C.图2表示已达平衡的某反应,在t0时改变某一条件后反应速率随时间变化,则改变的条件一定是加入催化剂 |
| D.图4表示10mL0.01mol·L-1酸性KMnO4溶液与过量的0.1mol·L-1H2C2O4溶液混合时,n(Mn2+)随时间的变化(Mn2+对该反应有催化作用) |
您最近一年使用:0次
名校
4 . 下列图示与对应叙述正确的是


A.图甲表示 的溶解度曲线,a点所示溶液是 的溶解度曲线,a点所示溶液是 时 时 的饱和容液 的饱和容液 |
B.图乙表示将 通入醋酸溶液中,溶液导电性的变化曲线 通入醋酸溶液中,溶液导电性的变化曲线 |
C.图丙表示分别加水稀释体积均为 的 的 溶液和 溶液和 溶液,则该温度下结合质子(H+)的能力: 溶液,则该温度下结合质子(H+)的能力: |
D.图丁表示用 溶液滴定 溶液滴定 溶液得到的滴定曲线 溶液得到的滴定曲线 |
您最近一年使用:0次
2022-05-05更新
|
339次组卷
|
2卷引用:江苏省常州市八校2021-2022学年高二下学期期中调研化学试题
名校
5 . 下列图示与对应的叙述不相符的是
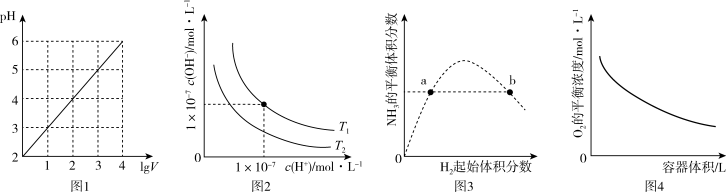
| A.图1表示1LpH=2的HCl溶液加水稀释至VL,pH随lgV的变化 |
| B.图2表示不同温度下水溶液中H+和OH-浓度的变化的曲线,图中温度T1>T2 |
| C.图3表示一定条件下的合成氨反应中,NH3的平衡体积分数随H2起始体积分数(N2的起始量恒定)的变化,图中a点N2的转化率小于b点 |
D.图4表示同一温度下,在不同容积的容器中进行反应2BaO2(s) 2BaO(s)+O2(g),O2的平衡浓度与容器容积的关系 2BaO(s)+O2(g),O2的平衡浓度与容器容积的关系 |
您最近一年使用:0次
2022-04-04更新
|
751次组卷
|
3卷引用:江苏省徐州市第七中学2023-2024学年高二下学期3月考试化学试题
6 . 根据下列图示所得出的结论正确的是
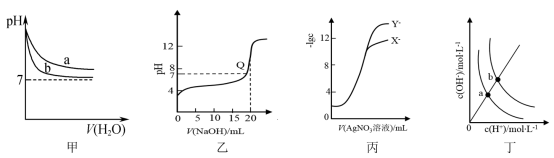

A.图甲表示 和体积相同的 和体积相同的 溶液与氨水稀释过程 溶液与氨水稀释过程 的变化,曲线a对应氨水 的变化,曲线a对应氨水 |
B.图乙是常温下用  溶液滴定 溶液滴定   的滴定曲线,Q点表示酸碱中和滴定终点 的滴定曲线,Q点表示酸碱中和滴定终点 |
C.图丙表示用  溶液滴定浓度均为 溶液滴定浓度均为 的 的 、 、 混合溶液时, 混合溶液时, 随 随 溶液体积的变化,说明 溶液体积的变化,说明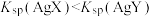 |
D.图丁表示不同温度水溶液中 和 和 的浓度变化,图中a点对应温度高于b点 的浓度变化,图中a点对应温度高于b点 |
您最近一年使用:0次
2021-07-02更新
|
281次组卷
|
3卷引用:江苏省徐州市2020-2021学年高二下学期期末抽测化学试题
名校
解题方法
7 . 下列叙述及对应图示正确的是

| A.图甲是某温度下c(CH3COOH)+c(CH3COO-)=0.100mol•L-1的醋酸与醋酸钠混合溶液中c(CH3COOH)、c(CH3COO-)与pH的关系曲线,pH=3的溶液中:Ka<10-4.75 |
| B.图乙是恒温密闭容器中发生CaCO3(s)=CaO(s)+CO2(g)反应时,c(CO2)随反应时间变化的曲线,t1时刻改变的条件可能是缩小容器的体积 |
| C.图丙是铁条与盐酸反应的反应速率随反应时间变化的曲线,t1时刻溶液的温度最高 |
D.图丁是在0.1mol•L-1Na2CO3溶液中加水稀释,随着加水量的增加,溶液中c(HCO )的变化曲线,则Na2CO3的水解程度A点大于B点 )的变化曲线,则Na2CO3的水解程度A点大于B点 |
您最近一年使用:0次
2021-07-01更新
|
1878次组卷
|
8卷引用:江苏省常州市教育学会2020-2021学年高二下学期期末学业水平监测化学试题
名校
8 . 下列图示与对应的叙述相符合的是
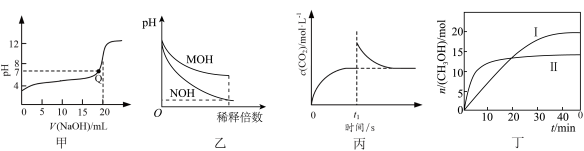

| A.图甲是常温下用0.100 mol/LNaOH溶液滴定20.00 mL 0.1000 mol/L CH3COOH的滴定曲线,Q点表示酸碱中和滴定终点 |
| B.图乙表示常温下稀释pH均为11的MOH溶液和NOH溶液时pH的变化,由图可知溶液的碱性:MOH>NOH |
C.图丙是恒温密闭容器中发生CaCO3(s) CaO(s)+CO2(g)反应时c(CO2)随反应时间变化的曲线,t1时刻改变的条件可能是缩小容器的体积 CaO(s)+CO2(g)反应时c(CO2)随反应时间变化的曲线,t1时刻改变的条件可能是缩小容器的体积 |
D.图丁表示恒容密闭容器中其它条件相同时改变温度,反应CO2(g)+3H2(l)  CH3OH(g)+H2O(g)中,n(CH3OH)随时间变化的曲线,说明反应平衡常数KII>KI CH3OH(g)+H2O(g)中,n(CH3OH)随时间变化的曲线,说明反应平衡常数KII>KI |
您最近一年使用:0次
2021-06-20更新
|
309次组卷
|
4卷引用:江苏省镇江第一中学2020-2021学年高二下学期期末模拟检测化学试题
13-14高三·全国·课后作业
名校
9 . 0.1 mol·L-1氨水10 mL,加蒸馏水稀释到1 L后,下列变化正确的是
①电离程度增大 ②c(NH3·H2O)增大 ③ 数目增多 ④c(OH-)增大 ⑤导电性增强 ⑥
数目增多 ④c(OH-)增大 ⑤导电性增强 ⑥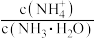 增大
增大
①电离程度增大 ②c(NH3·H2O)增大 ③
 数目增多 ④c(OH-)增大 ⑤导电性增强 ⑥
数目增多 ④c(OH-)增大 ⑤导电性增强 ⑥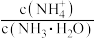 增大
增大| A.①②③ | B.①③⑤ | C.①③⑥ | D.②④⑥ |
您最近一年使用:0次
2021-06-02更新
|
2037次组卷
|
37卷引用:江苏省南通市通州区金沙中学2021-2022学年高二上学期第二次调研考试化学试题
江苏省南通市通州区金沙中学2021-2022学年高二上学期第二次调研考试化学试题湖北省长阳县第一高级中学2017-2018学年高二9月月考化学试题陕西省黄陵中学高新部2019-2020学年高二上学期期中考试化学试题云南省曲靖市宣威市第九中学2019-2020学年高二上学期第二次段考化学试题云南省曲靖市富源县第六中学2019-2020学年高二上学期期末考试化学试题沪科版化学高二拓展性课程3《化学中的平衡》测试题人教版(2019)高二化学选择性必修1第三章 水溶液中的离子反应与平衡 第一节 电离平衡 课时2 电离平衡常数黑龙江省大庆中学2020-2021学年高二上学期期中考试化学试题河北省石家庄市藁城区第一中学2019-2020学年高二上学期第二次月考化学试题安徽省合肥市第十一中学2020-2021学年高二上学期第二次月考化学试题山东省东营市胜利第二中学2020-2021学年高二上学期期中考试化学试题广西南宁市第四中学2020-2021学年高二下学期开学考试化学试题云南省丽江市第一中学2020-2021学年高二下学期期中考试化学试题云南省新平县一中2020-2021学年高二下学期期中考试化学试题选择性必修1(SJ)专题3第一单元课时2 电离平衡常数辽宁省沈阳市郊联体2021-2022学年高二上学期期中考试化学试题山东省济南市商河县第一中学2020-2021学年高二10月月考化学试题山东省临沂市兰陵县2021-2022学年高二上学期期中考试化学试题山东省临沂市兰山区、罗庄区2021-2022学年高二上学期中考试化学试题黑龙江省绥化市第一中学2021-2022学年高二上学期期中考试化学试卷云南省玉溪市第二中学2021-2022学年高二上学期期中考试化学试题云南省玉溪市江川区第二中学2021-2022学年高二上学期期中考试化学试题甘肃省永昌县第一高级中学2020-2021学年高二上学期期中考试化学(理)试题甘肃省永昌县第一高级中学2020-2021学年高二上学期期末考试化学试题山西省晋中市平遥县第二中学2021-2022学年高二上学期12月考试化学试题甘肃省民乐县第一中学2021--2022学年高二上学期期中考试化学试题山西省朔州市朔城区第一中学校2021-2022学年高二下学期开学检测化学试题新疆师范大学附属中学2021-2022学年高二12月月考化学试题吉林省长春市第二实验中学2021-2022学年高二上学期10月月考化学试题甘肃省永昌县第一高级中学2021-2022学年高二上学期期末考试化学试题四川省凉山州宁南中学2022-2023学年高二上学期第二次月考化学试题黑龙江省饶河县高级中学2021-2022学年高二上学期期中考试化学试题安徽省怀宁县第二中学2023-2024学年高二上学期期中考试化学试题(已下线)2014年化学高考总复习课时演练 8-1弱电解质的电离练习卷(已下线)2014高考化学专题突破训练 专题7电解质溶液练习卷黑龙江省大庆中学2018届高三上学期开学考试化学试题(已下线)专题23 强酸(碱)与弱酸(碱)的比较-2022年高考化学毕业班二轮热点题型归纳与变式演练(全国通用)
10 . 25℃时,三种酸的电离平衡常数如下表:
(1)CH3COOH溶液中存在电离平衡:CH3COOH⇌CH3CH3COO-+H+,下列方法中,可以使0.10mol•L−1CH3COOH溶液中CH3COOH电离程度增大的是_______ 。
a.加入少量稀盐酸 b.加入少量冰醋酸
c.加入少量醋酸钠固体 d.加入少量碳酸钠固体
(2)常温下0.1mol•L−1的CH3COOH溶液加水稀释过程,下列表达式的数据一定变小的是___ 。
a.c(H+) b. c.c(H+)•c(OH-) d.
c.c(H+)•c(OH-) d.
(3)体积为10mLpH=2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程pH变化如图所示。则HX的电离平衡常数___ (填“大于”、“等于”或“小于”,下同)醋酸的平衡常数;稀释后,HX溶液中水电离出来的c(H+)__ 醋酸溶液水电离出来的c(H+)。
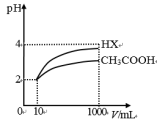
(4)等物质的量浓度的下列溶液:①Na2CO3;②NaClO;③CH3COONa;④NaHCO3的pH由大到小的顺序是____ (填序号)。
(5)写出往NaClO溶液中通少量CO2的离子方程式:____ 。
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.8×10-5 | Ka1=4.3×10-7 Ka2=5.6×10-11 | 3.0×10-8 |
a.加入少量稀盐酸 b.加入少量冰醋酸
c.加入少量醋酸钠固体 d.加入少量碳酸钠固体
(2)常温下0.1mol•L−1的CH3COOH溶液加水稀释过程,下列表达式的数据一定变小的是
a.c(H+) b.
 c.c(H+)•c(OH-) d.
c.c(H+)•c(OH-) d.
(3)体积为10mLpH=2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程pH变化如图所示。则HX的电离平衡常数

(4)等物质的量浓度的下列溶液:①Na2CO3;②NaClO;③CH3COONa;④NaHCO3的pH由大到小的顺序是
(5)写出往NaClO溶液中通少量CO2的离子方程式:
您最近一年使用:0次



