解题方法
1 . 用标准的 溶液滴定未知浓度的盐酸,若测定结果偏低,其原因可能是
溶液滴定未知浓度的盐酸,若测定结果偏低,其原因可能是
| A.滴定时有盐酸溅出锥形瓶外 |
| B.滴定终点读数时,仰视滴定管的刻度,其他操作正确 |
| C.盛装未知液的锥形瓶用蒸馏水洗过后再用未知液润洗 |
| D.滴定到终点读数时,发现滴定管尖嘴处悬挂一滴溶液 |
您最近一年使用:0次
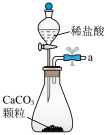
2 . α-呋喃丙烯酸是一种重要的有机酸,其实验室制备原理如下:
向三颈烧瓶中依次加入丙二酸、糠醛和吡啶,在95℃下回流2小时,停止反应;将混合物倒入装有100mL蒸馏水的烧杯中,加入固体碳酸钠中和至弱碱性,加入活性炭后煮沸5~10min脱色,趁热过滤;滤液在冰水浴中边搅拌边滴加浓盐酸至不再有沉淀生成,抽滤,用冷水洗涤2~3次,得到粗产品。实验装置如图所示。___________ 。
(2)与酒精灯加热相比,使用油浴加热的优点是___________ 。
(3)三颈烧瓶中反应已完成的标志是___________ 。
(4)“趁热过滤”的目的是___________ 。
(5)为精确测定产品纯度,拟用以下实验方案:
称取m gα-呋喃丙烯酸样品,加入 的乙醇水溶液中,滴入2~3滴酚酞作指示剂,用浓度为
的乙醇水溶液中,滴入2~3滴酚酞作指示剂,用浓度为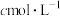 的氢氧化钠标准溶液滴定至终点,做3组平行实验,所消耗NaOH溶液的平均体积为V mL。
的氢氧化钠标准溶液滴定至终点,做3组平行实验,所消耗NaOH溶液的平均体积为V mL。
①滴定管需要用标准溶液润洗,润洗滴定管的具体操作为___________ 。
②产品的纯度是___________ (以质量分数表示)。
③下列操作会使测定结果偏大的是___________ (填标号)。
A.称量样品时,将样品放在托盘天平的右盘
B.加热回流阶段,油浴时没有搅拌,出现焦化现象
C.滴定过程中,读数时,滴定前仰视,滴定后俯视
D.滴定前,尖嘴管有气泡,滴定后无气泡

向三颈烧瓶中依次加入丙二酸、糠醛和吡啶,在95℃下回流2小时,停止反应;将混合物倒入装有100mL蒸馏水的烧杯中,加入固体碳酸钠中和至弱碱性,加入活性炭后煮沸5~10min脱色,趁热过滤;滤液在冰水浴中边搅拌边滴加浓盐酸至不再有沉淀生成,抽滤,用冷水洗涤2~3次,得到粗产品。实验装置如图所示。
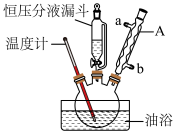
(2)与酒精灯加热相比,使用油浴加热的优点是
(3)三颈烧瓶中反应已完成的标志是
(4)“趁热过滤”的目的是
(5)为精确测定产品纯度,拟用以下实验方案:
称取m gα-呋喃丙烯酸样品,加入
 的乙醇水溶液中,滴入2~3滴酚酞作指示剂,用浓度为
的乙醇水溶液中,滴入2~3滴酚酞作指示剂,用浓度为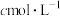 的氢氧化钠标准溶液滴定至终点,做3组平行实验,所消耗NaOH溶液的平均体积为V mL。
的氢氧化钠标准溶液滴定至终点,做3组平行实验,所消耗NaOH溶液的平均体积为V mL。①滴定管需要用标准溶液润洗,润洗滴定管的具体操作为
②产品的纯度是
③下列操作会使测定结果偏大的是
A.称量样品时,将样品放在托盘天平的右盘
B.加热回流阶段,油浴时没有搅拌,出现焦化现象
C.滴定过程中,读数时,滴定前仰视,滴定后俯视
D.滴定前,尖嘴管有气泡,滴定后无气泡
您最近一年使用:0次
解题方法
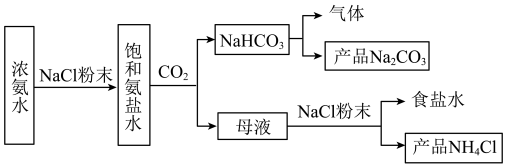
3 . 化工专家侯德榜发现的侯氏制碱法为我国纯碱工业和国民经济发展做出了重要贡献。
某化学兴趣小组在实验室中模拟并改进侯氏制碱法制备NaHCO3,进一步处理得到产品Na2CO3和NH4Cl。
步骤I:Na2CO3的制备
实验流程如图:
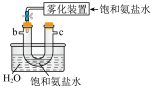
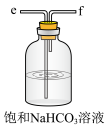
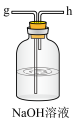
1.从A-E中选择合适的仪器制备NaHCO3,正确的连接顺序是___________ (按气流方向)。
2.B中使用雾化装置的优点是___________ 。反应完成后,将B中U形管内的混合物处理得到固体NaHCO3和滤液。
①对固体NaHCO3充分加热。
3.生成Na2CO3的化学方程式为___________ 。
②向滤液中加入NaCl粉末。
4.已知:存在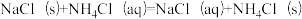 过程。为使NH4Cl沉淀充分折出并分离,根据NaCl和NH4Cl溶解度曲线,需采用的操作为
过程。为使NH4Cl沉淀充分折出并分离,根据NaCl和NH4Cl溶解度曲线,需采用的操作为___________ 、过滤、洗涤、干燥。
5.上述实验流程中,可以循环使用的物质是
步骤II:产品的检验
6.为检验产品Na2CO3中是否含有NaCl,可选用的最合适的试剂组合是
测试纯碱产品中NaHCO3含量的方法是:
①准确称取纯碱样品ag,放入锥形瓶中加蒸馏水溶解配成100.00mL溶液。
②取出10.00mL,加1~2滴酚酞指示剂,用物质的量浓度为1.000mol。L-1的HCl溶液滴定,滴定终点时完成 ,所用HCl溶液体积为V1mL。
,所用HCl溶液体积为V1mL。
③再加1~2滴甲基橙指示剂,继续用HCl溶液滴定,直至___________,达到滴定终点,所用HCl溶液总体积为V2mL。
7.补完第③步的操作___________ 。写出③中反应的离子方程式___________ 。
8.写出纯碱样品中NaHCO3质量分数的计算式(包含a、V1、V2):NaHCO3(%)=___________ %。
9.第②步滴定终点时,某同学俯视读数,其他操作均正确,则NaHCO3质量分数的计算结果___________ 。
A.偏大 B.偏小 C.无影响
某化学兴趣小组在实验室中模拟并改进侯氏制碱法制备NaHCO3,进一步处理得到产品Na2CO3和NH4Cl。
步骤I:Na2CO3的制备
实验流程如图:
1.从A-E中选择合适的仪器制备NaHCO3,正确的连接顺序是
|
|
|
| A | B | C |
|
| |
| D | E |
| A.abed | B.aghbed | C.afebcd | D.aefbcghd |
①对固体NaHCO3充分加热。
3.生成Na2CO3的化学方程式为
②向滤液中加入NaCl粉末。
4.已知:存在
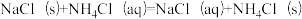 过程。为使NH4Cl沉淀充分折出并分离,根据NaCl和NH4Cl溶解度曲线,需采用的操作为
过程。为使NH4Cl沉淀充分折出并分离,根据NaCl和NH4Cl溶解度曲线,需采用的操作为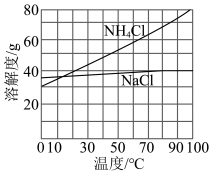
5.上述实验流程中,可以循环使用的物质是
| A.NaCl | B.NH4Cl | C.NH3 | D.CO2 |
步骤II:产品的检验
6.为检验产品Na2CO3中是否含有NaCl,可选用的最合适的试剂组合是
| A.澄清石灰水 | B.硝酸银溶液 | C.盐酸 | D.硝酸 |
测试纯碱产品中NaHCO3含量的方法是:
①准确称取纯碱样品ag,放入锥形瓶中加蒸馏水溶解配成100.00mL溶液。
②取出10.00mL,加1~2滴酚酞指示剂,用物质的量浓度为1.000mol。L-1的HCl溶液滴定,滴定终点时完成
 ,所用HCl溶液体积为V1mL。
,所用HCl溶液体积为V1mL。③再加1~2滴甲基橙指示剂,继续用HCl溶液滴定,直至___________,达到滴定终点,所用HCl溶液总体积为V2mL。
7.补完第③步的操作
8.写出纯碱样品中NaHCO3质量分数的计算式(包含a、V1、V2):NaHCO3(%)=
9.第②步滴定终点时,某同学俯视读数,其他操作均正确,则NaHCO3质量分数的计算结果
A.偏大 B.偏小 C.无影响
您最近一年使用:0次
解题方法
4 . 某学习小组为了探究 CH3COOH 的电离情况,进行了如下实验。
【实验一】配制并测定醋酸中 CH3COOH 的浓度。
将 0.2mol/L 醋酸稀释,并用 0.1000mol/L NaOH 溶液滴定 20.00mL 稀释后的溶液。4 次滴定消耗 NaOH 溶液的体积如下:
(1)该滴定涉及的离子反应方程式为__________________ 。
(2)滴定时量取 20.00ml 的待测液,选择的仪器为_______________ 。
A.酸式滴定管 B.碱式滴定管 C.量筒
(3)滴定时加入的指示剂为_______________ ,到达滴定终点的判断:_______________ 。
(4)该醋酸中 CH3COOH 的物质的量浓度为_______________ 。
(5)下列操作会导致测定 CH3COOH 的浓度偏低的是_______________。
【实验二】探究浓度对 CH3COOH 电离的影响。
用 PH 计测定 25℃时不同浓度的醋酸的 PH,结果如下:
(6)根据表中数据可以得出 CH3COOH 是弱电解质的结论,你认为得出此结论的依据是 _______________ 。
(7)根据表中数据还可以得出另一个结论:随着溶液中 CH3COOH 浓度的减小,CH3COOH 的电离程度将_______________ (填“增大”“减小”或“不变”)。
【实验一】配制并测定醋酸中 CH3COOH 的浓度。
将 0.2mol/L 醋酸稀释,并用 0.1000mol/L NaOH 溶液滴定 20.00mL 稀释后的溶液。4 次滴定消耗 NaOH 溶液的体积如下:
| 试验次数 | 1 | 2 | 3 | 4 |
| 消耗NaOH溶液的体积/mL | 20.05 | 20.00 | 18.40 | 19.95 |
(2)滴定时量取 20.00ml 的待测液,选择的仪器为
A.酸式滴定管 B.碱式滴定管 C.量筒
(3)滴定时加入的指示剂为
(4)该醋酸中 CH3COOH 的物质的量浓度为
(5)下列操作会导致测定 CH3COOH 的浓度偏低的是_______________。
| A.酸式滴定管洗净后未用待装液润洗 |
| B.滴定前碱式滴定管尖端处有气泡,滴定后气泡消失 |
| C.摇动锥形瓶用力过猛,使少量溶液溅出 |
| D.滴定前仰视读数,滴定完毕俯视读数 |
【实验二】探究浓度对 CH3COOH 电离的影响。
用 PH 计测定 25℃时不同浓度的醋酸的 PH,结果如下:
| 浓度/(mol/L) | 0.0010 | 0.0100 | 0.0200 | 0.100 | 0.200 |
| PH | 3.88 | 3.38 | 3.23 | 2.88 | 2.83 |
(7)根据表中数据还可以得出另一个结论:随着溶液中 CH3COOH 浓度的减小,CH3COOH 的电离程度将
您最近一年使用:0次
5 . 醋酸钙片常用于补钙、缓解磷过多症等。某小组为了测定醋酸钙片纯度,进行如下实验:
①称取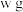 醋酸钙片,研磨成粉末,加入浓硫酸并加热,将产生的醋酸蒸气通入
醋酸钙片,研磨成粉末,加入浓硫酸并加热,将产生的醋酸蒸气通入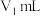
 溶液。
溶液。
②完全反应后,加水稀释吸收液并配制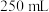 溶液。
溶液。
③准确量取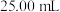 配制溶液于锥形瓶中,滴加指示剂R,用
配制溶液于锥形瓶中,滴加指示剂R,用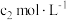 盐酸滴定过量的
盐酸滴定过量的 至终点,消耗滴定液
至终点,消耗滴定液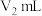 。
。
下列叙述正确的是
①称取
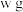 醋酸钙片,研磨成粉末,加入浓硫酸并加热,将产生的醋酸蒸气通入
醋酸钙片,研磨成粉末,加入浓硫酸并加热,将产生的醋酸蒸气通入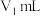
 溶液。
溶液。②完全反应后,加水稀释吸收液并配制
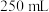 溶液。
溶液。③准确量取
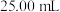 配制溶液于锥形瓶中,滴加指示剂R,用
配制溶液于锥形瓶中,滴加指示剂R,用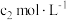 盐酸滴定过量的
盐酸滴定过量的 至终点,消耗滴定液
至终点,消耗滴定液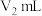 。
。下列叙述正确的是
| A.指示剂R可以选择酚酞溶液或甲基橙溶液 |
| B.步骤②配制溶液定容时仰视读数,配制溶液的浓度偏高 |
| C.步骤③中,若没有润洗酸式滴定管会使测定结果偏高 |
D.上述实验测得醋酸钙样品纯度为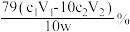 |
您最近一年使用:0次
解题方法
6 . 丙酸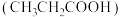 可用作食品防腐剂和防霉剂,能与水、乙醇等混溶。某同学为测定其电离常数做了如下实验:
可用作食品防腐剂和防霉剂,能与水、乙醇等混溶。某同学为测定其电离常数做了如下实验:
【实验一】配制丙酸溶液并用 溶液滴定测定丙酸的浓度。
溶液滴定测定丙酸的浓度。 丙酸溶液,用移液管移取
丙酸溶液,用移液管移取 丙酸溶液于锥形瓶中,加入几
丙酸溶液于锥形瓶中,加入几____________ 滴溶液作指示剂。
(2)取图中的滴定管____________ (填“a”或“b”),检查____________ 后,用蒸馏水洗涤,再用 的
的 标准溶液
标准溶液____________  次,完成后盛装好标准溶液,然后进行滴定,达到滴定终点时的操作和现象为
次,完成后盛装好标准溶液,然后进行滴定,达到滴定终点时的操作和现象为____________ 。
(3)重复滴定操作3次,每次消耗标准溶液的体积如下:
根据表中数据计算,所配丙酸溶液的物质的量浓度为____________  ;若读取滴定终点的数据时仰视读数,则造成所测丙酸溶液的浓度将
;若读取滴定终点的数据时仰视读数,则造成所测丙酸溶液的浓度将____________ (填“偏大”“偏小”或“无影响”)。
【实验二】常温下测定所配丙酸溶液的 。
。
(4)若用 试纸测定丙酸溶液的
试纸测定丙酸溶液的 ,写出简要操作:
,写出简要操作:____________ 。
(5)若用 计测得所配丙酸溶液的
计测得所配丙酸溶液的 为2.94,则常温下,丙酸的电离常数
为2.94,则常温下,丙酸的电离常数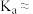
____________ 。
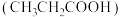 可用作食品防腐剂和防霉剂,能与水、乙醇等混溶。某同学为测定其电离常数做了如下实验:
可用作食品防腐剂和防霉剂,能与水、乙醇等混溶。某同学为测定其电离常数做了如下实验:【实验一】配制丙酸溶液并用
 溶液滴定测定丙酸的浓度。
溶液滴定测定丙酸的浓度。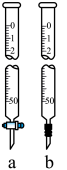
 丙酸溶液,用移液管移取
丙酸溶液,用移液管移取 丙酸溶液于锥形瓶中,加入几
丙酸溶液于锥形瓶中,加入几(2)取图中的滴定管
 的
的 标准溶液
标准溶液 次,完成后盛装好标准溶液,然后进行滴定,达到滴定终点时的操作和现象为
次,完成后盛装好标准溶液,然后进行滴定,达到滴定终点时的操作和现象为(3)重复滴定操作3次,每次消耗标准溶液的体积如下:
实验序号 | 1 | 2 | 3 |
消耗NaOH标准溶液的体积/mL | 24.98 | 25.00 | 25.02 |
 ;若读取滴定终点的数据时仰视读数,则造成所测丙酸溶液的浓度将
;若读取滴定终点的数据时仰视读数,则造成所测丙酸溶液的浓度将【实验二】常温下测定所配丙酸溶液的
 。
。(4)若用
 试纸测定丙酸溶液的
试纸测定丙酸溶液的 ,写出简要操作:
,写出简要操作:(5)若用
 计测得所配丙酸溶液的
计测得所配丙酸溶液的 为2.94,则常温下,丙酸的电离常数
为2.94,则常温下,丙酸的电离常数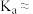
您最近一年使用:0次
解题方法
7 . 常温下某学生用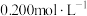 的标准
的标准 溶液滴定未知浓度的醋酸,其操作可分为如下几步:
溶液滴定未知浓度的醋酸,其操作可分为如下几步:
①用蒸馏水洗涤碱式滴定管,并注入 溶液至“0”刻度线以上
溶液至“0”刻度线以上
②固定好滴定管并使滴定管尖嘴充满液体
③调节液面至“0”或“0”刻度线以下,并记下读数
④量取20.00mL待测液注入洁净的锥形瓶中,并加入3滴指示剂
⑤用标准液滴定至终点,记下滴定管液面读数
(1)以上步骤有错误的是_______ (填序号)。
(2)用标准 溶液滴定时,应将标准
溶液滴定时,应将标准 溶液注入
溶液注入_______ 中(从图中选填“甲”或“乙”)。_______ 作指示剂,判断达到滴定终点的依据是_______ 。
(4)第一次滴定前后,碱式滴定管中的液面位置如图所示,则 标准溶液的实际用量为
标准溶液的实际用量为_______ mL。_______ ;滴定结束后读数时俯视液面_______ 。
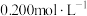 的标准
的标准 溶液滴定未知浓度的醋酸,其操作可分为如下几步:
溶液滴定未知浓度的醋酸,其操作可分为如下几步:①用蒸馏水洗涤碱式滴定管,并注入
 溶液至“0”刻度线以上
溶液至“0”刻度线以上②固定好滴定管并使滴定管尖嘴充满液体
③调节液面至“0”或“0”刻度线以下,并记下读数
④量取20.00mL待测液注入洁净的锥形瓶中,并加入3滴指示剂
⑤用标准液滴定至终点,记下滴定管液面读数
(1)以上步骤有错误的是
(2)用标准
 溶液滴定时,应将标准
溶液滴定时,应将标准 溶液注入
溶液注入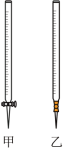
(4)第一次滴定前后,碱式滴定管中的液面位置如图所示,则
 标准溶液的实际用量为
标准溶液的实际用量为
您最近一年使用:0次
名校
8 . 电流滴定法(电压10~100mV)是根据电流情况判断滴定终点,仅I2、I-同时存在时才能产生电流。如图所示,可用此法来测定Na2S2O3溶液的浓度,下列说法正确的是。
已知: 。
。
已知:
 。
。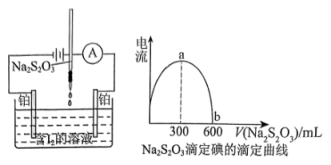
| A.a为滴定终点 |
| B.ab段电流减小是因为溶液中I-浓度降低 |
| C.若滴定前碘液中含有38.1g的I2,硫代硫酸钠溶液的浓度为0.5mol/L |
| D.若滴定结束后俯视读数,则测定Na2S2O3溶液的浓度偏小 |
您最近一年使用:0次
9 .  (乙二胺四乙酸,简写为
(乙二胺四乙酸,简写为 )滴定
)滴定 和
和 时发生反应:
时发生反应: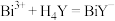 (无色)
(无色)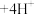
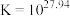 ;
;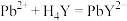 (无色)
(无色)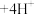
 ;二甲酚橙溶液呈黄色,在
;二甲酚橙溶液呈黄色,在 值
值 时能与
时能与 结合,
结合, 值
值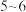 时与
时与 结合,形成的化合物均为紫色。用
结合,形成的化合物均为紫色。用 测定某
测定某 和
和 混合液中金属离子浓度,实验步骤为:
混合液中金属离子浓度,实验步骤为:
①取 混合液于锥形瓶中调
混合液于锥形瓶中调 值,滴加几滴二甲酚橙溶液,用浓度为
值,滴加几滴二甲酚橙溶液,用浓度为 标准EDTA溶液滴定至颜色突变且半分钟不恢复原色。此时消耗EDTA的体积记录为数据一。
标准EDTA溶液滴定至颜色突变且半分钟不恢复原色。此时消耗EDTA的体积记录为数据一。
②向锥形瓶中加入缓冲溶液调 至合适数值,再用EDTA滴定至颜色突变且半分钟不恢复原色。再次消耗EDTA体积记录为数据二。
至合适数值,再用EDTA滴定至颜色突变且半分钟不恢复原色。再次消耗EDTA体积记录为数据二。
③重复以上实验三次,数据一的均值为 ,数据二的均值为
,数据二的均值为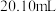 。
。
下列说法正确的是( )
 (乙二胺四乙酸,简写为
(乙二胺四乙酸,简写为 )滴定
)滴定 和
和 时发生反应:
时发生反应: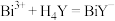 (无色)
(无色)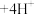
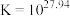 ;
;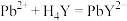 (无色)
(无色)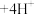
 ;二甲酚橙溶液呈黄色,在
;二甲酚橙溶液呈黄色,在 值
值 时能与
时能与 结合,
结合, 值
值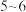 时与
时与 结合,形成的化合物均为紫色。用
结合,形成的化合物均为紫色。用 测定某
测定某 和
和 混合液中金属离子浓度,实验步骤为:
混合液中金属离子浓度,实验步骤为:①取
 混合液于锥形瓶中调
混合液于锥形瓶中调 值,滴加几滴二甲酚橙溶液,用浓度为
值,滴加几滴二甲酚橙溶液,用浓度为 标准EDTA溶液滴定至颜色突变且半分钟不恢复原色。此时消耗EDTA的体积记录为数据一。
标准EDTA溶液滴定至颜色突变且半分钟不恢复原色。此时消耗EDTA的体积记录为数据一。②向锥形瓶中加入缓冲溶液调
 至合适数值,再用EDTA滴定至颜色突变且半分钟不恢复原色。再次消耗EDTA体积记录为数据二。
至合适数值,再用EDTA滴定至颜色突变且半分钟不恢复原色。再次消耗EDTA体积记录为数据二。③重复以上实验三次,数据一的均值为
 ,数据二的均值为
,数据二的均值为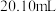 。
。下列说法正确的是( )
A.步骤② 值调好时溶液为黄色 值调好时溶液为黄色 | B.步骤①与步骤②突变颜色相同 |
C.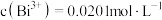 | D.若步骤①中多滴了EDTA,则测得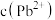 偏高 偏高 |
您最近一年使用:0次
解题方法
10 . 现使用酸碱中和滴定法测定某盐酸的浓度。
Ⅰ.实验步骤
(1)如图,用图中______ (填“甲”或“乙”)量取待测盐酸溶液20.00 mL于锥形瓶中,向其中滴加2滴______ 作指示剂。 NaOH溶液的碱式滴定管的初始读数。如果液面位置如图所示,则此时的读数为:
NaOH溶液的碱式滴定管的初始读数。如果液面位置如图所示,则此时的读数为:______ mL。______ 。当______ 时,停止滴定,并记录NaOH溶液的最终读数。重复滴定3次。
Ⅱ.实验记录
Ⅲ.数据处理与讨论
(4)根据图表数据平均消耗的NaOH溶液的体积
______ mL,数据处理,可得
______  。
。
(5)在本实验的滴定过程中,下列操作会使实验结果偏高的是______(填字母)。
Ⅰ.实验步骤
(1)如图,用图中

 NaOH溶液的碱式滴定管的初始读数。如果液面位置如图所示,则此时的读数为:
NaOH溶液的碱式滴定管的初始读数。如果液面位置如图所示,则此时的读数为:
Ⅱ.实验记录
滴定次数 | 1 | 2 | 3 | 4 |
V(样品)/mL | 20.00 | 20.00 | 20.00 | 20.00 |
V(NaOH)/mL | 15.95 | 15.00 | 15.05 | 14.95 |
(4)根据图表数据平均消耗的NaOH溶液的体积


 。
。(5)在本实验的滴定过程中,下列操作会使实验结果偏高的是______(填字母)。
| A.碱式滴定管在滴定时未用NaOH标准溶液润洗 |
| B.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失 |
| C.锥形瓶中加入待测盐酸溶液后,再加少量水 |
| D.锥形瓶在滴定时剧烈摇动,有少量液体溅出 |
您最近一年使用:0次