1 . 某校学生用中和滴定法测定某NaOH溶液的物质的量浓度,选甲基橙作指示剂。
(1)配制250mL 0.2000 mol/L盐酸标准溶液,所需玻璃仪器有______ 、______ 量筒、烧杯、玻璃棒。
(2)盛装0.2000 mol/L盐酸标准液应该用______ 式滴定管。(填“酸”或“碱”)
(3)滴定时,左手控制滴定管,右手摇动锥形瓶,眼睛注视_________ ,直到加入一滴盐酸后,溶液由_________ ,即到终点。
(4)滴定操作可分解为如下几步:
①检查滴定管是否漏水;
②取一定体积的待测液于锥形瓶中;
③用标准溶液润洗盛标准溶液的滴定管,用待测液润洗盛待测液的滴定管;
④装标准溶液和待测液并调整液面(记录初始读数);
⑤用蒸馏水洗涤玻璃仪器;⑥滴定操作。
正确的操作顺序为:_________ 。
(5)有关数据记录如下:
则NaOH溶液的物质的量浓度为__________ mol/L。
(6)若滴定时锥形瓶未干燥,则测定结果____________ ;若滴定前平视读数,滴定终点时仰视读数,则所测碱的浓度值_________ 。(填“无影响”、“偏高”或“偏低”)。
(1)配制250mL 0.2000 mol/L盐酸标准溶液,所需玻璃仪器有
(2)盛装0.2000 mol/L盐酸标准液应该用
(3)滴定时,左手控制滴定管,右手摇动锥形瓶,眼睛注视
(4)滴定操作可分解为如下几步:
①检查滴定管是否漏水;
②取一定体积的待测液于锥形瓶中;
③用标准溶液润洗盛标准溶液的滴定管,用待测液润洗盛待测液的滴定管;
④装标准溶液和待测液并调整液面(记录初始读数);
⑤用蒸馏水洗涤玻璃仪器;⑥滴定操作。
正确的操作顺序为:
(5)有关数据记录如下:
实验序号 | 待测液体积(mL) | 所消耗盐酸标准液的体积(mL) | |
| 滴定前 | 滴定后 | ||
| 1 | 20.00 | 0.60 | 20.70 |
| 2 | 20.00 | 6.00 | 25.90 |
| 3 | 20.00 | 1.40 | 23.20 |
(6)若滴定时锥形瓶未干燥,则测定结果
您最近一年使用:0次
2 . 某烧碱溶液中含有少量杂质(不与盐酸反应),现用中和滴定测定其浓度。
(1)用_______ 式滴定管盛装0.1000 mol•L-1盐酸标准液。配制250 mL0.1000 mol•L-1盐酸标准液,必须使用的容器,除了烧杯、玻璃棒、量筒、胶头滴管外,还需要_______ 。
(2)量取NaOH待测液的滴定管尖嘴部分留有气泡,排除气泡的方法应采用图中的_______ 操作。(填“甲”、“乙”、“丙”)。

(3)有关数据记录如下:
滴定过程中,眼睛应注视_______ ,第二次滴定前后50 mL滴定管中液面的位置如图所示,该次滴定所消耗标准盐酸体积为_______ mL。

(4)该实验应选用_______ (填“酚酞”或者“石蕊”)作指示剂;到达滴定终点的现象是_______ 。
(5)根据所给数据,该烧碱样品的物质的量浓度为_______ mol/L(保留四位有效数字)。
(6)下列操作中可能使所测氢氧化钠溶液的浓度数值偏低的是_______。
(7)硒是人体所需微量元素之一,也是一种重要的工业原料。Na2S2O3可以用于测定粗硒中硒的含量,操作步骤如下:
①用浓H2SO4将样品中的Se氧化为SeO2;
②用KI溶液还原SeO2为Se,同时生成I2;
③加入指示剂,用Na2S2O3标准溶液滴定Ⅱ中生成的I2(I2+2S2O =2I-+S4O
=2I-+S4O )。实验中准确称量0.4000 g粗硒样品,滴定中消耗0.8000 mol·L-1的Na2S2O3溶液20.00 mL。
)。实验中准确称量0.4000 g粗硒样品,滴定中消耗0.8000 mol·L-1的Na2S2O3溶液20.00 mL。
加入的指示剂为_______ ,粗硒样品中硒的质量分数为_______ 。
(1)用
(2)量取NaOH待测液的滴定管尖嘴部分留有气泡,排除气泡的方法应采用图中的

(3)有关数据记录如下:
| 滴定序号 | 待测液体积(mL) | 所消耗盐酸标准液的体积(mL) | ||
| 滴定前 | 滴定后 | 消耗的体积 | ||
| 1 | 25.00 | 0.50 | 26.80 | 26.30 |
| 2 | 25.00 | |||
| 3 | 25.00 | 5.00 | 31.34 | 26.34 |

(4)该实验应选用
(5)根据所给数据,该烧碱样品的物质的量浓度为
(6)下列操作中可能使所测氢氧化钠溶液的浓度数值偏低的是_______。
| A.滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液 |
| B.盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥 |
| C.读取盐酸体积时,滴定前读数正确,滴定结束时俯视读数 |
| D.装标准液的滴定管在滴定前有气泡,滴定后气泡消失 |
①用浓H2SO4将样品中的Se氧化为SeO2;
②用KI溶液还原SeO2为Se,同时生成I2;
③加入指示剂,用Na2S2O3标准溶液滴定Ⅱ中生成的I2(I2+2S2O
 =2I-+S4O
=2I-+S4O )。实验中准确称量0.4000 g粗硒样品,滴定中消耗0.8000 mol·L-1的Na2S2O3溶液20.00 mL。
)。实验中准确称量0.4000 g粗硒样品,滴定中消耗0.8000 mol·L-1的Na2S2O3溶液20.00 mL。加入的指示剂为
您最近一年使用:0次
名校
解题方法
3 . 实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验.请你完成下列填空:
步骤一:配制 标准溶液。
标准溶液。
步骤二:取 待测稀盐酸放入锥形瓶中,并滴加
待测稀盐酸放入锥形瓶中,并滴加 滴酚酞溶液作指示剂,用配制的标准NaOH溶液进行滴定.重复上述滴定操作
滴酚酞溶液作指示剂,用配制的标准NaOH溶液进行滴定.重复上述滴定操作 次,记录数据如下。
次,记录数据如下。
试回答下列问题:
(1)步骤一中要用到的玻璃仪器除烧杯、玻璃棒外还有______ 、_____ 。
(2)如何准确判断滴定终点____ 。
(3)如图某次实验的滴定管中的液面,其读数为_______  。
。

(4)在上述实验中,下列操作(其他操作正确)会造成测定结果(待测液浓度值)偏低的有_______ (填字母序号)。
A.配制标准溶液定容时,加水超过刻度线
B.锥形瓶水洗后直接装待测液
C.酸式滴定管水洗后未用待测稀盐酸溶液润洗
D.滴定到达终点时,仰视读出滴定管读数
E.碱式滴定管尖嘴部分有气泡,滴定后消失
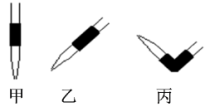
(5)排去碱式滴定管中气泡的方法应采用图的__________ 操作,然后轻轻挤压玻璃球使尖嘴部分充满碱液。
(6)从实验所得数据计算,盐酸溶液的浓度为________  。(结果保留到小数点后两位)
。(结果保留到小数点后两位)
步骤一:配制
 标准溶液。
标准溶液。步骤二:取
 待测稀盐酸放入锥形瓶中,并滴加
待测稀盐酸放入锥形瓶中,并滴加 滴酚酞溶液作指示剂,用配制的标准NaOH溶液进行滴定.重复上述滴定操作
滴酚酞溶液作指示剂,用配制的标准NaOH溶液进行滴定.重复上述滴定操作 次,记录数据如下。
次,记录数据如下。实验编号 | 盐酸溶液 | 滴定管起始读数 | 滴定管滴定终点读数 |
1 | 20.00 | 0.00 | 22.58 |
2 | 20.00 | 0.00 | 22.60 |
3 | 20.00 | 0.00 | 22.62 |
(1)步骤一中要用到的玻璃仪器除烧杯、玻璃棒外还有
(2)如何准确判断滴定终点
(3)如图某次实验的滴定管中的液面,其读数为
 。
。
(4)在上述实验中,下列操作(其他操作正确)会造成测定结果(待测液浓度值)偏低的有
A.配制标准溶液定容时,加水超过刻度线
B.锥形瓶水洗后直接装待测液
C.酸式滴定管水洗后未用待测稀盐酸溶液润洗
D.滴定到达终点时,仰视读出滴定管读数
E.碱式滴定管尖嘴部分有气泡,滴定后消失
(5)排去碱式滴定管中气泡的方法应采用图的

(6)从实验所得数据计算,盐酸溶液的浓度为
 。(结果保留到小数点后两位)
。(结果保留到小数点后两位)
您最近一年使用:0次
2021-11-10更新
|
158次组卷
|
3卷引用:云南省弥勒市第一中学2021-2022学年高二上学期第三次月考化学试题
名校
4 . 某课外活动小组测定了某工厂工业废水中游离态氯的含量,下面是测定实验分析报告:
(一)测定目的:测定工厂工业废水中的游离态氯的含量
(二)测定原理:Cl2+2KI=2KCl+I2;I2+2Na2S2O3=2NaI+Na2S4O6
(三)实验用品及试剂:
(1)仪器和用品(自选,略)
(2)试剂:指示剂_______ (填名称),KI溶液,浓度为0.010 mol·L-1的标准Na2S2O3溶液,蒸馏水等。
(四)实验过程:
(1)取水样10.00 mL 于锥形瓶中,加入10.00 mL KI溶液(足量),滴入指示剂2~3滴。
(2)取碱式滴定管(经检查不漏水),依次用自来水、蒸馏水洗净,然后注入0.010 mol·L-1Na2S2O3溶液待用。
(3)将锥形瓶置于滴定管下方进行滴定,眼睛注视_______ 直至滴定终点,滴定至终点的现象是_______ 。
(五)数据记录与处理:(请在表格中的横线上填上必要的物理量,不必填数据)
若经数据处理,滴定中消耗标准的Na2S2O3溶液的体积平均是20.00 mL,则废水中Cl2的物质的量浓度为_______ ,从实验过程分析,此浓度比实际浓度_______ (填“偏大”、“偏小”或“相等”),造成误差的原因是_______ (若认为没有误差,该问可不答)。
(六)问题和讨论:
实验结束后,发现个别同学结果误差较大,其所测游离态氯的含量较废水中Cl2的含量低。经过思考,该同学提出了下列可能造成结果偏小的原因,其中你认为正确的是_______ (填编号)。
①滴定前,滴定管嘴尖嘴处有气泡,滴定后气泡消失
②滴定过程中由于振荡过于剧烈,使少量溶液溅出锥形瓶外
③滴定前平视Na2S2O3液面,滴定后俯视Na2S2O3液面
(一)测定目的:测定工厂工业废水中的游离态氯的含量
(二)测定原理:Cl2+2KI=2KCl+I2;I2+2Na2S2O3=2NaI+Na2S4O6
(三)实验用品及试剂:
(1)仪器和用品(自选,略)
(2)试剂:指示剂
(四)实验过程:
(1)取水样10.00 mL 于锥形瓶中,加入10.00 mL KI溶液(足量),滴入指示剂2~3滴。
(2)取碱式滴定管(经检查不漏水),依次用自来水、蒸馏水洗净,然后注入0.010 mol·L-1Na2S2O3溶液待用。
(3)将锥形瓶置于滴定管下方进行滴定,眼睛注视
(五)数据记录与处理:(请在表格中的横线上填上必要的物理量,不必填数据)
| 滴定次数 | |||||
| 平均值 | |||||
| 1 | 10.00 | ||||
| 2 | 10.00 | ||||
| 3 | 10.00 | ||||
(六)问题和讨论:
实验结束后,发现个别同学结果误差较大,其所测游离态氯的含量较废水中Cl2的含量低。经过思考,该同学提出了下列可能造成结果偏小的原因,其中你认为正确的是
①滴定前,滴定管嘴尖嘴处有气泡,滴定后气泡消失
②滴定过程中由于振荡过于剧烈,使少量溶液溅出锥形瓶外
③滴定前平视Na2S2O3液面,滴定后俯视Na2S2O3液面
您最近一年使用:0次
5 . 某化学实验小组用酸性 溶液和草酸
溶液和草酸 溶液反应,完成以下实验。已知:常温下酸性
溶液反应,完成以下实验。已知:常温下酸性 溶液与草酸
溶液与草酸 溶液反应如下:
溶液反应如下: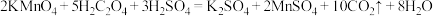
实验一、(1)某 样品中可能含有
样品中可能含有 ,采用酸性
,采用酸性 滴定法测定该样品的组成,实验步骤如下:称取
滴定法测定该样品的组成,实验步骤如下:称取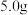 样品配制
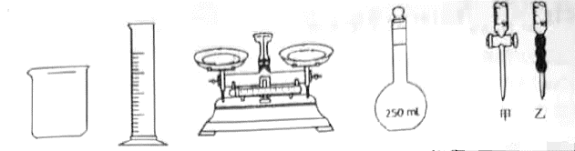
样品配制 溶液,配制溶液过程中,需要的仪器除了包含下图仪器外,还需要药匙、玻璃棒、
溶液,配制溶液过程中,需要的仪器除了包含下图仪器外,还需要药匙、玻璃棒、___________ (写出名称)。
(2)①滴定时应将酸性高锰酸钾溶液加入上图___________ 仪器(部分)中(填序号);在规格为 的滴定管中,若
的滴定管中,若 溶液起始读数为
溶液起始读数为 ,此时滴定管中
,此时滴定管中 溶液的实际体积为
溶液的实际体积为___________ (填标号)。
A. B.小于
B.小于 C.
C. D.大于
D.大于
②每次移取草酸 溶液
溶液 于锥形瓶中。用
于锥形瓶中。用 的酸性
的酸性 溶液滴定,滴定过程中,眼睛应注视
溶液滴定,滴定过程中,眼睛应注视___________ 。当滴入最后半滴溶液,溶液由无色变为浅紫色,且 不褪色,三次滴定消耗酸性
不褪色,三次滴定消耗酸性 溶液体积数据如下表,则
溶液体积数据如下表,则 样品的纯度为
样品的纯度为___________ 。
③滴定结束时,俯视刻度线读取高锰酸钾溶液的体积,会导致测定结果___________ (填“偏大”“偏小”或“不影响”)
实验二、研究外界条件对反应速率的影响,实验操作及现象如下表:
(3)由实验Ⅰ、Ⅱ可得出的结论是___________ 。
(4)关于实验Ⅱ中 后溶液颜色迅速变浅的原因,该小组提出了猜想:该反应中生成的
后溶液颜色迅速变浅的原因,该小组提出了猜想:该反应中生成的 对反应有催化作用。利用提供的试剂设计实验Ⅲ,验证猜想。提供的试剂:
对反应有催化作用。利用提供的试剂设计实验Ⅲ,验证猜想。提供的试剂: 酸性
酸性 溶液,
溶液,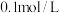 草酸溶液,
草酸溶液, 硫酸,
硫酸, 溶液,
溶液, 固体,蒸馏水
固体,蒸馏水
①补全实验Ⅲ的操作:向试管中先加入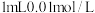 酸性
酸性 溶液,
溶液,___________ ,最后加入 草酸溶液。
草酸溶液。
②若猜想成立,应观察到的实验现象是___________ 。
 溶液和草酸
溶液和草酸 溶液反应,完成以下实验。已知:常温下酸性
溶液反应,完成以下实验。已知:常温下酸性 溶液与草酸
溶液与草酸 溶液反应如下:
溶液反应如下: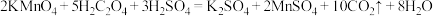
实验一、(1)某
 样品中可能含有
样品中可能含有 ,采用酸性
,采用酸性 滴定法测定该样品的组成,实验步骤如下:称取
滴定法测定该样品的组成,实验步骤如下:称取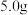 样品配制
样品配制 溶液,配制溶液过程中,需要的仪器除了包含下图仪器外,还需要药匙、玻璃棒、
溶液,配制溶液过程中,需要的仪器除了包含下图仪器外,还需要药匙、玻璃棒、
(2)①滴定时应将酸性高锰酸钾溶液加入上图
 的滴定管中,若
的滴定管中,若 溶液起始读数为
溶液起始读数为 ,此时滴定管中
,此时滴定管中 溶液的实际体积为
溶液的实际体积为A.
 B.小于
B.小于 C.
C. D.大于
D.大于
②每次移取草酸
 溶液
溶液 于锥形瓶中。用
于锥形瓶中。用 的酸性
的酸性 溶液滴定,滴定过程中,眼睛应注视
溶液滴定,滴定过程中,眼睛应注视 不褪色,三次滴定消耗酸性
不褪色,三次滴定消耗酸性 溶液体积数据如下表,则
溶液体积数据如下表,则 样品的纯度为
样品的纯度为| 实验次数 | 始读数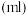 | 末读数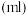 | 消耗体积 |
| 第1次 | 0.20 | 20.30 | 20.10 |
| 第2次 | 1.85 | 21.75 | 19.90 |
| 第3次 | 0.00 | 24.15 | 24.15 |
实验二、研究外界条件对反应速率的影响,实验操作及现象如下表:
| 编号 | 实验操作 | 实验现象 |
| Ⅰ | 向一支试管中先加入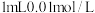 酸性 酸性 溶液,再加入1滴 溶液,再加入1滴 硫酸和9滴蒸馏水,最后加入 硫酸和9滴蒸馏水,最后加入 草酸溶液 草酸溶液 | 前 内溶液紫色无明显变化,后颜色逐渐变浅, 内溶液紫色无明显变化,后颜色逐渐变浅, 后几乎变为无色 后几乎变为无色 |
| Ⅱ | 向另一支试管中先加入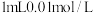 酸性 酸性 溶液,再加入10滴 溶液,再加入10滴 硫酸,最后加入 硫酸,最后加入 草酸溶液 草酸溶液 |  内溶液紫色无明显变化,后颜色迅速变浅,约 内溶液紫色无明显变化,后颜色迅速变浅,约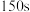 后几乎变为无色 后几乎变为无色 |
(4)关于实验Ⅱ中
 后溶液颜色迅速变浅的原因,该小组提出了猜想:该反应中生成的
后溶液颜色迅速变浅的原因,该小组提出了猜想:该反应中生成的 对反应有催化作用。利用提供的试剂设计实验Ⅲ,验证猜想。提供的试剂:
对反应有催化作用。利用提供的试剂设计实验Ⅲ,验证猜想。提供的试剂: 酸性
酸性 溶液,
溶液,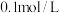 草酸溶液,
草酸溶液, 硫酸,
硫酸, 溶液,
溶液, 固体,蒸馏水
固体,蒸馏水①补全实验Ⅲ的操作:向试管中先加入
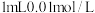 酸性
酸性 溶液,
溶液, 草酸溶液。
草酸溶液。②若猜想成立,应观察到的实验现象是
您最近一年使用:0次
2021-02-01更新
|
145次组卷
|
2卷引用:云南省丽江市重点中学2021-2022学年高二上学期11月月考化学试题
6 . 甲胺(CH3NH2)是一种应用广泛的一元弱碱。常温下,向20.00 mL0. 10 mol∙L-1的甲胺溶液中滴加V mL 0.10 mol·L-1盐酸,混合溶液的pH与 的关系曲线如图所示。
的关系曲线如图所示。

下列说法错误的是
 的关系曲线如图所示。
的关系曲线如图所示。
下列说法错误的是
| A.该滴定过程可选用甲基橙作指示剂 |
| B.常温下,甲胺的电离常数为Kb,则pKb=-lgKb=3.4 |
C.c点对应溶液可能存在关系:2c(H+)+c(CH3NH )=c(CH3NH2)+2c(OH-)+c(Cl-) )=c(CH3NH2)+2c(OH-)+c(Cl-) |
| D.b点对应溶液中加入盐酸的体积为20.00 mL |
您最近一年使用:0次
名校
7 . 草酸又名乙二酸,广泛存在于植物源食品中,它的用途非常广泛。测定某草酸晶体(组成为H2C2O4·nH2O)中H2C2O4的质量分数,进行下列实验:①取 w g 草酸晶体配成 250mL 溶液;②取 25.00mL 所配草酸溶液置于锥形瓶中, 加入适量稀H2SO4 后,在锥形瓶底部垫一张白纸,用浓度为 0.100mol·L-1KMnO4 溶液滴定。滴定时,所发生的反应为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O。
请回答下列问题:
(1)上述反应的还原剂是_____ (填化学式)。
(2)步骤①中为配制准确浓度的草酸溶液,所需用到的仪器有:天平(含砝码)、烧杯、药匙、250ml 容量瓶和___________ 、_______________ 。
(3)在锥形瓶底部垫一张白纸的作用是_____ 。
(4)滴定管应选用_______ 式滴定管(填“酸”或“碱”),判断滴定结束的标准是_________ 。
(5)三次滴定所用 KMnO 溶液体积平均为 20.00mL,则实验测得所配草酸溶液的物质的量浓度为______________ mol·L-1;草酸晶体中 H2C2O4 的质量分数为_______________ ;在实验过程中,锥形瓶用蒸馏水洗净之后,再用草酸溶液润洗,对测定结果造成的影响是_______ (填“偏大”、“偏小”或“无影响)
请回答下列问题:
(1)上述反应的还原剂是
(2)步骤①中为配制准确浓度的草酸溶液,所需用到的仪器有:天平(含砝码)、烧杯、药匙、250ml 容量瓶和
(3)在锥形瓶底部垫一张白纸的作用是
(4)滴定管应选用
(5)三次滴定所用 KMnO 溶液体积平均为 20.00mL,则实验测得所配草酸溶液的物质的量浓度为
您最近一年使用:0次
2019-12-11更新
|
90次组卷
|
2卷引用:云南省普洱市西盟佤族自治县第一中学2021-2022学年高二上学期12月月考化学试题
名校
8 . 下列关于酸碱中和滴定实验的说法正确的是( )
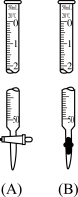

| A.用图B的滴定管可准确量取25.00mL的酸性KMnO4溶液 |
| B.滴定过程中,眼睛要时刻注视滴定管中液面的变化 |
| C.滴定管装入液体前需用待装液润洗 |
| D.滴定前平视,滴定结束后仰视读数,不影响测定结果 |
您最近一年使用:0次
2019-11-03更新
|
343次组卷
|
7卷引用:云南省楚雄天人中学2021-2022学年高二上学期12月月考化学试题(B卷)
云南省楚雄天人中学2021-2022学年高二上学期12月月考化学试题(B卷)安徽省滁州市明光中学2019-2020学年高二上学期第一次月考化学试题江苏省启东中学2019-2020学年高二上学期期中考试化学试题(已下线)3.2.2 酸碱中和滴定(练习)-2020-2021学年上学期高二化学同步精品课堂(新教材人教版选择性必修1)宁夏青铜峡市高级中学2020-2021学年高二上学期期中考试化学试题湖南省新宁县崀山培英学校2020-2021学年高二上学期期中考试化学试题(已下线)第03章 水溶液中的离子反应与平衡(A卷基础强化篇)-2020-2021学年高二化学选择性必修1同步单元AB卷(新教材人教版)
名校
9 . 下列有关实验操作的叙述正确的是
| A.中和滴定实验中指示剂不宜加入过多,通常控制量在1 mL ~2mL |
| B.用50mL酸式滴定管可准确量取25.00mLKMnO4溶液 |
| C.用量筒量取5.00mL1.00mol·L-1盐酸 |
| D.中和滴定实验中的锥形瓶用待测液润洗 |
您最近一年使用:0次
2019-09-04更新
|
652次组卷
|
6卷引用:云南省普洱市西盟佤族自治县第一中学2021-2022学年高二上学期12月月考化学试题
10 . 某化学课外小组为测定空气中CO2的含量,进行了如下实验:
①配制0.1000 mol/L 和0.01000 mol/L的标准盐酸。
②将2~3滴酚酞加入未知浓度的Ba(OH)2溶液10.00 mL中,并用0.1000 mol/L的标准盐酸进行滴定,结果用去盐酸19.60 mL。
③用测定的Ba(OH)2溶液吸收定量空气中的CO2。取Ba(OH)2溶液10.00 mL,放入100 mL容量瓶里加水至刻度线,取出稀释后的溶液放入密闭容器内,并通入10 L标准状况下的空气,振荡,这时生成沉淀。
④过滤上述所得浊液。
⑤取滤液20.00 mL,用0.01000 mol/L的盐酸滴定,用去盐酸34.80 mL。
请回答下列问题:
(1)配制标准盐酸时,需用下列哪些仪器?_____________________ 。
A.托盘天平 B.容量瓶 C.酸式滴定管 D.量筒 E.烧杯 F.胶头滴管 G.玻璃棒
(2)②操作中到达滴定终点时的现象是___________________________________________ 。
(3)Ba(OH)2溶液的物质的量浓度是________ 。
(4)此空气样品中含CO2的体积分数为________ 。
(5)本实验中,若第一次滴定时使用的酸式滴定管未经处理,即注入第二种标准盐酸,并进行第二次滴定,使测定结果________ (填“偏大”“偏小”或“无影响”)。
(6)在第一次滴定的时候未润洗滴定管,会使测定结果_______ (填“偏大”“偏小”或“无影响”)。
①配制0.1000 mol/L 和0.01000 mol/L的标准盐酸。
②将2~3滴酚酞加入未知浓度的Ba(OH)2溶液10.00 mL中,并用0.1000 mol/L的标准盐酸进行滴定,结果用去盐酸19.60 mL。
③用测定的Ba(OH)2溶液吸收定量空气中的CO2。取Ba(OH)2溶液10.00 mL,放入100 mL容量瓶里加水至刻度线,取出稀释后的溶液放入密闭容器内,并通入10 L标准状况下的空气,振荡,这时生成沉淀。
④过滤上述所得浊液。
⑤取滤液20.00 mL,用0.01000 mol/L的盐酸滴定,用去盐酸34.80 mL。
请回答下列问题:
(1)配制标准盐酸时,需用下列哪些仪器?
A.托盘天平 B.容量瓶 C.酸式滴定管 D.量筒 E.烧杯 F.胶头滴管 G.玻璃棒
(2)②操作中到达滴定终点时的现象是
(3)Ba(OH)2溶液的物质的量浓度是
(4)此空气样品中含CO2的体积分数为
(5)本实验中,若第一次滴定时使用的酸式滴定管未经处理,即注入第二种标准盐酸,并进行第二次滴定,使测定结果
(6)在第一次滴定的时候未润洗滴定管,会使测定结果
您最近一年使用:0次
2018-10-11更新
|
107次组卷
|
2卷引用:云南省玉溪市通海县第二中学2021-2022学年高二上学期12月月考化学试题




