名校
1 . 滴定实验是化学学科中重要的定量实验。请回答下列问题:
(1)酸碱中和滴定——用标准盐酸滴定未知浓度的NaOH溶液,下列操作造成测定结果偏低的是_______(填选项字母)
(2)氧化还原滴定——乙二酸俗名草酸,下面是化学学习小组的同学对草酸晶体( )进行的探究性学习的过程,请你参与并协助他们完成相关学习任务.该组同学的研究课题是:探究测定草酸晶体(
)进行的探究性学习的过程,请你参与并协助他们完成相关学习任务.该组同学的研究课题是:探究测定草酸晶体( )中的x值,通过查阅资料和网络查寻得,草酸易溶于水,水溶液可以用酸性
)中的x值,通过查阅资料和网络查寻得,草酸易溶于水,水溶液可以用酸性 溶液进行滴定(还原产物为
溶液进行滴定(还原产物为 )。学习小组的同学设计了滴定的方法测定x值。
)。学习小组的同学设计了滴定的方法测定x值。
第一步:称取1.260g纯草酸晶体,将其制成100.00mL水溶液为待测液。
第二步:取25.00mL待测液放入锥形瓶中,再加入适量的稀 。
。
第三步:用浓度为 的
的 标准溶液进行滴定,达到终点时消耗10.00mL。
标准溶液进行滴定,达到终点时消耗10.00mL。
请回答下列问题:
①滴定时,将酸性 标准液装在
标准液装在_______ (填“酸式”或“碱式”)滴定管中。
②本实验滴定达到终点的现象是_______ 。
③第三步中发生的离子方程式为:_______ 。
④通过上述数据,求得
_______ 。
(3)沉淀滴定——滴定剂和被滴定物的生成物比滴定剂与指示剂的生成物更难溶。参考下表中的数据,若用 滴定NaSCN溶液,可选用的指示剂是_______(填选项字母)。
滴定NaSCN溶液,可选用的指示剂是_______(填选项字母)。
(1)酸碱中和滴定——用标准盐酸滴定未知浓度的NaOH溶液,下列操作造成测定结果偏低的是_______(填选项字母)
| A.滴定终点读数时,俯视滴定管刻度,其他操作正确。 |
| B.重装未知液的锥形瓶用蒸馏水洗过,未用未知液润洗 |
| C.酸式滴定管用蒸馏水洗净后,未用标准盐酸润洗 |
| D.滴定前,盛装标准液的滴定管尖嘴有气泡,滴定后气泡消失 |
 )进行的探究性学习的过程,请你参与并协助他们完成相关学习任务.该组同学的研究课题是:探究测定草酸晶体(
)进行的探究性学习的过程,请你参与并协助他们完成相关学习任务.该组同学的研究课题是:探究测定草酸晶体( )中的x值,通过查阅资料和网络查寻得,草酸易溶于水,水溶液可以用酸性
)中的x值,通过查阅资料和网络查寻得,草酸易溶于水,水溶液可以用酸性 溶液进行滴定(还原产物为
溶液进行滴定(还原产物为 )。学习小组的同学设计了滴定的方法测定x值。
)。学习小组的同学设计了滴定的方法测定x值。第一步:称取1.260g纯草酸晶体,将其制成100.00mL水溶液为待测液。
第二步:取25.00mL待测液放入锥形瓶中,再加入适量的稀
 。
。第三步:用浓度为
 的
的 标准溶液进行滴定,达到终点时消耗10.00mL。
标准溶液进行滴定,达到终点时消耗10.00mL。请回答下列问题:
①滴定时,将酸性
 标准液装在
标准液装在②本实验滴定达到终点的现象是
③第三步中发生的离子方程式为:
④通过上述数据,求得

(3)沉淀滴定——滴定剂和被滴定物的生成物比滴定剂与指示剂的生成物更难溶。参考下表中的数据,若用
 滴定NaSCN溶液,可选用的指示剂是_______(填选项字母)。
滴定NaSCN溶液,可选用的指示剂是_______(填选项字母)。| 难溶物 | AgCl | AgBr | AgCN |  | AgSCN |
| 颜色 | 白 | 浅黄 | 白 | 砖红 | 白 |
| Ksp | 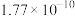 | 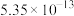 | 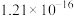 | 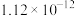 |  |
| A.NaCl | B.NaBr | C.NaCN | D. |
您最近一年使用:0次
名校
解题方法
2 . 某学习小组用“间接碘量法”测定某CuCl2晶体试样的纯度,试样不含其它能与I-发生反应的氧化性杂质,已知:2Cu2++4I-=2CuI↓+I2, 。取mg试样加水溶解,加入过量KI固体反应,用0.1000 mol/LNa2S2O3标准溶液滴定,部分实验仪器和读数如所示。下列说法正确的是
。取mg试样加水溶解,加入过量KI固体反应,用0.1000 mol/LNa2S2O3标准溶液滴定,部分实验仪器和读数如所示。下列说法正确的是
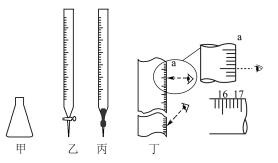
 。取mg试样加水溶解,加入过量KI固体反应,用0.1000 mol/LNa2S2O3标准溶液滴定,部分实验仪器和读数如所示。下列说法正确的是
。取mg试样加水溶解,加入过量KI固体反应,用0.1000 mol/LNa2S2O3标准溶液滴定,部分实验仪器和读数如所示。下列说法正确的是
| A.试样在甲中溶解,滴定管选乙 |
| B.选用淀粉作指示剂,当甲中溶液由无色变为蓝色时,立刻进行读数 |
| C.丁图中,滴定前滴定管的读数为(a- 1.00) mL |
| D.对装有标准液的滴定管读数时,滴定前后读数方式如丁图所示,则测得的结果偏小 |
您最近一年使用:0次
解题方法
3 . 在不同温度下的水溶液中离子浓度曲线如图所示。

(1)图中
_______  (填写“>”,“<”或“=”)
(填写“>”,“<”或“=”)
(2)C点溶液的性质_______ 。(填写“酸性”、“碱性”或“中性”)
(3)将D点变为E点,采取的措施是_______ 。
(4)在48 mL 0.1 mol/L 液中加入12 mL 0.4 mol/L KOH溶液,所得溶液呈_______。
液中加入12 mL 0.4 mol/L KOH溶液,所得溶液呈_______。
(5)用已知浓度HCl溶液滴定未知浓度NaOH溶液,选用酚酞做指示剂。

①滴定时,将酸性HCl标准液装在图中的_______ (填“甲”或“乙”)滴定管中。
②判断滴定终点到达时的现象为_______ 。
③若出现下列情况,测定结果偏高的是_______ (选填字母序号)
a.滴定前用蒸馏水冲洗锥形瓶
b.滴定过程中振荡锥形瓶时不慎将瓶内溶液溅出
c.滴定过程中不慎将数滴酸液滴在锥形瓶外
d.酸式滴定管在滴定前有气泡,滴定后气泡消失

(1)图中

 (填写“>”,“<”或“=”)
(填写“>”,“<”或“=”)(2)C点溶液的性质
(3)将D点变为E点,采取的措施是
(4)在48 mL 0.1 mol/L
 液中加入12 mL 0.4 mol/L KOH溶液,所得溶液呈_______。
液中加入12 mL 0.4 mol/L KOH溶液,所得溶液呈_______。| A.弱酸性 | B.强酸性 | C.碱性 | D.中性 |
(5)用已知浓度HCl溶液滴定未知浓度NaOH溶液,选用酚酞做指示剂。

①滴定时,将酸性HCl标准液装在图中的
②判断滴定终点到达时的现象为
③若出现下列情况,测定结果偏高的是
a.滴定前用蒸馏水冲洗锥形瓶
b.滴定过程中振荡锥形瓶时不慎将瓶内溶液溅出
c.滴定过程中不慎将数滴酸液滴在锥形瓶外
d.酸式滴定管在滴定前有气泡,滴定后气泡消失
您最近一年使用:0次
名校
解题方法
4 . I.某学生用 标准溶液滴定未知浓度盐酸时,选择甲基橙作指示剂。请回答下列问题:
标准溶液滴定未知浓度盐酸时,选择甲基橙作指示剂。请回答下列问题:
(1)若滴定开始和结束时,碱式滴定管中的液面如图1,则消耗 标准液的体积为
标准液的体积为____ mL。

(2)下列有关实验的说法不正确的是_______ 。

A.用酸式滴定管取 稀盐酸放入用蒸馏水洗涤后的锥形瓶中,再滴加几滴甲基橙试液进行滴定
稀盐酸放入用蒸馏水洗涤后的锥形瓶中,再滴加几滴甲基橙试液进行滴定
B.滴定前,锥形瓶和滴定管均须用标准溶液润洗
C.将标准溶液装入滴定管时,应借助烧杯或漏斗等玻璃仪器转移
D.为除去碱式滴定管底部的气泡,应挤压玻璃球快速放出碱液,最后采用图2中的丙操作使尖嘴处充满碱液
E.滴定前碱式滴定管尖嘴部分有气泡,滴定后气泡消失,测定盐酸的物质的量浓度偏高
F.根据图3中 突变范围,选择甲基橙作指示剂时所产生的误差最小
突变范围,选择甲基橙作指示剂时所产生的误差最小
(3)某学生实验中记录的有关数据如下表:
依据表中数据,计算盐酸的物质的量浓度为_______ 。
II.氧化还原滴定实验与酸碱中和滴定类似。某学生用“间接硝量法”测定含有 晶体的试样纯度(不含与
晶体的试样纯度(不含与 发生反应的氧化性杂质)。过程如下:取
发生反应的氧化性杂质)。过程如下:取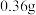 试样溶于水,加入过量
试样溶于水,加入过量 固体,充分反应:
固体,充分反应: 。用
。用 标准溶液滴定:
标准溶液滴定: ,到达滴定终点时,消耗
,到达滴定终点时,消耗 标准溶液
标准溶液 。
。
(4)选用_______ 作滴定指示剂,滴定终点的现象是_______ 。
(5)该试样中 的质量分数为
的质量分数为_______ 。
 标准溶液滴定未知浓度盐酸时,选择甲基橙作指示剂。请回答下列问题:
标准溶液滴定未知浓度盐酸时,选择甲基橙作指示剂。请回答下列问题:(1)若滴定开始和结束时,碱式滴定管中的液面如图1,则消耗
 标准液的体积为
标准液的体积为
(2)下列有关实验的说法不正确的是

A.用酸式滴定管取
 稀盐酸放入用蒸馏水洗涤后的锥形瓶中,再滴加几滴甲基橙试液进行滴定
稀盐酸放入用蒸馏水洗涤后的锥形瓶中,再滴加几滴甲基橙试液进行滴定B.滴定前,锥形瓶和滴定管均须用标准溶液润洗
C.将标准溶液装入滴定管时,应借助烧杯或漏斗等玻璃仪器转移
D.为除去碱式滴定管底部的气泡,应挤压玻璃球快速放出碱液,最后采用图2中的丙操作使尖嘴处充满碱液
E.滴定前碱式滴定管尖嘴部分有气泡,滴定后气泡消失,测定盐酸的物质的量浓度偏高
F.根据图3中
 突变范围,选择甲基橙作指示剂时所产生的误差最小
突变范围,选择甲基橙作指示剂时所产生的误差最小(3)某学生实验中记录的有关数据如下表:
| 滴定次数 | 待测盐酸体积/mL | 标准 溶液体积 溶液体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 第1次 | 25.00 | 0.00 | 26.11 |
| 第2次 | 25.00 | 1.56 | 29.61 |
| 第3次 | 25.00 | 0.22 | 26.31 |
II.氧化还原滴定实验与酸碱中和滴定类似。某学生用“间接硝量法”测定含有
 晶体的试样纯度(不含与
晶体的试样纯度(不含与 发生反应的氧化性杂质)。过程如下:取
发生反应的氧化性杂质)。过程如下:取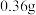 试样溶于水,加入过量
试样溶于水,加入过量 固体,充分反应:
固体,充分反应: 。用
。用 标准溶液滴定:
标准溶液滴定: ,到达滴定终点时,消耗
,到达滴定终点时,消耗 标准溶液
标准溶液 。
。(4)选用
(5)该试样中
 的质量分数为
的质量分数为
您最近一年使用:0次
2023-03-05更新
|
398次组卷
|
2卷引用:吉林省BEST合作体八校2023-2024学年高二上学期1月期末化学试题
名校
解题方法
5 . 某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液时,选择甲基橙作指示剂。请填写下列空白:
(1)用标准的盐酸溶液滴定待测的氢氧化钠溶液时,标准液应该装在_______ (填仪器名称)中;滴定达到终点的现象为:_______ 。
(2)下列操作中可能使所测氢氧化钠溶液的浓度数值偏低的是_______ 。
A.酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液
B.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥
C.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
(3)若滴定开始和结束时,滴定管中的液面如图所示,所用盐酸溶液的体积为_______ mL。

(4)某学生根据三次实验分别记录有关数据如表:
请选用数据计算该氢氧化钠溶液的物质的量浓度:c(NaOH)=_______ mol/L(保留小数点后4位)。
(5)某学习小组用“间接碘量法”测定含有 晶体的试样(不含能与
晶体的试样(不含能与 发生反应的氧化性杂质)的纯度,过程如下:取0.36g试样溶于水,加过量KI固体,充分反应,生成白色沉淀。用0.1000mol/L
发生反应的氧化性杂质)的纯度,过程如下:取0.36g试样溶于水,加过量KI固体,充分反应,生成白色沉淀。用0.1000mol/L 标准溶液滴定,到达滴定终点时,消耗
标准溶液滴定,到达滴定终点时,消耗 标准溶液20.00mL。
标准溶液20.00mL。
已知:
选用_______ 作滴定指示剂,试样中 的质量分数为
的质量分数为_______ 。(保留小数点后一位)
(1)用标准的盐酸溶液滴定待测的氢氧化钠溶液时,标准液应该装在
(2)下列操作中可能使所测氢氧化钠溶液的浓度数值偏低的是
A.酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液
B.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥
C.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
(3)若滴定开始和结束时,滴定管中的液面如图所示,所用盐酸溶液的体积为

(4)某学生根据三次实验分别记录有关数据如表:
| 滴定次数 | 待测NaOH溶液的体积/mL | 0.1000mol/L盐酸的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
| 第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
(5)某学习小组用“间接碘量法”测定含有
 晶体的试样(不含能与
晶体的试样(不含能与 发生反应的氧化性杂质)的纯度,过程如下:取0.36g试样溶于水,加过量KI固体,充分反应,生成白色沉淀。用0.1000mol/L
发生反应的氧化性杂质)的纯度,过程如下:取0.36g试样溶于水,加过量KI固体,充分反应,生成白色沉淀。用0.1000mol/L 标准溶液滴定,到达滴定终点时,消耗
标准溶液滴定,到达滴定终点时,消耗 标准溶液20.00mL。
标准溶液20.00mL。已知:

选用
 的质量分数为
的质量分数为
您最近一年使用:0次
2022-08-25更新
|
562次组卷
|
3卷引用:吉林省长春市第二中学2022-2023学年高二上学期11月期中考试化学试题
名校
6 . 工业废水中常含有一定量氧化性较强的 ,利用滴定原理测定
,利用滴定原理测定 含量方法如下:
含量方法如下:
步骤I:量取 废水于锥形瓶中,加入适量稀硫酸酸化。
废水于锥形瓶中,加入适量稀硫酸酸化。
步骤Ⅱ:加入过量的碘化钾溶液充分反应: 。
。
步骤Ⅲ:向锥形瓶中滴入几滴指示剂。用滴定管量取 溶液进行滴定,数据记录如下表:
溶液进行滴定,数据记录如下表: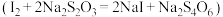
(1)写出水溶液中 和
和 相互转化的离子方程式
相互转化的离子方程式___________ 。
(2)量取 废水选择的仪器是
废水选择的仪器是___________ ,步骤Ⅲ中滴加的指示剂为___________ ,滴定达到终点时的实验现象是___________ 。
(3)步骤Ⅲ中a的读数如图所示,则工业废水中 的含量为
的含量为___________ 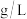 。
。

(4)以下操作会造成废水中 含量测定值偏高的是___________(填序号)。
含量测定值偏高的是___________(填序号)。
 ,利用滴定原理测定
,利用滴定原理测定 含量方法如下:
含量方法如下:步骤I:量取
 废水于锥形瓶中,加入适量稀硫酸酸化。
废水于锥形瓶中,加入适量稀硫酸酸化。步骤Ⅱ:加入过量的碘化钾溶液充分反应:
 。
。步骤Ⅲ:向锥形瓶中滴入几滴指示剂。用滴定管量取
 溶液进行滴定,数据记录如下表:
溶液进行滴定,数据记录如下表: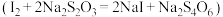
| 滴定次数 |  溶液起始读数 溶液起始读数 |  溶液终点读数 溶液终点读数 |
| 第一次 | 1.02 | 19.03 |
| 第二次 | 2.00 | 19.99 |
| 第三次 | 0.20 | a |
 和
和 相互转化的离子方程式
相互转化的离子方程式(2)量取
 废水选择的仪器是
废水选择的仪器是(3)步骤Ⅲ中a的读数如图所示,则工业废水中
 的含量为
的含量为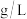 。
。
(4)以下操作会造成废水中
 含量测定值偏高的是___________(填序号)。
含量测定值偏高的是___________(填序号)。| A.滴定终点读数时,俯视滴定管的刻度 |
| B.盛装待测液的锥形瓶用蒸馏水洗过,未用待测液润洗 |
| C.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液 |
D.量取 溶液的滴定管用蒸馏水洗后未用标准液润洗 溶液的滴定管用蒸馏水洗后未用标准液润洗 |
您最近一年使用:0次
12-13高二上·吉林·期末
7 . (10分)蛋壳的主要成分是CaCO3,其次是SiO2、MgCO3及色素等杂质,测定蛋壳中钙的含量时常涉及如图操作步骤,其中最后滴定操作是用标准酸性高锰酸钾溶液滴定生成的草酸,通过钙与草酸的定量关系,可间接求出钙的含量。

资料支持:①草酸的电离方程式为H2C2O4 H++HC2O4- ;
H++HC2O4- ;
②滴定过程的反应为H2C2O4+MnO4- +H+→Mn2++CO2↑+H2O(未配平);
③Ksp(CaC2O4)=2.5×10-9,Ksp(MgC2O4)=8.6×10-5
根据以上材料回答下列问题:
(1)样品溶于盐酸后得到的滤渣主要是________ 。
(2)①②操作时,加入饱和(NH4)2C2O4溶液和氨水的作用是_______________ ;
(3)实验中通常用0.1 mol·L-1草酸铵溶液洗涤沉淀。若实验时用水洗涤沉淀,且每次洗涤时消耗草酸铵溶液和水的体积相同,则每次洗涤时用草酸铵溶液洗涤与用水洗涤损失的质量之比为____________ ;
(4)达到滴定终点的特征为____________ ;
(5)若考虑MgCO3的存在,则此法求得的钙含量略__________ 实际值(填>、=、<)

资料支持:①草酸的电离方程式为H2C2O4
 H++HC2O4- ;
H++HC2O4- ;②滴定过程的反应为H2C2O4+MnO4- +H+→Mn2++CO2↑+H2O(未配平);
③Ksp(CaC2O4)=2.5×10-9,Ksp(MgC2O4)=8.6×10-5
根据以上材料回答下列问题:
(1)样品溶于盐酸后得到的滤渣主要是
(2)①②操作时,加入饱和(NH4)2C2O4溶液和氨水的作用是
(3)实验中通常用0.1 mol·L-1草酸铵溶液洗涤沉淀。若实验时用水洗涤沉淀,且每次洗涤时消耗草酸铵溶液和水的体积相同,则每次洗涤时用草酸铵溶液洗涤与用水洗涤损失的质量之比为
(4)达到滴定终点的特征为
(5)若考虑MgCO3的存在,则此法求得的钙含量略
您最近一年使用:0次
名校
解题方法
8 . Ⅰ.已知:
①
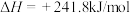
②
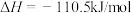
③

请填写下列空白。
(1)上述反应中属于吸热反应的是_______ (填序号)。
(2)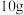
 完全燃烧生成水蒸气,放出的热量为
完全燃烧生成水蒸气,放出的热量为_______ 。
Ⅱ.由于亚硝酸钠和食盐性状相似,曾多次发生过将 误当食盐食用的事件。欲测定某样品中
误当食盐食用的事件。欲测定某样品中 的含量,某同学设计如下实验:①称取样品
的含量,某同学设计如下实验:①称取样品 ,加水溶解,配制成
,加水溶解,配制成 溶液。②取
溶液。②取 溶液于锥形瓶中,用
溶液于锥形瓶中,用
 标准溶液(酸性)进行滴定,滴定结束后消耗
标准溶液(酸性)进行滴定,滴定结束后消耗 溶液
溶液 。
。
(3)上述实验①所需玻璃仪器除烧杯、玻璃棒、胶头滴管之外还有_______ 。
(4)在进行滴定操作时, 溶液盛装在
溶液盛装在_______ (填“酸式”或“碱式”)滴定管中。当滴入最后半滴 溶液,
溶液,_______ 时达到滴定终点。
(5)滴定过程中发生反应的离子方程式是_______ ;测得该样品中 的质量分数为
的质量分数为_______ 。
(6)以下操作造成测定结果偏高的是_______ 。
A.滴定管未用 标准溶液润洗
标准溶液润洗
B.锥形瓶未用待测液润洗
C.盛装标准溶液的滴定管,滴定前尖端有气泡,滴定后气泡消失
D.盛装标准溶液的滴定管,滴定前仰视凹液面最低处,滴定后俯视读数
E.若滴定过程中刚出现颜色变化就停止滴定
①

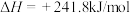
②

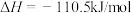
③


请填写下列空白。
(1)上述反应中属于吸热反应的是
(2)
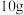
 完全燃烧生成水蒸气,放出的热量为
完全燃烧生成水蒸气,放出的热量为Ⅱ.由于亚硝酸钠和食盐性状相似,曾多次发生过将
 误当食盐食用的事件。欲测定某样品中
误当食盐食用的事件。欲测定某样品中 的含量,某同学设计如下实验:①称取样品
的含量,某同学设计如下实验:①称取样品 ,加水溶解,配制成
,加水溶解,配制成 溶液。②取
溶液。②取 溶液于锥形瓶中,用
溶液于锥形瓶中,用
 标准溶液(酸性)进行滴定,滴定结束后消耗
标准溶液(酸性)进行滴定,滴定结束后消耗 溶液
溶液 。
。(3)上述实验①所需玻璃仪器除烧杯、玻璃棒、胶头滴管之外还有
(4)在进行滴定操作时,
 溶液盛装在
溶液盛装在 溶液,
溶液,(5)滴定过程中发生反应的离子方程式是
 的质量分数为
的质量分数为(6)以下操作造成测定结果偏高的是
A.滴定管未用
 标准溶液润洗
标准溶液润洗B.锥形瓶未用待测液润洗
C.盛装标准溶液的滴定管,滴定前尖端有气泡,滴定后气泡消失
D.盛装标准溶液的滴定管,滴定前仰视凹液面最低处,滴定后俯视读数
E.若滴定过程中刚出现颜色变化就停止滴定
您最近一年使用:0次



