2022·江苏·模拟预测
解题方法
1 . 铁矿石中含铁量的测定是铁元素提炼的基础和前提,目前主要采用重铬酸钾法测定铁矿石中的铁含量,其流程如图所示:
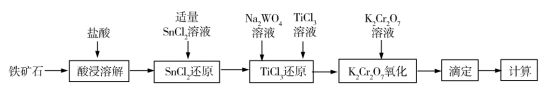
已知:①氧化性顺序: >Fe3+>WO
>Fe3+>WO ;
;
②Sn在溶液中的主要存在形式为Sn2+和SnCl ;
;
③二苯胺磺酸钠可作氧化还原指示剂,氧化型为紫红色,还原型为无色。
回答下列问题:
(1)提高“酸浸溶解”速率可采取的措施有_______ (任写两条)。
(2)“SnCl2还原”过程的离子反应方程式为_______ 。
(3)“SnCl2还原”后溶液仍呈浅黄色,而“TiCl3还原”后溶液呈现蓝色溶液(五价钨溶液为蓝色),则蓝色溶液中铁元素的主要存在形式为_______ ,Na2WO4的作用为_______ 。
(4)滴定前先进行“K2Cr2O7氧化”,即滴加K2Cr2O7溶液至溶液蓝色褪去,请分析该过程的目的是_______ 。
(5)“滴定”过程以二苯胺磺酸钠为指示剂,用酸性K2Cr2O7标准溶液滴定,滴定的反应离子方程式为_______ ;平行滴定5次,其中一组数据异常,所测c(Fe3+)偏大,原因可能是_______ (填标号)。
A.滴定终点读数时仰视滴定管刻度线
B.摇动锥形瓶时有液体溅出
C.未进行“K2Cr2O7氧化”过程就开始滴定
D.加入二苯胺磺酸钠指示剂的量过多
(6)现称取mg铁矿石进行测定,“滴定”时共消耗VmLcmol·L−1K2Cr2O7,则该铁矿石中铁的质量分数为_______ (用含m、c、V的代数式表示)。

已知:①氧化性顺序:
 >Fe3+>WO
>Fe3+>WO ;
;②Sn在溶液中的主要存在形式为Sn2+和SnCl
 ;
;③二苯胺磺酸钠可作氧化还原指示剂,氧化型为紫红色,还原型为无色。
回答下列问题:
(1)提高“酸浸溶解”速率可采取的措施有
(2)“SnCl2还原”过程的离子反应方程式为
(3)“SnCl2还原”后溶液仍呈浅黄色,而“TiCl3还原”后溶液呈现蓝色溶液(五价钨溶液为蓝色),则蓝色溶液中铁元素的主要存在形式为
(4)滴定前先进行“K2Cr2O7氧化”,即滴加K2Cr2O7溶液至溶液蓝色褪去,请分析该过程的目的是
(5)“滴定”过程以二苯胺磺酸钠为指示剂,用酸性K2Cr2O7标准溶液滴定,滴定的反应离子方程式为
A.滴定终点读数时仰视滴定管刻度线
B.摇动锥形瓶时有液体溅出
C.未进行“K2Cr2O7氧化”过程就开始滴定
D.加入二苯胺磺酸钠指示剂的量过多
(6)现称取mg铁矿石进行测定,“滴定”时共消耗VmLcmol·L−1K2Cr2O7,则该铁矿石中铁的质量分数为
您最近一年使用:0次
2 .  价铬有强氧化性和毒性,必须进行处理后排放。处理含铬废水并制备
价铬有强氧化性和毒性,必须进行处理后排放。处理含铬废水并制备 的流程如下:
的流程如下:

已知:
(1)①写出 与
与 溶液在酸性条件下反应的离子方程式:
溶液在酸性条件下反应的离子方程式:___________ 。
② 转化为
转化为 时,不同
时,不同 条件对铬元素的去除效果如图所示,调节
条件对铬元素的去除效果如图所示,调节 时总铬浓度先减小再增大的原因是
时总铬浓度先减小再增大的原因是___________ 。

(2)测定 样品中
样品中 的质量分数。称取样品0.5000g,加水溶解配成
的质量分数。称取样品0.5000g,加水溶解配成 溶液。移取
溶液。移取 于锥形瓶中,加入过量
于锥形瓶中,加入过量 ,充分反应后,加热煮沸,然后加
,充分反应后,加热煮沸,然后加 酸化。此时铬元素以
酸化。此时铬元素以 形式存在,再加入
形式存在,再加入 ,摇匀,充分反应(
,摇匀,充分反应( ),用
),用 标准
标准 溶液滴定至接近终点时,加入淀粉溶液,继续滴定至终点,消耗标准
溶液滴定至接近终点时,加入淀粉溶液,继续滴定至终点,消耗标准 溶液21.00mL(
溶液21.00mL( )。
)。
①标准 溶液需盛放在
溶液需盛放在___________ (填“酸式”或“碱式”)滴定管中,滴定至终点的现象为___________ 。
②若未充分加热煮沸,则测量结果会___________ (填“偏大”“偏小”或“无影响”)。
③计算样品中 的质量分数:
的质量分数:___________ (写出计算过程)。
 价铬有强氧化性和毒性,必须进行处理后排放。处理含铬废水并制备
价铬有强氧化性和毒性,必须进行处理后排放。处理含铬废水并制备 的流程如下:
的流程如下:
已知:

(1)①写出
 与
与 溶液在酸性条件下反应的离子方程式:
溶液在酸性条件下反应的离子方程式:②
 转化为
转化为 时,不同
时,不同 条件对铬元素的去除效果如图所示,调节
条件对铬元素的去除效果如图所示,调节 时总铬浓度先减小再增大的原因是
时总铬浓度先减小再增大的原因是
(2)测定
 样品中
样品中 的质量分数。称取样品0.5000g,加水溶解配成
的质量分数。称取样品0.5000g,加水溶解配成 溶液。移取
溶液。移取 于锥形瓶中,加入过量
于锥形瓶中,加入过量 ,充分反应后,加热煮沸,然后加
,充分反应后,加热煮沸,然后加 酸化。此时铬元素以
酸化。此时铬元素以 形式存在,再加入
形式存在,再加入 ,摇匀,充分反应(
,摇匀,充分反应( ),用
),用 标准
标准 溶液滴定至接近终点时,加入淀粉溶液,继续滴定至终点,消耗标准
溶液滴定至接近终点时,加入淀粉溶液,继续滴定至终点,消耗标准 溶液21.00mL(
溶液21.00mL( )。
)。①标准
 溶液需盛放在
溶液需盛放在②若未充分加热煮沸,则测量结果会
③计算样品中
 的质量分数:
的质量分数:
您最近一年使用:0次
3 . 某化学兴趣小组取一定量的过氧化氢溶液,准确测定了过氧化氢的含量,并探究了过氧化氢的性质。请填写下列空白:
Ⅰ.测定过氧化氢的含量
(1)移取10.00 mL密度为ρ g/mL的过氧化氢溶液至250 mL_______ (填仪器名称)中,加水稀释至刻度,摇匀。移取稀释后的过氧化氢溶液25.00 mL至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释,作被测试样。
(2)用高锰酸钾标准溶液滴定被测试样,其反应的离子方程式为________ 。
(3)判断滴定到达终点的现象是_________________________ 。
(4)重复滴定三次,平均耗用c mol/L KMnO4标准溶液V mL,则原过氧化氢溶液中过氧化氢的质量分数为____________ 。
(5)若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则测定结果_________ (填“偏高”或“偏低”或“不变”)。
Ⅱ.探究过氧化氢的性质
该化学兴趣小组根据所提供的实验条件设计了两个实验,分别证明了过氧化氢的氧化性和不稳定性。(实验条件:试剂只有过氧化氢溶液、氯水、碘化钾淀粉溶液、饱和硫化氢溶液,实验仪器及用品可自选。)
请将他们的实验方法和实验现象填入下表:
Ⅰ.测定过氧化氢的含量
(1)移取10.00 mL密度为ρ g/mL的过氧化氢溶液至250 mL
(2)用高锰酸钾标准溶液滴定被测试样,其反应的离子方程式为
(3)判断滴定到达终点的现象是
(4)重复滴定三次,平均耗用c mol/L KMnO4标准溶液V mL,则原过氧化氢溶液中过氧化氢的质量分数为
(5)若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则测定结果
Ⅱ.探究过氧化氢的性质
该化学兴趣小组根据所提供的实验条件设计了两个实验,分别证明了过氧化氢的氧化性和不稳定性。(实验条件:试剂只有过氧化氢溶液、氯水、碘化钾淀粉溶液、饱和硫化氢溶液,实验仪器及用品可自选。)
请将他们的实验方法和实验现象填入下表:
| 实验内容 | 实验方法 | 实验现象 |
| 验证氧化性 | ||
| 验证不稳定性 |
您最近一年使用:0次
2016-12-09更新
|
571次组卷
|
4卷引用:2015届江苏省扬州中学高三质量检测化学试卷
2015届江苏省扬州中学高三质量检测化学试卷福建省2020届高三化学总复习专题训练——过氧化氢氧化性、还原性的探究三轮冲刺2020届高三化学考题必刷——“拓展综合型”实验探究题(已下线)微专题24 H2O2性质“四重性”探究及应用-备战2022年高考化学考点微专题
11-12高二上·江苏南通·阶段练习
4 . 随着人们日常生活水平的提高,室内空气污染越来越受到人们的重视。造成室内环境污染的有毒物质主要有甲醛、苯、氨、氡、一氧化碳等物质。
请回答下列问题:
⑴苯分子的结构简式为_________ 。
⑵我国《室内空气质量标准》规定室内空气中甲醛(HCHO)含量不得超过0.08mg/m3。某校化学研究性学习小组的同学通过查阅资料,拟采用如下方法测定某新装修居室内空气中甲醛的含量。
测定原理:5HCHO+4KMnO4+6H2SO4=2K2SO4+4MnSO4+5CO2↑+11H2O
实验操作:用容积为1000 mL的医用注射器抽取空气,缓慢注入酸性高锰酸钾溶液中(装置如下),当酸性高锰酸钾溶液正好褪色时,停止注入。

①用0.1000mol/L的酸性KMnO4溶液配制实验中使用的酸性KMnO4溶液1000mL,需0.1000mol/L的酸性KMnO4溶液的体积为_________ 。
②向酸性高锰酸钾溶液中注入空气前,应检查吸收器装置气密性,操作方法为_________ ;装置中多孔玻璃球的作用是___________ 。
③实验时在居室内不同地点抽取空气,并缓慢注入酸性高锰酸钾溶液中。当第200次将注射器中空气全部缓慢注入酸性高锰酸钾溶液中时,酸性高锰酸钾溶液正好褪色。请通过计算说明该居室空气中甲醛含量是否超标(空气中其他成分不与酸性高锰酸钾溶液反应)。
④请你举出减少室内空气污染的一条合理措施:____________ 。
请回答下列问题:
⑴苯分子的结构简式为
⑵我国《室内空气质量标准》规定室内空气中甲醛(HCHO)含量不得超过0.08mg/m3。某校化学研究性学习小组的同学通过查阅资料,拟采用如下方法测定某新装修居室内空气中甲醛的含量。
测定原理:5HCHO+4KMnO4+6H2SO4=2K2SO4+4MnSO4+5CO2↑+11H2O
实验操作:用容积为1000 mL的医用注射器抽取空气,缓慢注入酸性高锰酸钾溶液中(装置如下),当酸性高锰酸钾溶液正好褪色时,停止注入。

①用0.1000mol/L的酸性KMnO4溶液配制实验中使用的酸性KMnO4溶液1000mL,需0.1000mol/L的酸性KMnO4溶液的体积为
②向酸性高锰酸钾溶液中注入空气前,应检查吸收器装置气密性,操作方法为
③实验时在居室内不同地点抽取空气,并缓慢注入酸性高锰酸钾溶液中。当第200次将注射器中空气全部缓慢注入酸性高锰酸钾溶液中时,酸性高锰酸钾溶液正好褪色。请通过计算说明该居室空气中甲醛含量是否超标(空气中其他成分不与酸性高锰酸钾溶液反应)。
④请你举出减少室内空气污染的一条合理措施:
您最近一年使用:0次
名校
5 . 工业废水中常含有一定量氧化性较强的Cr2O72-,利用滴定原理测定Cr2O72-含量方法如下:
步骤Ⅰ:量取30.00 mL废水于锥形瓶中,加入适量稀硫酸酸化。
步骤Ⅱ:加入过量的碘化钾溶液充分反应:Cr2O72-+6I-+14H+=== 2Cr3++3I2+7H2O。
步骤Ⅲ:向锥形瓶中滴入几滴指示剂。用滴定管量取0.1000 mol•L-1Na2S2O3溶液进行滴定,数据记录如下:(I2+2Na2S2O3=== 2NaI+Na2S4O6)
(1)步骤Ⅰ量取30.00 mL废水选择的仪器是_____ 。
(2)步骤Ⅲ中滴加的指示剂为_____ 。滴定达到终点的实验现象是____ 。
(3)步骤Ⅲ中a的读数如图所示,则:
① a=_____ 。

② Cr2O72-的含量为____ g•L-1。
(4)以下操作会造成废水中Cr2O72-含量测定值偏高的是_____ 。
A.滴定终点读数时,俯视滴定管的刻度
B.盛装待测液的锥形瓶用蒸馏水洗过,未用待测液润洗
C.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
D.量取Na2S2O3溶液的滴定管用蒸馏水洗后未用标准液润洗
步骤Ⅰ:量取30.00 mL废水于锥形瓶中,加入适量稀硫酸酸化。
步骤Ⅱ:加入过量的碘化钾溶液充分反应:Cr2O72-+6I-+14H+=== 2Cr3++3I2+7H2O。
步骤Ⅲ:向锥形瓶中滴入几滴指示剂。用滴定管量取0.1000 mol•L-1Na2S2O3溶液进行滴定,数据记录如下:(I2+2Na2S2O3=== 2NaI+Na2S4O6)
| 滴定次数 | Na2S2O3溶液起始读数/mL | Na2S2O3溶液终点读数/mL |
| 第一次 | 1.02 | 19.03 |
| 第二次 | 2.00 | 19.99 |
| 第三次 | 0. 20 | a |
(1)步骤Ⅰ量取30.00 mL废水选择的仪器是
(2)步骤Ⅲ中滴加的指示剂为
(3)步骤Ⅲ中a的读数如图所示,则:
① a=

② Cr2O72-的含量为
(4)以下操作会造成废水中Cr2O72-含量测定值偏高的是
A.滴定终点读数时,俯视滴定管的刻度
B.盛装待测液的锥形瓶用蒸馏水洗过,未用待测液润洗
C.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
D.量取Na2S2O3溶液的滴定管用蒸馏水洗后未用标准液润洗
您最近一年使用:0次
2018-07-01更新
|
902次组卷
|
12卷引用:【全国市级联考】江苏省宿迁市2017-2018学年高二下学期期末考试化学试题
【全国市级联考】江苏省宿迁市2017-2018学年高二下学期期末考试化学试题浙江省山河联盟2021-2022学年高二上学期12月考试化学试题河南省信阳高级中学2021-2022学年高一下学期第四次月考化学试题第二节 水的电离和溶液的pH 第3课时 酸碱中和滴定河南省鹤壁市第一中学2022-2023学年高二上学期期末检测化学试题重庆市铜梁一中等三校2022-2023学年高二上学期期末考试化学试题 四川省内江市第六中学2022-2023学年高二下学期第一次月考化学试题(已下线)题型43 氧化还原滴定—-重铬酸钾法内蒙古呼和浩特市第一中学2023-2024学年高二上学期期中考试化学试题浙江省嘉兴高级中学2023-2024学年高二上学期期中考试化学试题 四川省广安市华蓥中学2023-2024学年高二下学期开学化学试题内蒙古呼和浩特市回民区2023-2024学年高二上学期期中考试化学试题



