解题方法
1 . 乙酸是典型的有机酸,在生产、生活中有广泛应用.乙酸作为化工原料可以制备氢气,以乙酸为原料制备氢气时的反应:
反应1(热裂解):
反应2(脱羧基):
(1) 中形成
中形成____________ 中心____________ 电子的大π键;

____________  。
。
(2)向一恒容密闭容器中充入一定量的乙酸气体发生反应1和反应2,反应相同时间后,测得部分气体产率与温度的关系如图。 之后氢气产率高于甲烷,试说明理由:
之后氢气产率高于甲烷,试说明理由:_____________________________ 。
②一定温度下,若在充入容器的乙酸气体中掺杂一定量水蒸气,氢气产率显著提高而 产率下降,分析可能原因:
产率下降,分析可能原因:____________________________ (用化学方程式表示)。
(3)采用光催化反应技术直接合成乙酸,可符合原子经济学(原子利用率100%)。下列原料组合符合要求的是____________ (填标号)。
A.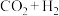 B.
B.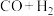 C.
C.
(4)若利用合适的催化剂控制其他副反应(只发生反应1和反应2),温度为 时反应达到平衡,此时总压强为力
时反应达到平衡,此时总压强为力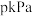 ,反应1消耗起始乙酸总量的30%,反应2消耗起始乙酸总量的50%,则平衡时
,反应1消耗起始乙酸总量的30%,反应2消耗起始乙酸总量的50%,则平衡时 体积分数为
体积分数为____________ %;反应2的平衡常数
____________  (
( 为以分压表示的平衡常数,分压=总压×体积分数,计算结果用最简式表示)。
为以分压表示的平衡常数,分压=总压×体积分数,计算结果用最简式表示)。
(5)研究 在水溶液中的电离平衡有重要意义。若室温下将
在水溶液中的电离平衡有重要意义。若室温下将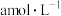 的
的 溶液和
溶液和 溶液等体积混合,恢复至室温后混合溶液中存在
溶液等体积混合,恢复至室温后混合溶液中存在 。则乙酸的电离平衡常数
。则乙酸的电离平衡常数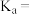
____________ (用含a和b的代数式表示)。
反应1(热裂解):

反应2(脱羧基):

(1)
 中形成
中形成

 。
。(2)向一恒容密闭容器中充入一定量的乙酸气体发生反应1和反应2,反应相同时间后,测得部分气体产率与温度的关系如图。

 之后氢气产率高于甲烷,试说明理由:
之后氢气产率高于甲烷,试说明理由:②一定温度下,若在充入容器的乙酸气体中掺杂一定量水蒸气,氢气产率显著提高而
 产率下降,分析可能原因:
产率下降,分析可能原因:(3)采用光催化反应技术直接合成乙酸,可符合原子经济学(原子利用率100%)。下列原料组合符合要求的是
A.
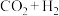 B.
B.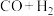 C.
C.
(4)若利用合适的催化剂控制其他副反应(只发生反应1和反应2),温度为
 时反应达到平衡,此时总压强为力
时反应达到平衡,此时总压强为力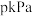 ,反应1消耗起始乙酸总量的30%,反应2消耗起始乙酸总量的50%,则平衡时
,反应1消耗起始乙酸总量的30%,反应2消耗起始乙酸总量的50%,则平衡时 体积分数为
体积分数为
 (
( 为以分压表示的平衡常数,分压=总压×体积分数,计算结果用最简式表示)。
为以分压表示的平衡常数,分压=总压×体积分数,计算结果用最简式表示)。(5)研究
 在水溶液中的电离平衡有重要意义。若室温下将
在水溶液中的电离平衡有重要意义。若室温下将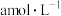 的
的 溶液和
溶液和 溶液等体积混合,恢复至室温后混合溶液中存在
溶液等体积混合,恢复至室温后混合溶液中存在 。则乙酸的电离平衡常数
。则乙酸的电离平衡常数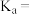
您最近一年使用:0次
名校
解题方法
2 . 二氧化铈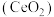 是一种用途广泛的稀土化合物。以氟碳铈矿(主要含
是一种用途广泛的稀土化合物。以氟碳铈矿(主要含 )为原料制备
)为原料制备 的一种工艺流程如图所示:
的一种工艺流程如图所示: 能与
能与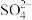 结合成
结合成 ;
;
②在硫酸体系中 能被萃取剂
能被萃取剂 萃取,而
萃取,而 不能。
不能。
回答下列问题:
(1)“氧化焙烧”中氧化的目的是___________ 。
(2)“酸浸”时提高浸取率的方法___________ (写出一种)。
(3)“萃取”时存在反应: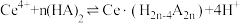 ,Ce4+的萃取率与温度、稀硫酸的浓度的变化关系如图所示,应选择的最适宜条件为
,Ce4+的萃取率与温度、稀硫酸的浓度的变化关系如图所示,应选择的最适宜条件为___________ (填标号);硫酸浓度过大时,萃取率降低的原因是___________ 。
(4)“反萃取”中,在稀硫酸和 的作用下
的作用下 转化为
转化为 ,反应的离子方程式为:
,反应的离子方程式为:___________ 。
(5)向水层中加入 溶液来调节溶液的
溶液来调节溶液的 ,
, 大于
大于___________ 时, 完全生成
完全生成 沉淀。(已知Ksp[Ce(OH)3]=1.0×10-20;当溶液中某离子浓度c<1.0×10-5mol·L-1时,可认为该离子沉淀完全。)
沉淀。(已知Ksp[Ce(OH)3]=1.0×10-20;当溶液中某离子浓度c<1.0×10-5mol·L-1时,可认为该离子沉淀完全。)
(6)二氧化铈( )作为一种脱硝催化剂,能在
)作为一种脱硝催化剂,能在 和
和 之间改变氧化状态,将NO氧化为
之间改变氧化状态,将NO氧化为 ,并引起氧空位的形成,得到新的铈氧化物
,并引起氧空位的形成,得到新的铈氧化物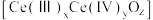 。铈氧化物晶胞发生的变化如下图所示,生成新的铈氧化物中x、y、z的最简整数比为
。铈氧化物晶胞发生的变化如下图所示,生成新的铈氧化物中x、y、z的最简整数比为___________ ,当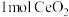 发生如图所示变化时,可吸收标况下NO的体积为
发生如图所示变化时,可吸收标况下NO的体积为___________ 。
 是一种用途广泛的稀土化合物。以氟碳铈矿(主要含
是一种用途广泛的稀土化合物。以氟碳铈矿(主要含 )为原料制备
)为原料制备 的一种工艺流程如图所示:
的一种工艺流程如图所示:
 能与
能与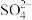 结合成
结合成 ;
;②在硫酸体系中
 能被萃取剂
能被萃取剂 萃取,而
萃取,而 不能。
不能。回答下列问题:
(1)“氧化焙烧”中氧化的目的是
(2)“酸浸”时提高浸取率的方法
(3)“萃取”时存在反应:
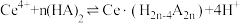 ,Ce4+的萃取率与温度、稀硫酸的浓度的变化关系如图所示,应选择的最适宜条件为
,Ce4+的萃取率与温度、稀硫酸的浓度的变化关系如图所示,应选择的最适宜条件为
(4)“反萃取”中,在稀硫酸和
 的作用下
的作用下 转化为
转化为 ,反应的离子方程式为:
,反应的离子方程式为:(5)向水层中加入
 溶液来调节溶液的
溶液来调节溶液的 ,
, 大于
大于 完全生成
完全生成 沉淀。(已知Ksp[Ce(OH)3]=1.0×10-20;当溶液中某离子浓度c<1.0×10-5mol·L-1时,可认为该离子沉淀完全。)
沉淀。(已知Ksp[Ce(OH)3]=1.0×10-20;当溶液中某离子浓度c<1.0×10-5mol·L-1时,可认为该离子沉淀完全。)(6)二氧化铈(
 )作为一种脱硝催化剂,能在
)作为一种脱硝催化剂,能在 和
和 之间改变氧化状态,将NO氧化为
之间改变氧化状态,将NO氧化为 ,并引起氧空位的形成,得到新的铈氧化物
,并引起氧空位的形成,得到新的铈氧化物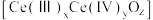 。铈氧化物晶胞发生的变化如下图所示,生成新的铈氧化物中x、y、z的最简整数比为
。铈氧化物晶胞发生的变化如下图所示,生成新的铈氧化物中x、y、z的最简整数比为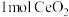 发生如图所示变化时,可吸收标况下NO的体积为
发生如图所示变化时,可吸收标况下NO的体积为
您最近一年使用:0次
3 . 羟胺(NH2OH)是白色片状晶体,熔点为32.05℃,极易溶于水,受热易分解生成NH3和N2,常用作还原剂,也用作合成抗癌药和农药的原料。羟胺结构可看做是氨分子内的1个氢原子被羟基取代而形成。
已知: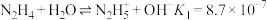 ;
;
 。
。
有关反应的方程式错误的是
已知:
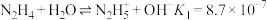 ;
; 。
。有关反应的方程式错误的是
A.羟胺还原 的反应: 的反应: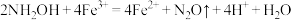 |
B.羟胺分解的反应: |
C.向羟胺溶液中滴加过量稀硫酸: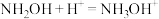 |
D.向(NH4)2SO4溶液中加入NH2OH: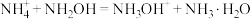 |
您最近一年使用:0次
名校
解题方法
4 . 资源化利用CO2,不仅可以减少温室气体的排放,还可以获得燃料或重要的化工产品。
(1)CO2的捕集:
①CO2属于___________ 分子(填“极性”或“非极性”),其晶体(干冰)属于__________ 晶体。
②用饱和 溶液做吸收剂可“捕集”CO2。若所得溶液
溶液做吸收剂可“捕集”CO2。若所得溶液 ,溶液中c(HCO
,溶液中c(HCO ):c(CO
):c(CO )=
)=_______ ;(室温下, 的K1=4×10-7;K2=5×10-11)若吸收剂失效,可利用NaOH溶液使其再生,写出该反应的离子方程式
的K1=4×10-7;K2=5×10-11)若吸收剂失效,可利用NaOH溶液使其再生,写出该反应的离子方程式_____ 。
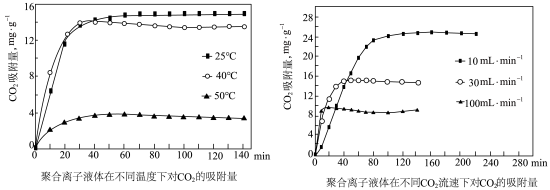
③聚合离子液体是目前广泛研究的CO2吸附剂。结合下图 分析聚合离子液体吸附CO2的有利条件是____________ 。
(2)生产尿素:工业上以CO2、 为原料生产尿素[CO(NH2)2],该反应分为二步进行:
为原料生产尿素[CO(NH2)2],该反应分为二步进行:
第一步: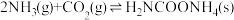
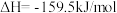
第二步:
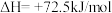
写出上述合成尿素的热化学方程式_______ 。
(3)合成乙酸:中国科学家首次以 、CO2和H2为原料高效合成乙酸,其反应路径如图所示:
、CO2和H2为原料高效合成乙酸,其反应路径如图所示:
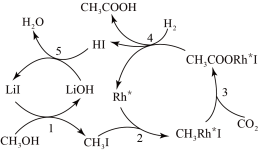
①原料中的 可通过电解法由
可通过电解法由 制取,用稀硫酸作电解质溶液,写出生成
制取,用稀硫酸作电解质溶液,写出生成 的电极反应式:
的电极反应式:____________ 。
②根据图示 ,写出总反应的化学方程式:_______ 。
(1)CO2的捕集:
①CO2属于
②用饱和
 溶液做吸收剂可“捕集”CO2。若所得溶液
溶液做吸收剂可“捕集”CO2。若所得溶液 ,溶液中c(HCO
,溶液中c(HCO ):c(CO
):c(CO )=
)= 的K1=4×10-7;K2=5×10-11)若吸收剂失效,可利用NaOH溶液使其再生,写出该反应的离子方程式
的K1=4×10-7;K2=5×10-11)若吸收剂失效,可利用NaOH溶液使其再生,写出该反应的离子方程式③聚合离子液体是目前广泛研究的CO2吸附剂。

(2)生产尿素:工业上以CO2、
 为原料生产尿素[CO(NH2)2],该反应分为二步进行:
为原料生产尿素[CO(NH2)2],该反应分为二步进行:第一步:
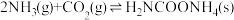
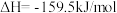
第二步:

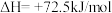
写出上述合成尿素的热化学方程式
(3)合成乙酸:中国科学家首次以
 、CO2和H2为原料高效合成乙酸,其反应路径如图所示:
、CO2和H2为原料高效合成乙酸,其反应路径如图所示:
①原料中的
 可通过电解法由
可通过电解法由 制取,用稀硫酸作电解质溶液,写出生成
制取,用稀硫酸作电解质溶液,写出生成 的电极反应式:
的电极反应式:②
您最近一年使用:0次
2024-04-04更新
|
359次组卷
|
3卷引用:辽宁省实验中学2024届高三高考适应性测试(二)化学试题
名校
5 . 二氧化碳的捕获、利用是实现碳中和的一个重要战略方向。回答下列问题:
(1)已知:常温下,反应CaO(s)+CO2(g) CaCO3(s)能自发进行。则该反应为
CaCO3(s)能自发进行。则该反应为____ (填“吸热”或“放热”)反应;上述反应达到平衡后,若其他条件不变,增大CaO的用量,CO2的转化率将____ (填“增大”“减小”或“不变”)。
(2)工业上以CO2和H2为原料合成CH3OH涉及的主要反应如下:
反应I.CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H1=-49kJ·mol-1
CH3OH(g)+H2O(g) △H1=-49kJ·mol-1
反应II.CO2(g)+H2(g) CO(g)+H2O(g) △H2=+41kJ·mol-1
CO(g)+H2O(g) △H2=+41kJ·mol-1
①将反应物混合气按进料比n(CO2):n(H2)=1:3通入反应装置,选择合适的催化剂发生反应。
不同温度和压强下,CH3OH平衡产率如图所示。则图中的压强p1____ (填“>”“=”或“<”)p2,推断的依据是____ 。
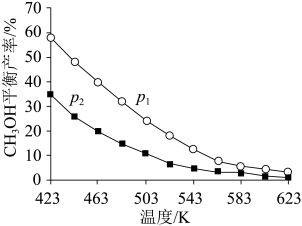
②T℃时,在体积为V的密闭容器中,反应I、II均达到化学平衡,CO2转化率为25%,且生成等物质的量的CH3OH和CO,则该温度下反应II的平衡常数的值为_____ (用分数表示)。
(3)调节溶液pH可实现工业废气中CO2的捕获和释放。已知20℃时碳酸的电离常数为Ka1、Ka2,当溶液pH=11时,c(H2CO3):c(HCO ):c(CO
):c(CO )=1:
)=1:____ :____ 。(用Ka1、Ka2表示)
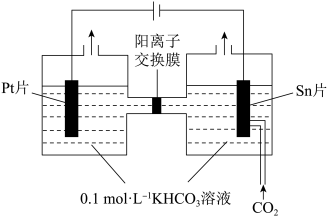
(4)电解CO2制HCOOH的原理如图所示,写出在Sn片上发生的电极反应式:____ 。
(1)已知:常温下,反应CaO(s)+CO2(g)
 CaCO3(s)能自发进行。则该反应为
CaCO3(s)能自发进行。则该反应为(2)工业上以CO2和H2为原料合成CH3OH涉及的主要反应如下:
反应I.CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H1=-49kJ·mol-1
CH3OH(g)+H2O(g) △H1=-49kJ·mol-1反应II.CO2(g)+H2(g)
 CO(g)+H2O(g) △H2=+41kJ·mol-1
CO(g)+H2O(g) △H2=+41kJ·mol-1①将反应物混合气按进料比n(CO2):n(H2)=1:3通入反应装置,选择合适的催化剂发生反应。
不同温度和压强下,CH3OH平衡产率如图所示。则图中的压强p1

②T℃时,在体积为V的密闭容器中,反应I、II均达到化学平衡,CO2转化率为25%,且生成等物质的量的CH3OH和CO,则该温度下反应II的平衡常数的值为
(3)调节溶液pH可实现工业废气中CO2的捕获和释放。已知20℃时碳酸的电离常数为Ka1、Ka2,当溶液pH=11时,c(H2CO3):c(HCO
 ):c(CO
):c(CO )=1:
)=1:(4)电解CO2制HCOOH的原理如图所示,写出在Sn片上发生的电极反应式:

您最近一年使用:0次
2022-07-14更新
|
109次组卷
|
3卷引用:辽宁省朝阳市建平县2023-2024学年高二上学期1月期末化学试题



