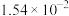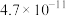1 . 食醋是烹饪美食的调味品,有效成分主要为乙酸,回答下列问题:
(1)乙酸俗称醋酸,乙酸可凝结为类似冰一样的晶体,又叫___________ ,乙酸的官能团是___________ (写名称).
(2)实验室常用图装置制备乙酸乙酯.
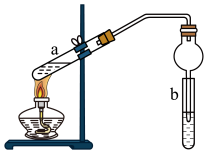
①a试管中装有乙酸、无水乙醇、浓硫酸,b试管中液体是___________ ,浓硫酸的作用是___________ ,a试管中主要反应的化学方程式为______________________________ .
②在实验中球形干燥管除起冷凝作用外,另一个重要作用是___________ .
(3)醋酸能除水垢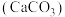 ,写出该反应的离子方程式:
,写出该反应的离子方程式:_________________________ .
(4) ,将
,将 的醋酸溶液加水稀释,请填写下列表达式中的数据情况(填“变大”“变小”或“不变”).
的醋酸溶液加水稀释,请填写下列表达式中的数据情况(填“变大”“变小”或“不变”).
①
___________ ;②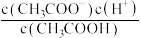
___________ ;③
___________ .
(5)室温下,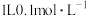 醋酸溶液
醋酸溶液 ,则该温度下醋酸电离平衡常数
,则该温度下醋酸电离平衡常数 ,约为
,约为___________ .
(1)乙酸俗称醋酸,乙酸可凝结为类似冰一样的晶体,又叫
(2)实验室常用图装置制备乙酸乙酯.

①a试管中装有乙酸、无水乙醇、浓硫酸,b试管中液体是
②在实验中球形干燥管除起冷凝作用外,另一个重要作用是
(3)醋酸能除水垢
 ,写出该反应的离子方程式:
,写出该反应的离子方程式:(4)
 ,将
,将 的醋酸溶液加水稀释,请填写下列表达式中的数据情况(填“变大”“变小”或“不变”).
的醋酸溶液加水稀释,请填写下列表达式中的数据情况(填“变大”“变小”或“不变”).①

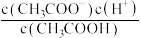

(5)室温下,
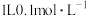 醋酸溶液
醋酸溶液 ,则该温度下醋酸电离平衡常数
,则该温度下醋酸电离平衡常数 ,约为
,约为
您最近一年使用:0次
2 . 能够抵抗外加少量强酸、强碱或水稀释,而保持pH基本不变的溶液称为缓冲溶液。某化学学习小组配制不同浓度的NH4Cl-NH3缓冲溶液,探究c(NH4Cl)/c(NH3)对缓冲溶液抗酸和抗碱的影响。
实验1:配制缓冲溶液
该小组先配制0.1mol·L-1NH4Cl溶液和0.1mol·L-1氨水,再将NH4Cl溶液和氨水按照1:4、1:1和4:1的比例混合后,分别配制成15mL缓冲溶液①、②、③,测得pH分别为10.6、10.1和9.6。
实验2:探究c(NH4Cl)/c(NH3)对缓冲溶液抗酸、抗碱能力的影响
分别向滴定管中加入0.1mol·L-1盐酸和0.1mol·L-1NaOH溶液,逐滴滴入缓冲溶液①②③和等量蒸馏水中,测得pH与滴入的盐酸、NaOH溶液体积的关系如图所示。

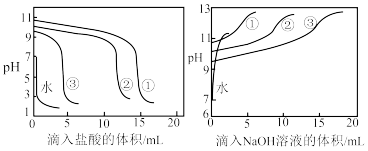
对于实验2,下列说法错误的是
实验1:配制缓冲溶液
该小组先配制0.1mol·L-1NH4Cl溶液和0.1mol·L-1氨水,再将NH4Cl溶液和氨水按照1:4、1:1和4:1的比例混合后,分别配制成15mL缓冲溶液①、②、③,测得pH分别为10.6、10.1和9.6。
实验2:探究c(NH4Cl)/c(NH3)对缓冲溶液抗酸、抗碱能力的影响
分别向滴定管中加入0.1mol·L-1盐酸和0.1mol·L-1NaOH溶液,逐滴滴入缓冲溶液①②③和等量蒸馏水中,测得pH与滴入的盐酸、NaOH溶液体积的关系如图所示。


对于实验2,下列说法错误的是
| A.c(NH4Cl)/c(NH3)=4:1时,缓冲溶液抗碱能力最强 |
| B.c(NH4Cl)/c(NH3)不变时,c(NH4Cl)+c(NH3)越大,抗酸抗碱能力越强 |
| C.缓冲溶液抗酸、抗碱最佳比例为c(NH4Cl)/c(NH3)=1:1 |
| D.向上述缓冲溶液中加入少量盐酸或NaOH溶液时,水的电离程度均增加 |
您最近一年使用:0次
3 . 回答下列问题
(1)下列物质中属于强电解质的是___________ (填序号)。
①稀硫酸 ②硫酸钡 ③熔融氯化钠 ④氯水 ⑤醋酸铵
(2)已知水的电离平衡曲线如图所示。
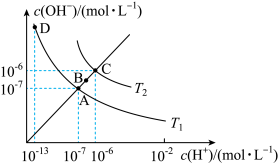
①写出使A点变为B点的措施:___________ ,采取该措施的原因是___________ 。
②向水中滴加适量NaOH溶液可实现A点→D点的变化,则D点对应溶液的pH为___________ 。
③ ℃时,
℃时, 的NaOH溶液中
的NaOH溶液中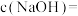
___________ ,若向该溶液中滴加 盐酸使溶液呈中性,则所用溶液的体积比
盐酸使溶液呈中性,则所用溶液的体积比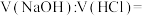
___________ 。
(3)常温下,碳酸的电离平衡常数为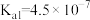 、
、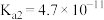 ;次氯酸的电离平衡常数
;次氯酸的电离平衡常数 。向NaClO溶液中通入少量
。向NaClO溶液中通入少量 ,发生反应的离子方程式为
,发生反应的离子方程式为___________ 。
(1)下列物质中属于强电解质的是
①稀硫酸 ②硫酸钡 ③熔融氯化钠 ④氯水 ⑤醋酸铵
(2)已知水的电离平衡曲线如图所示。

①写出使A点变为B点的措施:
②向水中滴加适量NaOH溶液可实现A点→D点的变化,则D点对应溶液的pH为
③
 ℃时,
℃时, 的NaOH溶液中
的NaOH溶液中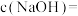
 盐酸使溶液呈中性,则所用溶液的体积比
盐酸使溶液呈中性,则所用溶液的体积比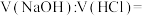
(3)常温下,碳酸的电离平衡常数为
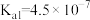 、
、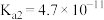 ;次氯酸的电离平衡常数
;次氯酸的电离平衡常数 。向NaClO溶液中通入少量
。向NaClO溶液中通入少量 ,发生反应的离子方程式为
,发生反应的离子方程式为
您最近一年使用:0次
名校
4 . 砷(As)与氮(N)是同主族元素,它们的化合物在生活、生产和科学研究中有重要的作用。
(1)亚硝酸钠(NaNO2)的外观与食盐非常相似,但有毒。某小组欲鉴别NaCl与NaNO2,常温下,用pH试纸分别测定0.1 mol∙L−1两种盐溶液的pH,测得NaNO2溶液的pH=9,即NaNO2溶液呈碱性,其原因为___________ (用离子方程式表示)。常温下,HNO2电离常数Ka(HNO2)约为___________ 。
(2)查阅资料知:5 +2
+2 +6H+=5
+6H+=5 +3Mn2++3H2O;
+3Mn2++3H2O; +5Fe2++8H+=Mn2++5Fe3++4H2O。该小组设计如下方案测定NaNO2样品的纯度(含NaNO3杂质):取样品2.3 g经溶解后得到溶液A 100 mL,准确量取10.00 mL A与24.00 mL 0.0500 mol∙L−1的酸性高锰酸钾溶液在锥形瓶中充分反应。反应后的溶液用0.1000 mol∙L−1 (NH4)2Fe(SO4)2标准溶液滴定至紫色刚好褪去;重复上述实验3次,平均消耗(NH4)2Fe(SO4)2溶液10.00 mL,则样品中NaNO2的纯度为
+5Fe2++8H+=Mn2++5Fe3++4H2O。该小组设计如下方案测定NaNO2样品的纯度(含NaNO3杂质):取样品2.3 g经溶解后得到溶液A 100 mL,准确量取10.00 mL A与24.00 mL 0.0500 mol∙L−1的酸性高锰酸钾溶液在锥形瓶中充分反应。反应后的溶液用0.1000 mol∙L−1 (NH4)2Fe(SO4)2标准溶液滴定至紫色刚好褪去;重复上述实验3次,平均消耗(NH4)2Fe(SO4)2溶液10.00 mL,则样品中NaNO2的纯度为___________ 。通过上述实验测得样品中NaNO2的纯度偏高,该小组讨论的原因错误的是___________ (填字母编号)。
a.滴定至溶液紫色刚好褪去,立即停止滴定
b.加入A与KMnO4溶液前的锥形瓶未经干燥
c.实验中使用的(NH4)2Fe(SO4)2溶液暴露在空气中的时间过长
(3)已知常温下,Ksp(AgNO2)=2×10−8,Ksp(AgCl)=1.8×10−10.分别向同浓度的两种盐溶液中滴入向同浓度的AgNO3溶液,先出现的沉淀是___________ (填化学式)。欲用1L NaNO2溶液将0.01mol AgCl完全转化为AgNO2,则NaNO2溶液的浓度需要满足___________ 。
(4)25℃时,10mL 0.3 mol∙L−1 Na3AsO3溶液、10mL 0.3 mol∙L−1 I2溶液的的水溶液和10mL NaOH溶液混合,发生反应: (aq)+I2(aq)+2OH-(aq)
(aq)+I2(aq)+2OH-(aq) 
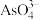 (aq)+2I-(aq)+H2O(l)。溶液中c(I-)与反应时间(t)的关系如图所示(溶液体积变化忽略不计):
(aq)+2I-(aq)+H2O(l)。溶液中c(I-)与反应时间(t)的关系如图所示(溶液体积变化忽略不计):
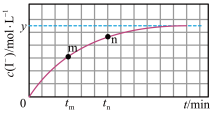
①m点时υ逆___________ n点时υ正(填“>”、“=”或“<”)。
②若平衡时溶液的pH=13,该反应的平衡常数K=___________ (用含y的代数式表示)。
(5)已知H3AsO4的电离常数分别为Ka1=6.3×10−2,Ka2=1.0×10−7,Ka3=3.2×10−12。
①25℃时,0.1 mol∙L−1的NaH2AsO4溶液中:c(H3AsO4)___________ c( )(填“>”、“=”或“<”)。
)(填“>”、“=”或“<”)。
②25℃时,向10mL 0.1 mol∙L−1的H3AsO4溶液中逐滴滴加1 mol∙L−1 NaOH溶液至中性,此时混合溶液中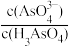 =
=___________ 。
(1)亚硝酸钠(NaNO2)的外观与食盐非常相似,但有毒。某小组欲鉴别NaCl与NaNO2,常温下,用pH试纸分别测定0.1 mol∙L−1两种盐溶液的pH,测得NaNO2溶液的pH=9,即NaNO2溶液呈碱性,其原因为
(2)查阅资料知:5
 +2
+2 +6H+=5
+6H+=5 +3Mn2++3H2O;
+3Mn2++3H2O; +5Fe2++8H+=Mn2++5Fe3++4H2O。该小组设计如下方案测定NaNO2样品的纯度(含NaNO3杂质):取样品2.3 g经溶解后得到溶液A 100 mL,准确量取10.00 mL A与24.00 mL 0.0500 mol∙L−1的酸性高锰酸钾溶液在锥形瓶中充分反应。反应后的溶液用0.1000 mol∙L−1 (NH4)2Fe(SO4)2标准溶液滴定至紫色刚好褪去;重复上述实验3次,平均消耗(NH4)2Fe(SO4)2溶液10.00 mL,则样品中NaNO2的纯度为
+5Fe2++8H+=Mn2++5Fe3++4H2O。该小组设计如下方案测定NaNO2样品的纯度(含NaNO3杂质):取样品2.3 g经溶解后得到溶液A 100 mL,准确量取10.00 mL A与24.00 mL 0.0500 mol∙L−1的酸性高锰酸钾溶液在锥形瓶中充分反应。反应后的溶液用0.1000 mol∙L−1 (NH4)2Fe(SO4)2标准溶液滴定至紫色刚好褪去;重复上述实验3次,平均消耗(NH4)2Fe(SO4)2溶液10.00 mL,则样品中NaNO2的纯度为a.滴定至溶液紫色刚好褪去,立即停止滴定
b.加入A与KMnO4溶液前的锥形瓶未经干燥
c.实验中使用的(NH4)2Fe(SO4)2溶液暴露在空气中的时间过长
(3)已知常温下,Ksp(AgNO2)=2×10−8,Ksp(AgCl)=1.8×10−10.分别向同浓度的两种盐溶液中滴入向同浓度的AgNO3溶液,先出现的沉淀是
(4)25℃时,10mL 0.3 mol∙L−1 Na3AsO3溶液、10mL 0.3 mol∙L−1 I2溶液的的水溶液和10mL NaOH溶液混合,发生反应:
 (aq)+I2(aq)+2OH-(aq)
(aq)+I2(aq)+2OH-(aq) 
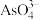 (aq)+2I-(aq)+H2O(l)。溶液中c(I-)与反应时间(t)的关系如图所示(溶液体积变化忽略不计):
(aq)+2I-(aq)+H2O(l)。溶液中c(I-)与反应时间(t)的关系如图所示(溶液体积变化忽略不计):
①m点时υ逆
②若平衡时溶液的pH=13,该反应的平衡常数K=
(5)已知H3AsO4的电离常数分别为Ka1=6.3×10−2,Ka2=1.0×10−7,Ka3=3.2×10−12。
①25℃时,0.1 mol∙L−1的NaH2AsO4溶液中:c(H3AsO4)
 )(填“>”、“=”或“<”)。
)(填“>”、“=”或“<”)。②25℃时,向10mL 0.1 mol∙L−1的H3AsO4溶液中逐滴滴加1 mol∙L−1 NaOH溶液至中性,此时混合溶液中
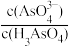 =
=
您最近一年使用:0次
5 . 电解质的溶液中存在着众多的化学平衡。已知室温下,电离平衡常数如下表
(1)室温下,有浓度均为 的五种溶液①
的五种溶液① 、②
、② 、③
、③ 、④
、④ 、⑤
、⑤ ,溶液的pH
,溶液的pH由大到小 的顺序为___________ (填序号)。比较溶液③和④中 的物质的量浓度:③
的物质的量浓度:③___________ ④(填“<”、“=”或“>”)。为确定溶液①稀释后的精确浓度,取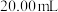 待测溶液①于锥形瓶中,用浓度为
待测溶液①于锥形瓶中,用浓度为 的NaOH标准溶液滴定。为了确定滴定终点,还需要加入的试剂为
的NaOH标准溶液滴定。为了确定滴定终点,还需要加入的试剂为___________ ,达到滴定终点的现象为___________ 。在滴定实验过程中,下列仪器中有蒸馏水,对实验结果没有影响的是___________ (“滴定管”或“锥形瓶”)。经3次平行实验,达到滴定终点时,消耗氢氧化钠标准溶液体积的平均值为 ,则①所得溶液的准确浓度为
,则①所得溶液的准确浓度为___________  。
。
(2)根据以上的电离平衡常数,判断下列说法正确的是___________。
(3)根据以上的电离平衡常数,25℃时,浓度均为 的
的 溶液和
溶液和 溶液,两溶液中
溶液,两溶液中
___________ (填“>”“<”或“=”) 。若要使两溶液的pH相等,可
。若要使两溶液的pH相等,可___________ (填序号)。
A.向 溶液中加适量水 B.向
溶液中加适量水 B.向 溶液中加适量NaOH固体
溶液中加适量NaOH固体
C.向 溶液中加
溶液中加 固体 D.向
固体 D.向 溶液中加适量的水
溶液中加适量的水
(4)草酸 是二元弱酸。室温下,向
是二元弱酸。室温下,向 溶液中加入
溶液中加入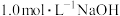 溶液调节pH,加水控制溶液体积为
溶液调节pH,加水控制溶液体积为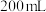 。测得溶液中微粒的
。测得溶液中微粒的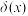 随pH变化曲线如图所示,
随pH变化曲线如图所示, ,x代表微粒
,x代表微粒 、
、 或
或 。
。

①当加入NaOH溶液的体积为 时,
时,
___________ (写关系式)。
②c点,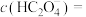
___________  。
。
物质 |
|
|
|
|
|
|
|
|
|
|
|
|
|
| —— | —— | —— |
 的五种溶液①
的五种溶液① 、②
、② 、③
、③ 、④
、④ 、⑤
、⑤ ,溶液的pH
,溶液的pH 的物质的量浓度:③
的物质的量浓度:③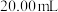 待测溶液①于锥形瓶中,用浓度为
待测溶液①于锥形瓶中,用浓度为 的NaOH标准溶液滴定。为了确定滴定终点,还需要加入的试剂为
的NaOH标准溶液滴定。为了确定滴定终点,还需要加入的试剂为 ,则①所得溶液的准确浓度为
,则①所得溶液的准确浓度为 。
。(2)根据以上的电离平衡常数,判断下列说法正确的是___________。
A.相同条件下,同浓度的 溶液和 溶液和 溶液的碱性,前者更强 溶液的碱性,前者更强 |
B. 溶液中通入少量 溶液中通入少量 : : |
C. 溶液中通入少量 溶液中通入少量 : :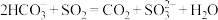 |
D.向氯水中分别加入等浓度的 和 和 溶液,均可提高氯水中 溶液,均可提高氯水中 的浓度 的浓度 |
 的
的 溶液和
溶液和 溶液,两溶液中
溶液,两溶液中
 。若要使两溶液的pH相等,可
。若要使两溶液的pH相等,可A.向
 溶液中加适量水 B.向
溶液中加适量水 B.向 溶液中加适量NaOH固体
溶液中加适量NaOH固体C.向
 溶液中加
溶液中加 固体 D.向
固体 D.向 溶液中加适量的水
溶液中加适量的水(4)草酸
 是二元弱酸。室温下,向
是二元弱酸。室温下,向 溶液中加入
溶液中加入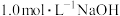 溶液调节pH,加水控制溶液体积为
溶液调节pH,加水控制溶液体积为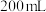 。测得溶液中微粒的
。测得溶液中微粒的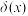 随pH变化曲线如图所示,
随pH变化曲线如图所示, ,x代表微粒
,x代表微粒 、
、 或
或 。
。
①当加入NaOH溶液的体积为
 时,
时,
②c点,
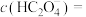
 。
。
您最近一年使用:0次
名校
解题方法
6 . 回答下列问题:
(1)常温下,将pH=9的NaOH溶液稀释1000倍,溶液中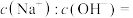
______
(2)常温下,已知醋酸的电离常数为Ka,向100mL0.1mol/L的醋酸溶液中,加入______ mL0.1mol/L的NaOH,可使反应所得的溶液pH=7(用含Ka的式子表达)
(3)常温下,100mLpH=0盐酸和硫酸的混合溶液中加入200mLpH=13的 ,恰好沉淀完全,则原溶液中c(HCl)=
,恰好沉淀完全,则原溶液中c(HCl)=______
(4)常温下,设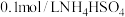 溶液的pH为a,则
溶液的pH为a,则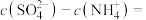
______ (用含a的精确式子表达)
(1)常温下,将pH=9的NaOH溶液稀释1000倍,溶液中
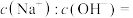
(2)常温下,已知醋酸的电离常数为Ka,向100mL0.1mol/L的醋酸溶液中,加入
(3)常温下,100mLpH=0盐酸和硫酸的混合溶液中加入200mLpH=13的
 ,恰好沉淀完全,则原溶液中c(HCl)=
,恰好沉淀完全,则原溶液中c(HCl)=(4)常温下,设
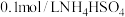 溶液的pH为a,则
溶液的pH为a,则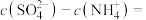
您最近一年使用:0次
7 . 已知:25℃时, 、HClO、
、HClO、 ,
, 的电离平衡常数如表所示,
的电离平衡常数如表所示, 。请回答下列问题。
。请回答下列问题。
(1)等浓度的四种酸溶液的酸性由强到弱的顺序是_________ 。
(2)写出HClO在水中的电离方程式:_________ 。
(3)将10 mL 0.1 mol⋅L
 溶液逐滴滴入50 mL 0.1 mol⋅L
溶液逐滴滴入50 mL 0.1 mol⋅L
 溶液中,现象为
溶液中,现象为_________ ,写出反应的离子方程式_________ 。
(4)若将少量的 气体通入NaClO溶液中,反应的离子方程式为
气体通入NaClO溶液中,反应的离子方程式为_________ 。
(5)25℃时,取50 mL 0.1 mol⋅L
 溶液,将其稀释100倍。
溶液,将其稀释100倍。
①稀释前 的电离度(
的电离度(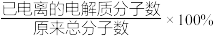 )约为
)约为_________ (保留三位有效数字)%。
②在稀释过程中,随着 浓度的降低,
浓度的降低, 逐渐
逐渐_________ (填“增大”、“减小”或“不变”)。
 、HClO、
、HClO、 ,
, 的电离平衡常数如表所示,
的电离平衡常数如表所示, 。请回答下列问题。
。请回答下列问题。| 物质 |  | HClO |  |  |
| 电离平衡常数 | 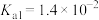 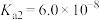 | 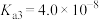 | 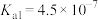  |  |
(2)写出HClO在水中的电离方程式:
(3)将10 mL 0.1 mol⋅L

 溶液逐滴滴入50 mL 0.1 mol⋅L
溶液逐滴滴入50 mL 0.1 mol⋅L
 溶液中,现象为
溶液中,现象为(4)若将少量的
 气体通入NaClO溶液中,反应的离子方程式为
气体通入NaClO溶液中,反应的离子方程式为(5)25℃时,取50 mL 0.1 mol⋅L

 溶液,将其稀释100倍。
溶液,将其稀释100倍。①稀释前
 的电离度(
的电离度(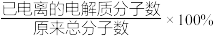 )约为
)约为②在稀释过程中,随着
 浓度的降低,
浓度的降低, 逐渐
逐渐
您最近一年使用:0次
2022-11-11更新
|
254次组卷
|
3卷引用:贵州省遵义市2022-2023学年高二上学期期中考试化学试题
8 . 硫化钠( )是一种重要的化工原料,生产方法有:硫化氢(
)是一种重要的化工原料,生产方法有:硫化氢( )吸收法,该方法是用NaOH溶液或
)吸收法,该方法是用NaOH溶液或 溶液吸收
溶液吸收 ,已知酸性:
,已知酸性: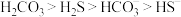 ;下列化学反应表示正确的是
;下列化学反应表示正确的是
 )是一种重要的化工原料,生产方法有:硫化氢(
)是一种重要的化工原料,生产方法有:硫化氢( )吸收法,该方法是用NaOH溶液或
)吸收法,该方法是用NaOH溶液或 溶液吸收
溶液吸收 ,已知酸性:
,已知酸性: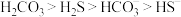 ;下列化学反应表示正确的是
;下列化学反应表示正确的是A. 溶液呈碱性: 溶液呈碱性: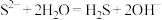 |
B. 与NaOH溶液反应: 与NaOH溶液反应: |
C. 与 与 溶液反应: 溶液反应: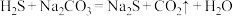 |
D.用足量炭还原硫酸钡制取硫化钡: |
您最近一年使用:0次
2022-11-11更新
|
198次组卷
|
3卷引用:江苏省连云港市2022-2023学年高三上学期期中调研考试化学试题
名校
9 . 氧化铋( )俗称铋黄,是制作防火纸的材料之一。以白色难溶物氯氧化铋(
)俗称铋黄,是制作防火纸的材料之一。以白色难溶物氯氧化铋( )为原料转型脱氯制备氧化铋的方法如下:
)为原料转型脱氯制备氧化铋的方法如下:
步骤1:准确称取3.0g ,先与25mL3
,先与25mL3 脱氯剂
脱氯剂 溶液混合,加入氨水至
溶液混合,加入氨水至 ,50℃下搅拌40min可得前驱体
,50℃下搅拌40min可得前驱体 (难溶于水),反应装置如图所示(加热装置已略去);
(难溶于水),反应装置如图所示(加热装置已略去);

步骤2:将前驱体干燥后灼烧,可得 。
。
回答下列问题:
(1) 的原子序数为83,则
的原子序数为83,则 在元素周期表中的位置是
在元素周期表中的位置是_______ 。
(2)试剂X的目的为防止挥发的氨气进入空气中,试剂X可选用_______ (填化学式)。
(3) 溶液过量的原因是
溶液过量的原因是_______ (用平衡移动原理解释),步骤1中生成 的化学方程式为
的化学方程式为_______ 。
(4)反应后,分离出三颈烧瓶的前驱体,用蒸馏水洗涤前驱体2~3次,将滤液和洗涤液合并,稀释至100 ,取25.00
,取25.00 于锥形瓶中,滴入2滴
于锥形瓶中,滴入2滴 溶液作指示剂,再用0.1
溶液作指示剂,再用0.1 标准
标准 溶液滴定,平行测定三组。
溶液滴定,平行测定三组。
①分离前驱体的操作名称是_______ ;盛装标准 溶液应选用
溶液应选用_______ (填“酸式”或“碱式”)滴定管。
②若消耗 标准液的平均体积为a
标准液的平均体积为a ,则脱氯率为
,则脱氯率为_______ %(用含a的代数式表示)。
(5)灼烧 时用到的硅酸盐制品有
时用到的硅酸盐制品有_______ 、酒精灯、玻璃棒、泥三角。
 )俗称铋黄,是制作防火纸的材料之一。以白色难溶物氯氧化铋(
)俗称铋黄,是制作防火纸的材料之一。以白色难溶物氯氧化铋( )为原料转型脱氯制备氧化铋的方法如下:
)为原料转型脱氯制备氧化铋的方法如下:步骤1:准确称取3.0g
 ,先与25mL3
,先与25mL3 脱氯剂
脱氯剂 溶液混合,加入氨水至
溶液混合,加入氨水至 ,50℃下搅拌40min可得前驱体
,50℃下搅拌40min可得前驱体 (难溶于水),反应装置如图所示(加热装置已略去);
(难溶于水),反应装置如图所示(加热装置已略去);
步骤2:将前驱体干燥后灼烧,可得
 。
。回答下列问题:
(1)
 的原子序数为83,则
的原子序数为83,则 在元素周期表中的位置是
在元素周期表中的位置是(2)试剂X的目的为防止挥发的氨气进入空气中,试剂X可选用
(3)
 溶液过量的原因是
溶液过量的原因是 的化学方程式为
的化学方程式为(4)反应后,分离出三颈烧瓶的前驱体,用蒸馏水洗涤前驱体2~3次,将滤液和洗涤液合并,稀释至100
 ,取25.00
,取25.00 于锥形瓶中,滴入2滴
于锥形瓶中,滴入2滴 溶液作指示剂,再用0.1
溶液作指示剂,再用0.1 标准
标准 溶液滴定,平行测定三组。
溶液滴定,平行测定三组。①分离前驱体的操作名称是
 溶液应选用
溶液应选用②若消耗
 标准液的平均体积为a
标准液的平均体积为a ,则脱氯率为
,则脱氯率为(5)灼烧
 时用到的硅酸盐制品有
时用到的硅酸盐制品有
您最近一年使用:0次
2022-09-01更新
|
188次组卷
|
2卷引用:河北省省级联测2022-2023学年高三上学期第一次月考化学试题
解题方法
10 . 含砷废水常见于采矿、半导体等工业,部分砷的化合物有毒,因此需除去废水中的砷。
Ⅰ.天然水体中砷元素主要以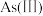 和
和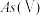 存在。在
存在。在 水溶液中,各种微粒的物质的量分数与溶液
水溶液中,各种微粒的物质的量分数与溶液 的关系如图1所示。
的关系如图1所示。
(1)当天然水体的 为4时,水体中所含
为4时,水体中所含 的主要微粒是
的主要微粒是_______ 。
(2)将 溶液滴入
溶液滴入 溶液中,当
溶液中,当 达到8时,所发生反应的离子方程式为
达到8时,所发生反应的离子方程式为_______ 。此时,溶液中含砷离子浓度由大到小的顺序为_______ 。
(3) 时,向
时,向 溶液中加入
溶液中加入 溶液至中性,此时溶液中
溶液至中性,此时溶液中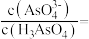
_______ 。
Ⅱ.利用高铁酸盐处理含砷废水。在一定 范围内,高铁酸盐被还原成胶体,而吸附含砷化合物。不同
范围内,高铁酸盐被还原成胶体,而吸附含砷化合物。不同 对
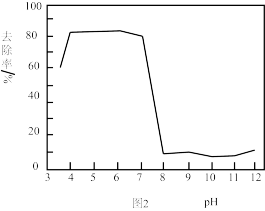
对 除砷影响如图2所示。
除砷影响如图2所示。
已知:溶液的 对胶体粒子表面所带电荷有影响。
对胶体粒子表面所带电荷有影响。 时,胶体粒子表面带正电荷,
时,胶体粒子表面带正电荷, 越低,表面所带正电荷越多。
越低,表面所带正电荷越多。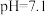 时,胶体粒子表面不带电荷;
时,胶体粒子表面不带电荷;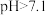 时,胶体粒子表面带负电荷,
时,胶体粒子表面带负电荷, 越高,表面所带负电荷越多。
越高,表面所带负电荷越多。
(4)结合图1和图2分析,除砷过程中控制废水 约为
约为_______ 适宜, 过低或过高,砷的去除率都会下降。
过低或过高,砷的去除率都会下降。 过低,主要以
过低,主要以 形式存在,不易形成
形式存在,不易形成 胶体。
胶体。 过高,一是
过高,一是 氧化性减弱,产生
氧化性减弱,产生 胶体的量少;二是
胶体的量少;二是_______ ;三是 过高,生成
过高,生成 沉淀而不是
沉淀而不是 胶体。
胶体。
(5)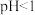 时,
时, 氧化
氧化 的离子方程式为
的离子方程式为_______ 。
Ⅰ.天然水体中砷元素主要以
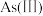 和
和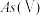 存在。在
存在。在 水溶液中,各种微粒的物质的量分数与溶液
水溶液中,各种微粒的物质的量分数与溶液 的关系如图1所示。
的关系如图1所示。
(1)当天然水体的
 为4时,水体中所含
为4时,水体中所含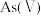 的主要微粒是
的主要微粒是(2)将
 溶液滴入
溶液滴入 溶液中,当
溶液中,当 达到8时,所发生反应的离子方程式为
达到8时,所发生反应的离子方程式为(3)
 时,向
时,向 溶液中加入
溶液中加入 溶液至中性,此时溶液中
溶液至中性,此时溶液中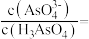
Ⅱ.利用高铁酸盐处理含砷废水。在一定
 范围内,高铁酸盐被还原成胶体,而吸附含砷化合物。不同
范围内,高铁酸盐被还原成胶体,而吸附含砷化合物。不同 对
对 除砷影响如图2所示。
除砷影响如图2所示。
已知:溶液的
 对胶体粒子表面所带电荷有影响。
对胶体粒子表面所带电荷有影响。 时,胶体粒子表面带正电荷,
时,胶体粒子表面带正电荷, 越低,表面所带正电荷越多。
越低,表面所带正电荷越多。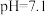 时,胶体粒子表面不带电荷;
时,胶体粒子表面不带电荷;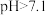 时,胶体粒子表面带负电荷,
时,胶体粒子表面带负电荷, 越高,表面所带负电荷越多。
越高,表面所带负电荷越多。(4)结合图1和图2分析,除砷过程中控制废水
 约为
约为 过低或过高,砷的去除率都会下降。
过低或过高,砷的去除率都会下降。 过低,主要以
过低,主要以 形式存在,不易形成
形式存在,不易形成 胶体。
胶体。 过高,一是
过高,一是 氧化性减弱,产生
氧化性减弱,产生 胶体的量少;二是
胶体的量少;二是 过高,生成
过高,生成 沉淀而不是
沉淀而不是 胶体。
胶体。(5)
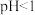 时,
时, 氧化
氧化 的离子方程式为
的离子方程式为
您最近一年使用:0次
2022-01-25更新
|
217次组卷
|
2卷引用:山东省威海市2021-2022学年高二上学期期末考试化学试题