1 . 工业上用磷铁渣(主要含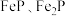 ,以及少量
,以及少量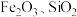 等杂质)制备
等杂质)制备 (磷酸铁)。
(磷酸铁)。

已知: 难溶于水,能溶于无机强酸。
难溶于水,能溶于无机强酸。
(1)“浸取”时为加速溶解,可以采取的措施有____________ (任写一种);加入硫酸的目的是____________ 。
(2)“浸取”时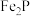 发生反应的离子方程式为
发生反应的离子方程式为____________ 。
(3)“制备”过程中溶液的 对磷酸铁产品中铁和磷的含量及
对磷酸铁产品中铁和磷的含量及 比值的影响如图所示[考虑到微量金属杂质,在
比值的影响如图所示[考虑到微量金属杂质,在 时,
时, 为0.973最接近理论值]。
为0.973最接近理论值]。

在 范围为1~1.5时,随
范围为1~1.5时,随 增大,
增大, 明显增大,其原因是
明显增大,其原因是____________ 。
(4)工业上也可以用电解磷铁渣的方法制备 。
。

①FeP在阳极放电的电极反应式为____________ 。
②常温电解一段时间,测得溶液中 浓度约为
浓度约为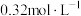 ,为了避免生成
,为了避免生成 沉淀,应控制溶液的
沉淀,应控制溶液的 不大于
不大于____________ (已知: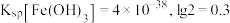 )。
)。
(5)工业上还可以用可溶性三价铁盐在酸性溶液中与磷酸盐反应,通过氨水调节 得到磷酸铁,将
得到磷酸铁,将 与
与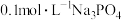 等体积混合充分反应后,静置,上层的清液中
等体积混合充分反应后,静置,上层的清液中 为
为____________  。【已知:
。【已知: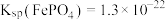 】
】
 ,以及少量
,以及少量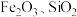 等杂质)制备
等杂质)制备 (磷酸铁)。
(磷酸铁)。
已知:
 难溶于水,能溶于无机强酸。
难溶于水,能溶于无机强酸。(1)“浸取”时为加速溶解,可以采取的措施有
(2)“浸取”时
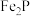 发生反应的离子方程式为
发生反应的离子方程式为(3)“制备”过程中溶液的
 对磷酸铁产品中铁和磷的含量及
对磷酸铁产品中铁和磷的含量及 比值的影响如图所示[考虑到微量金属杂质,在
比值的影响如图所示[考虑到微量金属杂质,在 时,
时, 为0.973最接近理论值]。
为0.973最接近理论值]。
在
 范围为1~1.5时,随
范围为1~1.5时,随 增大,
增大, 明显增大,其原因是
明显增大,其原因是(4)工业上也可以用电解磷铁渣的方法制备
 。
。
①FeP在阳极放电的电极反应式为
②常温电解一段时间,测得溶液中
 浓度约为
浓度约为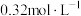 ,为了避免生成
,为了避免生成 沉淀,应控制溶液的
沉淀,应控制溶液的 不大于
不大于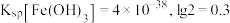 )。
)。(5)工业上还可以用可溶性三价铁盐在酸性溶液中与磷酸盐反应,通过氨水调节
 得到磷酸铁,将
得到磷酸铁,将 与
与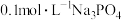 等体积混合充分反应后,静置,上层的清液中
等体积混合充分反应后,静置,上层的清液中 为
为 。【已知:
。【已知: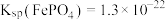 】
】
您最近一年使用:0次
解题方法
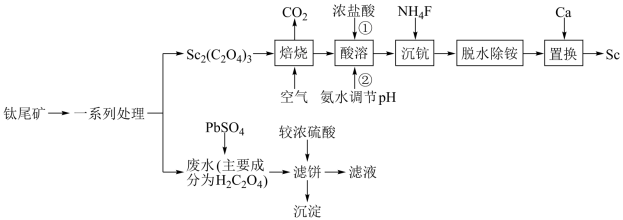
2 . 稀土在电子、激光、核工业、超导等诸多高科技领域有广泛的应用。钪(Sc)是一种稀土金属,利用钛尾矿回收金属钪和草酸的工艺流程如图所示,回答下列问题:
②“脱水除铵”是沉淀的热分解过程。
(1)钛(Ti)原子的外围电子排布式为___________ 。
(2)“焙烧”过程生成Sc2O,反应的化学方程式为___________ 。
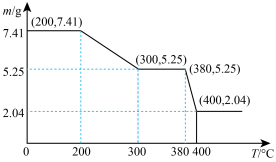
(3)“脱水除铵”过程中残留固体质量随温度的变化关系如图所示,在380~400℃过程中会有白烟冒出,保温至无烟气产生,即得到ScF3,则“沉钪”过程中ScF3与氯化物形成的沉淀的化学式为___________ 。(写出计算过程)___________ (用化学方程式表示);流程中“沉钪”后“脱水除铵”可制得纯度很高的ScF3,其原因是___________ 。
②“脱水除铵”是沉淀的热分解过程。
(1)钛(Ti)原子的外围电子排布式为
(2)“焙烧”过程生成Sc2O,反应的化学方程式为
(3)“脱水除铵”过程中残留固体质量随温度的变化关系如图所示,在380~400℃过程中会有白烟冒出,保温至无烟气产生,即得到ScF3,则“沉钪”过程中ScF3与氯化物形成的沉淀的化学式为
您最近一年使用:0次
解题方法
3 .  和
和 可以作为锂离子电池的正极材料。
可以作为锂离子电池的正极材料。
(1) 的制备。在氮气的氛围中,将一定量的
的制备。在氮气的氛围中,将一定量的 溶液与
溶液与 、LiOH溶液中的一种混合,然后加入到三颈烧瓶中(如图),在搅拌下通过滴液漏斗缓慢滴加剩余的另一种溶液,充分反应后,过滤、洗涤、干燥得到粗产品。
、LiOH溶液中的一种混合,然后加入到三颈烧瓶中(如图),在搅拌下通过滴液漏斗缓慢滴加剩余的另一种溶液,充分反应后,过滤、洗涤、干燥得到粗产品。
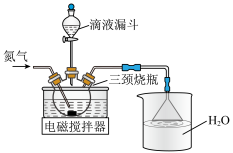
①滴液漏斗中的溶液是___________ 。
② 与
与 、LiOH反应得到
、LiOH反应得到 和
和 ,该反应的离子方程式为
,该反应的离子方程式为___________ 。已知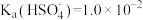 。
。
③在氮气氛围下,粗产品经150℃干燥、高温焙烧,即可得到锂离子电池的正极材料。焙烧时常向其中加入少量活性炭黑,其主要目的是___________ 。
(2) 的制备。取一定量比例的铁粉、磷酸、水放入容器中,加热充分反应,向反应后的溶液中加入一定量
的制备。取一定量比例的铁粉、磷酸、水放入容器中,加热充分反应,向反应后的溶液中加入一定量 ,同时加入适量水调节pH,静置后过滤、洗涤、干燥得到
,同时加入适量水调节pH,静置后过滤、洗涤、干燥得到 ,高温煅烧
,高温煅烧 ,即可得到
,即可得到 。
。
①其他条件不变时,磷酸与水的混合比例对铁粉溶解速率的影响如图所示:
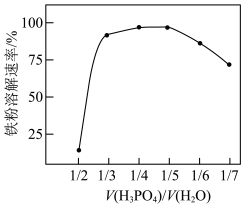
当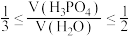 时,随着水的比例增加,铁粉溶解速率迅速升高的原因是
时,随着水的比例增加,铁粉溶解速率迅速升高的原因是___________ 。
②为使反应过程中的 完全被
完全被 氧化,下列操作控制能达到目的的是
氧化,下列操作控制能达到目的的是___________ (填序号)。
a.用 调节溶液
调节溶液 b.加热,使反应在较高温度下进行
b.加热,使反应在较高温度下进行
c.缓慢滴加 溶液并搅拌 d.加入适当过量的
溶液并搅拌 d.加入适当过量的 溶液
溶液
③将 与
与 溶液混合可以得到
溶液混合可以得到 。设计以
。设计以 与
与 溶液为原料,补充完整制备
溶液为原料,补充完整制备 的实验方案:
的实验方案:___________ ,干燥得到 。[实验中必须使用的试剂:盐酸、
。[实验中必须使用的试剂:盐酸、 溶液,
溶液, 开始沉淀的
开始沉淀的 ]
]
 和
和 可以作为锂离子电池的正极材料。
可以作为锂离子电池的正极材料。(1)
 的制备。在氮气的氛围中,将一定量的
的制备。在氮气的氛围中,将一定量的 溶液与
溶液与 、LiOH溶液中的一种混合,然后加入到三颈烧瓶中(如图),在搅拌下通过滴液漏斗缓慢滴加剩余的另一种溶液,充分反应后,过滤、洗涤、干燥得到粗产品。
、LiOH溶液中的一种混合,然后加入到三颈烧瓶中(如图),在搅拌下通过滴液漏斗缓慢滴加剩余的另一种溶液,充分反应后,过滤、洗涤、干燥得到粗产品。
①滴液漏斗中的溶液是
②
 与
与 、LiOH反应得到
、LiOH反应得到 和
和 ,该反应的离子方程式为
,该反应的离子方程式为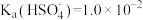 。
。③在氮气氛围下,粗产品经150℃干燥、高温焙烧,即可得到锂离子电池的正极材料。焙烧时常向其中加入少量活性炭黑,其主要目的是
(2)
 的制备。取一定量比例的铁粉、磷酸、水放入容器中,加热充分反应,向反应后的溶液中加入一定量
的制备。取一定量比例的铁粉、磷酸、水放入容器中,加热充分反应,向反应后的溶液中加入一定量 ,同时加入适量水调节pH,静置后过滤、洗涤、干燥得到
,同时加入适量水调节pH,静置后过滤、洗涤、干燥得到 ,高温煅烧
,高温煅烧 ,即可得到
,即可得到 。
。①其他条件不变时,磷酸与水的混合比例对铁粉溶解速率的影响如图所示:

当
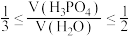 时,随着水的比例增加,铁粉溶解速率迅速升高的原因是
时,随着水的比例增加,铁粉溶解速率迅速升高的原因是②为使反应过程中的
 完全被
完全被 氧化,下列操作控制能达到目的的是
氧化,下列操作控制能达到目的的是a.用
 调节溶液
调节溶液 b.加热,使反应在较高温度下进行
b.加热,使反应在较高温度下进行c.缓慢滴加
 溶液并搅拌 d.加入适当过量的
溶液并搅拌 d.加入适当过量的 溶液
溶液③将
 与
与 溶液混合可以得到
溶液混合可以得到 。设计以
。设计以 与
与 溶液为原料,补充完整制备
溶液为原料,补充完整制备 的实验方案:
的实验方案: 。[实验中必须使用的试剂:盐酸、
。[实验中必须使用的试剂:盐酸、 溶液,
溶液, 开始沉淀的
开始沉淀的 ]
]
您最近一年使用:0次
4 . 镍的单质及氧化物常用作催化剂。以含镍废渣(主要含Ni,还含少量NiO、 和
和 )为原料可通过如下过程制取高纯度NiO。
)为原料可通过如下过程制取高纯度NiO。

已知①常温时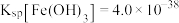 ,
,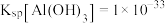 ,
,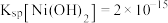 ,溶液中离子的浓度小于
,溶液中离子的浓度小于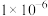 可认为已除尽。
可认为已除尽。
②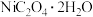 难溶于水。
难溶于水。
(1)“浸取”时,当加料完成后,提高镍元素浸出速率的方法有___________ 、___________ 。
(2)“浸取”后,测得溶液中 、
、 和
和 的物质的量浓度分别为
的物质的量浓度分别为 、
、 和
和 ,则“除铝铁”时应控制溶液的
,则“除铝铁”时应控制溶液的 范围为
范围为___________ (设加入氨水时溶液体积不发生变化) 。
(3)“沉镍”后所得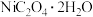 中可能吸附含有少量
中可能吸附含有少量 ,若“沉镍”时使用
,若“沉镍”时使用 溶液,则所得
溶液,则所得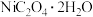 中可能吸附含有少量
中可能吸附含有少量 ,实际生产流程中用
,实际生产流程中用 而不用
而不用 的原因是
的原因是___________ 。
(4)雷尼镍是一种多孔的单质镍,可用作催化剂,工业上可由镍铝合金制得。选择合适的试剂,补充完整制取雷尼镍的方法:取粉碎后的镍铝合金,___________ ,真空干燥得到雷尼镍。(实验中可选用的试剂:10%的稀硫酸、20%的 溶液)
溶液)
(5)为测定某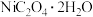 产品的纯度,现进行如下实验:准确取
产品的纯度,现进行如下实验:准确取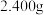 样品,用足量硫酸溶解后,加水稀释到
样品,用足量硫酸溶解后,加水稀释到 ,取
,取 所配溶液于锥形瓶中,加入
所配溶液于锥形瓶中,加入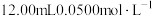 标准
标准 溶液,振荡使其充分反应;向反应后的溶液滴加
溶液,振荡使其充分反应;向反应后的溶液滴加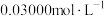 的
的 标准溶液与过量的
标准溶液与过量的 反应,恰好完全反应时消耗
反应,恰好完全反应时消耗 标准溶液体积为
标准溶液体积为 ,计算
,计算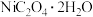 产品的纯度
产品的纯度___________ (写出计算过程,杂质不参与反应),实验过程中反应如下: (未配平);
(未配平);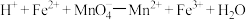 (未配平)。
(未配平)。
 和
和 )为原料可通过如下过程制取高纯度NiO。
)为原料可通过如下过程制取高纯度NiO。
已知①常温时
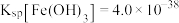 ,
,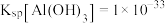 ,
,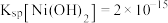 ,溶液中离子的浓度小于
,溶液中离子的浓度小于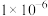 可认为已除尽。
可认为已除尽。②
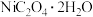 难溶于水。
难溶于水。(1)“浸取”时,当加料完成后,提高镍元素浸出速率的方法有
(2)“浸取”后,测得溶液中
 、
、 和
和 的物质的量浓度分别为
的物质的量浓度分别为 、
、 和
和 ,则“除铝铁”时应控制溶液的
,则“除铝铁”时应控制溶液的 范围为
范围为(3)“沉镍”后所得
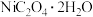 中可能吸附含有少量
中可能吸附含有少量 ,若“沉镍”时使用
,若“沉镍”时使用 溶液,则所得
溶液,则所得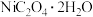 中可能吸附含有少量
中可能吸附含有少量 ,实际生产流程中用
,实际生产流程中用 而不用
而不用 的原因是
的原因是(4)雷尼镍是一种多孔的单质镍,可用作催化剂,工业上可由镍铝合金制得。选择合适的试剂,补充完整制取雷尼镍的方法:取粉碎后的镍铝合金,
 溶液)
溶液)(5)为测定某
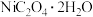 产品的纯度,现进行如下实验:准确取
产品的纯度,现进行如下实验:准确取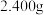 样品,用足量硫酸溶解后,加水稀释到
样品,用足量硫酸溶解后,加水稀释到 ,取
,取 所配溶液于锥形瓶中,加入
所配溶液于锥形瓶中,加入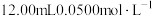 标准
标准 溶液,振荡使其充分反应;向反应后的溶液滴加
溶液,振荡使其充分反应;向反应后的溶液滴加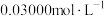 的
的 标准溶液与过量的
标准溶液与过量的 反应,恰好完全反应时消耗
反应,恰好完全反应时消耗 标准溶液体积为
标准溶液体积为 ,计算
,计算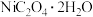 产品的纯度
产品的纯度 (未配平);
(未配平);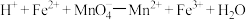 (未配平)。
(未配平)。
您最近一年使用:0次
名校
解题方法
5 . 消除氮氧化物尾气和水中硝酸盐造成的氮污染已成为环境修复研究的热点。
(1)氧化吸收法
酸性条件下,NaClO 溶液可以氧化 N2O、NO 和 NO2等生成 Cl— 和 NO ,其他条件一定,N2O 转化为 NO
,其他条件一定,N2O 转化为 NO 的转化率随NaClO 溶液初始 pH 的变化如图所示:
的转化率随NaClO 溶液初始 pH 的变化如图所示:

①酸性 NaClO 溶液吸收N2O 的离子方程式为___________ 。
②NaClO 溶液的初始 pH 越小,N2O 转化率越高,其原因是___________ 。
③NaClO2/H2O2酸性复合吸收剂可有效脱除 NO。复合吸收剂组成一定时,温度对 NO 去除率的影响如图,温度高于 60℃后,NO 去除率下降的原因是___________ 。

(2)电化学法
在通电的条件下,利用零价铁(Fe)去除弱酸性水体中 NO ,其原理如图所示:
,其原理如图所示:

①去除NO 的总反应离子方程式为
的总反应离子方程式为___________ 。
②溶液的初始 pH 值对铁的氧化产物和 NO 的去除率都有影响。取两份相同的含NO
的去除率都有影响。取两份相同的含NO 废液, 调节起始 pH 分别为 2.5 和 4.5,一段时间后,测得实验结果如表所示,当初始pH=4.5, NO
废液, 调节起始 pH 分别为 2.5 和 4.5,一段时间后,测得实验结果如表所示,当初始pH=4.5, NO 去除率低的原因是
去除率低的原因是___________ 。
(3)催化还原法
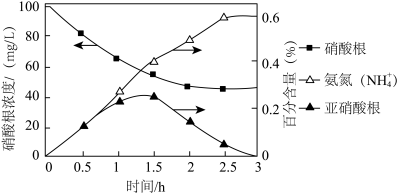
多相催化剂条件下,使用 H2作为还原剂,可将水中的 NO 转化为 N2,因为不会带来二次污染的优点,受到了广泛关注。W-Cu/Al2O3催化剂还原硝酸盐过程中三种含氮微粒的变化如图所示,在 1.5~2.5h 过程中,亚硝酸盐氮(NO
转化为 N2,因为不会带来二次污染的优点,受到了广泛关注。W-Cu/Al2O3催化剂还原硝酸盐过程中三种含氮微粒的变化如图所示,在 1.5~2.5h 过程中,亚硝酸盐氮(NO ) 浓度下降的原因是
) 浓度下降的原因是__________ 。
(1)氧化吸收法
酸性条件下,NaClO 溶液可以氧化 N2O、NO 和 NO2等生成 Cl— 和 NO
 ,其他条件一定,N2O 转化为 NO
,其他条件一定,N2O 转化为 NO 的转化率随NaClO 溶液初始 pH 的变化如图所示:
的转化率随NaClO 溶液初始 pH 的变化如图所示:
①酸性 NaClO 溶液吸收N2O 的离子方程式为
②NaClO 溶液的初始 pH 越小,N2O 转化率越高,其原因是
③NaClO2/H2O2酸性复合吸收剂可有效脱除 NO。复合吸收剂组成一定时,温度对 NO 去除率的影响如图,温度高于 60℃后,NO 去除率下降的原因是

(2)电化学法
在通电的条件下,利用零价铁(Fe)去除弱酸性水体中 NO
 ,其原理如图所示:
,其原理如图所示:
①去除NO
 的总反应离子方程式为
的总反应离子方程式为②溶液的初始 pH 值对铁的氧化产物和 NO
 的去除率都有影响。取两份相同的含NO
的去除率都有影响。取两份相同的含NO 废液, 调节起始 pH 分别为 2.5 和 4.5,一段时间后,测得实验结果如表所示,当初始pH=4.5, NO
废液, 调节起始 pH 分别为 2.5 和 4.5,一段时间后,测得实验结果如表所示,当初始pH=4.5, NO 去除率低的原因是
去除率低的原因是| 初始pH | pH=2.5 | pH=4.5 |
24小时后NO 的去除率 的去除率 | 接近100% | <50% |
| 铁的最终物质形态 |  | 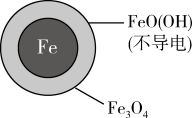 |
多相催化剂条件下,使用 H2作为还原剂,可将水中的 NO
 转化为 N2,因为不会带来二次污染的优点,受到了广泛关注。W-Cu/Al2O3催化剂还原硝酸盐过程中三种含氮微粒的变化如图所示,在 1.5~2.5h 过程中,亚硝酸盐氮(NO
转化为 N2,因为不会带来二次污染的优点,受到了广泛关注。W-Cu/Al2O3催化剂还原硝酸盐过程中三种含氮微粒的变化如图所示,在 1.5~2.5h 过程中,亚硝酸盐氮(NO ) 浓度下降的原因是
) 浓度下降的原因是
您最近一年使用:0次
名校
解题方法
6 . 葡萄糖酸锌是一种抗缺锌药物,可由 为原料制得。工业上以废锌铁合金(主要成分为Zn,含有少量的Fe、Fe2O3、ZnO、CuO和油污等杂质)为原料制备
为原料制得。工业上以废锌铁合金(主要成分为Zn,含有少量的Fe、Fe2O3、ZnO、CuO和油污等杂质)为原料制备 的流程如图。
的流程如图。

(1)碱洗的目的是___________ 。
(2)氧化时发生反应的离子方程式为___________ 。
(3)取“氧化”过程中的上层清液,滴加酸性 稀溶液,紫红色褪去,可能的原因是
稀溶液,紫红色褪去,可能的原因是_____ 。
(4)由过滤所得的滤液为原料制备 ,请补充完整相应的实验方案:向滤液中
,请补充完整相应的实验方案:向滤液中___________ ,过滤、晾干,得到 。
。
实验中须用到的试剂:锌粉、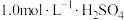 。
。
(5)以 为原料可制得葡萄糖酸锌
为原料可制得葡萄糖酸锌 。为测定葡萄糖酸锌样品的纯度,进行下列实验。
。为测定葡萄糖酸锌样品的纯度,进行下列实验。
步骤1:称取5.200g样品溶于水配成100mL溶液,取25.00mL置于锥形瓶中,滴入少量的铬黑T作指示剂。
步骤2:向锥形瓶中加入过量的 ,振荡。
,振荡。
步骤3:用 锌标准溶液滴定过量的EDTA至终点,消耗锌标准溶液16.00mL(已知:
锌标准溶液滴定过量的EDTA至终点,消耗锌标准溶液16.00mL(已知: 与EDTA反应的化学计量比为1∶1)。
与EDTA反应的化学计量比为1∶1)。
①计算此产品中锌元素的质量分数:___________ 。(写出计算过程)
②葡萄糖酸锌中锌元素的含量为14.28%,对照①计算结果,产生误差的可能原因是(样品纯或不纯)___________ 。
 为原料制得。工业上以废锌铁合金(主要成分为Zn,含有少量的Fe、Fe2O3、ZnO、CuO和油污等杂质)为原料制备
为原料制得。工业上以废锌铁合金(主要成分为Zn,含有少量的Fe、Fe2O3、ZnO、CuO和油污等杂质)为原料制备 的流程如图。
的流程如图。
(1)碱洗的目的是
(2)氧化时发生反应的离子方程式为
(3)取“氧化”过程中的上层清液,滴加酸性
 稀溶液,紫红色褪去,可能的原因是
稀溶液,紫红色褪去,可能的原因是(4)由过滤所得的滤液为原料制备
 ,请补充完整相应的实验方案:向滤液中
,请补充完整相应的实验方案:向滤液中 。
。实验中须用到的试剂:锌粉、
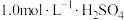 。
。(5)以
 为原料可制得葡萄糖酸锌
为原料可制得葡萄糖酸锌 。为测定葡萄糖酸锌样品的纯度,进行下列实验。
。为测定葡萄糖酸锌样品的纯度,进行下列实验。步骤1:称取5.200g样品溶于水配成100mL溶液,取25.00mL置于锥形瓶中,滴入少量的铬黑T作指示剂。
步骤2:向锥形瓶中加入过量的
 ,振荡。
,振荡。步骤3:用
 锌标准溶液滴定过量的EDTA至终点,消耗锌标准溶液16.00mL(已知:
锌标准溶液滴定过量的EDTA至终点,消耗锌标准溶液16.00mL(已知: 与EDTA反应的化学计量比为1∶1)。
与EDTA反应的化学计量比为1∶1)。①计算此产品中锌元素的质量分数:
②葡萄糖酸锌中锌元素的含量为14.28%,对照①计算结果,产生误差的可能原因是(样品纯或不纯)
您最近一年使用:0次
名校
解题方法
7 .  在电池中有重要应用。以软锰矿(含
在电池中有重要应用。以软锰矿(含 及少量
及少量 、
、 的氧化物)为原料制备粗二氧化锰颗粒的过程如下:
的氧化物)为原料制备粗二氧化锰颗粒的过程如下:
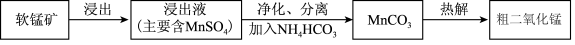
(1)浸出。用 和
和 可溶解软锰矿,生成
可溶解软锰矿,生成 的离子方程式为
的离子方程式为_______ 。
(2)净化、分离。
①浸出液中的 、
、 可加入
可加入 溶液并调节溶液pH在5~6之间,转化为沉淀去除,溶液的pH不能超过6的原因是
溶液并调节溶液pH在5~6之间,转化为沉淀去除,溶液的pH不能超过6的原因是_______ 。
②为减少碱用量,可以通过稀释浸出液除去 ,结合离子方程式解释原理:
,结合离子方程式解释原理:_______ 。
(3)热解。在一定空气流速下,相同时间内 热解产物中不同价态
热解产物中不同价态 的占比随热解温度的变化如图:
的占比随热解温度的变化如图:
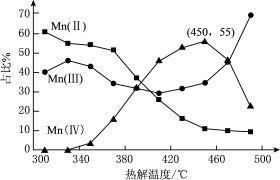
注:图中 (Ⅱ)等表示化合物中锰元素的价态
(Ⅱ)等表示化合物中锰元素的价态
 热解过程中涉及如下化学反应:
热解过程中涉及如下化学反应:
ⅰ.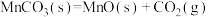
ⅱ.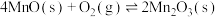

ⅲ.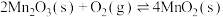

①为了增大产物中 的占比,除控制温度在450℃左右外,还可采用的措施有
的占比,除控制温度在450℃左右外,还可采用的措施有_______ 。
②温度升高,产物中 的占比降低,可能的原因是
的占比降低,可能的原因是_______ 。
(4)测定 的纯度。称取0.1450g
的纯度。称取0.1450g 粗品置于具塞锥形瓶中,加水润湿后,依次加入足量稀硫酸和过量
粗品置于具塞锥形瓶中,加水润湿后,依次加入足量稀硫酸和过量 溶液,盖上玻璃塞,充分摇匀后静置30min。用0.1500
溶液,盖上玻璃塞,充分摇匀后静置30min。用0.1500
 标准溶液滴定生成的
标准溶液滴定生成的 ,消耗
,消耗 标准溶液20.00
标准溶液20.00 ,滴定反应为
,滴定反应为 ,计算粗品中
,计算粗品中 的质量分数
的质量分数_______ 。(写出计算过程)。
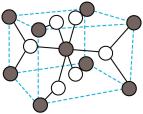
(5)分析 的结构,下图是
的结构,下图是 的一种晶型的晶胞,该晶胞中
的一种晶型的晶胞,该晶胞中 所围成的空间构型是
所围成的空间构型是_______ 。
 在电池中有重要应用。以软锰矿(含
在电池中有重要应用。以软锰矿(含 及少量
及少量 、
、 的氧化物)为原料制备粗二氧化锰颗粒的过程如下:
的氧化物)为原料制备粗二氧化锰颗粒的过程如下: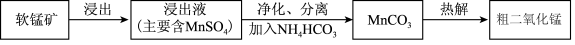
(1)浸出。用
 和
和 可溶解软锰矿,生成
可溶解软锰矿,生成 的离子方程式为
的离子方程式为(2)净化、分离。
①浸出液中的
 、
、 可加入
可加入 溶液并调节溶液pH在5~6之间,转化为沉淀去除,溶液的pH不能超过6的原因是
溶液并调节溶液pH在5~6之间,转化为沉淀去除,溶液的pH不能超过6的原因是②为减少碱用量,可以通过稀释浸出液除去
 ,结合离子方程式解释原理:
,结合离子方程式解释原理:(3)热解。在一定空气流速下,相同时间内
 热解产物中不同价态
热解产物中不同价态 的占比随热解温度的变化如图:
的占比随热解温度的变化如图:
注:图中
 (Ⅱ)等表示化合物中锰元素的价态
(Ⅱ)等表示化合物中锰元素的价态 热解过程中涉及如下化学反应:
热解过程中涉及如下化学反应:ⅰ.
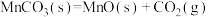
ⅱ.
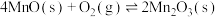

ⅲ.
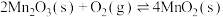

①为了增大产物中
 的占比,除控制温度在450℃左右外,还可采用的措施有
的占比,除控制温度在450℃左右外,还可采用的措施有②温度升高,产物中
 的占比降低,可能的原因是
的占比降低,可能的原因是(4)测定
 的纯度。称取0.1450g
的纯度。称取0.1450g 粗品置于具塞锥形瓶中,加水润湿后,依次加入足量稀硫酸和过量
粗品置于具塞锥形瓶中,加水润湿后,依次加入足量稀硫酸和过量 溶液,盖上玻璃塞,充分摇匀后静置30min。用0.1500
溶液,盖上玻璃塞,充分摇匀后静置30min。用0.1500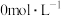
 标准溶液滴定生成的
标准溶液滴定生成的 ,消耗
,消耗 标准溶液20.00
标准溶液20.00 ,滴定反应为
,滴定反应为 ,计算粗品中
,计算粗品中 的质量分数
的质量分数(5)分析
 的结构,下图是
的结构,下图是 的一种晶型的晶胞,该晶胞中
的一种晶型的晶胞,该晶胞中 所围成的空间构型是
所围成的空间构型是
您最近一年使用:0次
2023-09-02更新
|
264次组卷
|
2卷引用:江苏省镇江市丹阳市2023-2024学年高三上学期开学考试化学试题
名校
解题方法
8 . 实验室以碳酸锰矿(含MnCO3及少量Fe、Al、Si等氧化物)为原料制高纯MnCO3和MnO2的流程如下:

(1)焙烧时的温度为300~500℃,写出焙烧时MnCO3所发生反应的化学方程式:______ 。
(2)焙烧前需测定碳酸锰矿中MnCO3的含量,测定过程如下:称取0.2000g碳酸锰矿粉于锥形瓶中,加入15mL磷酸,加热并不断摇动至矿粉溶解,加入NH4NO3将溶液中的Mn2+转化为Mn(PO4) ,待冷却至室温后,加入40mL蒸馏水,滴加2滴N苯代邻胺基苯甲酸作指示剂,用0.02000mol·L-1(NH4)2Fe(SO4)2标准溶液滴定至终点[滴定过程中Mn(PO4)
,待冷却至室温后,加入40mL蒸馏水,滴加2滴N苯代邻胺基苯甲酸作指示剂,用0.02000mol·L-1(NH4)2Fe(SO4)2标准溶液滴定至终点[滴定过程中Mn(PO4) 与Fe2+反应生成Mn2+和Fe3+],消耗(NH4)2Fe(SO4)2标准溶液30.00mL。计算碳酸锰矿中MnCO3的含量
与Fe2+反应生成Mn2+和Fe3+],消耗(NH4)2Fe(SO4)2标准溶液30.00mL。计算碳酸锰矿中MnCO3的含量___________ (写出计算过程)。
(3)将过滤后所得溶液净化后可得MnSO4溶液。
①将净化后MnSO4溶液置于如图所示三颈烧瓶中,控制一定的温度,将沉淀剂滴加到烧瓶中,充分反应后过滤、洗涤、干燥可得MnCO3白色粉末。沉淀剂可以使用Na2CO3溶液、NH4HCO3溶液或NH4HCO3与氨水的混合溶液。实验小组经过比较后使用的是NH4HCO3与氨水的混合溶液。
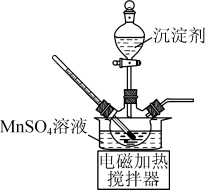
a.不使用Na2CO3溶液的原因是___________ 。
b.不使用NH4HCO3溶液的原因是___________ 。
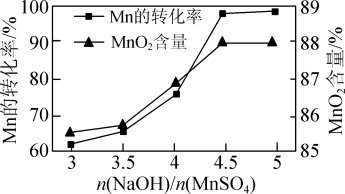
②已知MnSO4可发生如下反应:MnSO4+K2S2O8+4NaOH=MnO2↓+K2SO4+2Na2SO4+2H2O,MnSO4和K2S2O8的物质的量相同,改变NaOH的物质的量,测得Mn的转化率、MnO2的含量{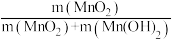 }与NaOH和MnSO4物质的量比值之间的关系如图所示。根据信息,补充完整制取纯净MnO2的实验方案:将20mL 1.0mol·L-1的MnSO4溶液和20mL 1.0mol·L-1的K2S2O8溶液混合,
}与NaOH和MnSO4物质的量比值之间的关系如图所示。根据信息,补充完整制取纯净MnO2的实验方案:将20mL 1.0mol·L-1的MnSO4溶液和20mL 1.0mol·L-1的K2S2O8溶液混合,___________ ,得到纯净的MnO2(实验中可使用的试剂是1.0mol·L-1 NaOH溶液、1.0mol·L-1 H2SO4溶液、1.0mol·L-1 BaCl2溶液)。

(1)焙烧时的温度为300~500℃,写出焙烧时MnCO3所发生反应的化学方程式:
(2)焙烧前需测定碳酸锰矿中MnCO3的含量,测定过程如下:称取0.2000g碳酸锰矿粉于锥形瓶中,加入15mL磷酸,加热并不断摇动至矿粉溶解,加入NH4NO3将溶液中的Mn2+转化为Mn(PO4)
 ,待冷却至室温后,加入40mL蒸馏水,滴加2滴N苯代邻胺基苯甲酸作指示剂,用0.02000mol·L-1(NH4)2Fe(SO4)2标准溶液滴定至终点[滴定过程中Mn(PO4)
,待冷却至室温后,加入40mL蒸馏水,滴加2滴N苯代邻胺基苯甲酸作指示剂,用0.02000mol·L-1(NH4)2Fe(SO4)2标准溶液滴定至终点[滴定过程中Mn(PO4) 与Fe2+反应生成Mn2+和Fe3+],消耗(NH4)2Fe(SO4)2标准溶液30.00mL。计算碳酸锰矿中MnCO3的含量
与Fe2+反应生成Mn2+和Fe3+],消耗(NH4)2Fe(SO4)2标准溶液30.00mL。计算碳酸锰矿中MnCO3的含量(3)将过滤后所得溶液净化后可得MnSO4溶液。
①将净化后MnSO4溶液置于如图所示三颈烧瓶中,控制一定的温度,将沉淀剂滴加到烧瓶中,充分反应后过滤、洗涤、干燥可得MnCO3白色粉末。沉淀剂可以使用Na2CO3溶液、NH4HCO3溶液或NH4HCO3与氨水的混合溶液。实验小组经过比较后使用的是NH4HCO3与氨水的混合溶液。

a.不使用Na2CO3溶液的原因是
b.不使用NH4HCO3溶液的原因是
②已知MnSO4可发生如下反应:MnSO4+K2S2O8+4NaOH=MnO2↓+K2SO4+2Na2SO4+2H2O,MnSO4和K2S2O8的物质的量相同,改变NaOH的物质的量,测得Mn的转化率、MnO2的含量{
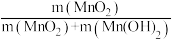 }与NaOH和MnSO4物质的量比值之间的关系如图所示。根据信息,补充完整制取纯净MnO2的实验方案:将20mL 1.0mol·L-1的MnSO4溶液和20mL 1.0mol·L-1的K2S2O8溶液混合,
}与NaOH和MnSO4物质的量比值之间的关系如图所示。根据信息,补充完整制取纯净MnO2的实验方案:将20mL 1.0mol·L-1的MnSO4溶液和20mL 1.0mol·L-1的K2S2O8溶液混合,
您最近一年使用:0次
2022-03-29更新
|
819次组卷
|
4卷引用:江苏省2022届高三下学期3月第一次调研测试化学试题
江苏省2022届高三下学期3月第一次调研测试化学试题江苏省苏州市重点中学2022-2023学年高三上学期10月月考化学试题江苏省南京市中华中学2022-2023学年高三上学期期末考试化学试题(已下线)化学-2022年高考押题预测卷03(福建卷)
名校
9 . 通过下列实验可以从废铜屑中制取CuSO4·5H2O。

下列说法正确的是

下列说法正确的是

| A.加入Na2CO3溶液的作用是除去废铜屑表面的油污 |
| B.“氧化”时反应的离子方程式:Cu+H2O2+2H+=Cu2++H2O |
| C.操作1是蒸发浓缩、冷却结晶 |
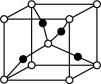
| D.将CuSO4·5H2O加热到1000℃以上会分解得到Cu2O,1个Cu2O晶胞(如图)中含1个氧原子 |
您最近一年使用:0次
2022-01-20更新
|
509次组卷
|
5卷引用:江苏省无锡市普通高中2021-2022学年上学期高三期末调研考试化学试题
江苏省无锡市普通高中2021-2022学年上学期高三期末调研考试化学试题(已下线)黄金卷1-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(江苏卷)江苏省泰州中学2021-2022学年高二下学期第一次质量检测化学试题(已下线)押江苏卷第9题 化学工艺流程选择题 -备战2022年高考化学临考题号押题(江苏卷)湖南省郴州市第二中学2022届高三下学期期中考试化学试题
10 . 下列由废催化剂(主要含FeBr3及少量溴、苯)制取无水FeCl3的实验装置与原理能达到实验目的的是
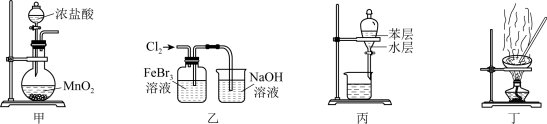
| A.用装置甲制取氯气 |
| B.用装置乙氧化FeBr3溶液中的溴离子 |
| C.用装置丙分离出FeCl3溶液 |
| D.用装置丁蒸干溶液可得无水FeCl3 |
您最近一年使用:0次
2022-01-20更新
|
1072次组卷
|
12卷引用:江苏省无锡市普通高中2021-2022学年上学期高三期末调研考试化学试题
江苏省无锡市普通高中2021-2022学年上学期高三期末调研考试化学试题(已下线)黄金卷1-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(江苏卷)(已下线)押江苏卷第3题 化学实验基础知识和技能 -备战2022年高考化学临考题号押题(江苏卷)江苏省常熟中学2023-2024学年高三上学期阶段性抽测一化学试题2024届江苏省常熟市中学高三上学期阶段性抽测一 化学试题江苏省扬州中学2023-2024学年高三下学期阶段练习化学试题江苏省南通市海安市实验中学2023-2024学年高二上学期11月期中化学试题江苏省扬州中学2024届高三下学期3月月考化学试卷江苏省南京市六校联合体2023-2024学年高二下学期四月联考化学试卷河南省五市2022届高三下学期第二次联合调研检测(二模)理综化学试题江西省赣州市赣县第三中学2022-2023学年高三上学期(奥赛班)强化训练化学试题湖南省郴州市第二中学2022届高三下学期期中考试化学试题



