解题方法
1 . 勤劳致富,越努力越幸福。下列劳动项目与所述的化学知识没有关联的是
选项 | 劳动项目 | 化学知识 |
A | 游泳池中加硫酸铜进行消毒 | 硫酸铜的氧化性 |
B | 高铁酸钾常用于处理水 | 高铁酸钾的氧化性和氢氧化铁胶体的吸附性 |
C | 用热的纯碱溶液洗去油污 | 热的纯碱溶液水解显碱性 |
D | 用厨余垃圾制肥料 | 厨余垃圾含N、P等元素 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
2 . 下列说法正确的是
| A.电热水器用镁棒防止内胆腐蚀,原理是牺牲阳极的阴极保护法 |
| B.SO2能使品红溶液、溴水褪色,分别说明SO2具有强氧化性、还原性 |
| C.将AlCl3溶液和Al2(SO4)3溶液分别蒸干和灼烧,最终所得产物的成分均为Al2O3 |
| D.金属钠具有强还原性,可用与TiCl4溶液反应制取金属Ti |
您最近一年使用:0次
2019-12-23更新
|
119次组卷
|
2卷引用:新疆乌鲁木齐市第八中学2020-2021学年高二上学期期末考试化学试题
解题方法
3 . 平板液晶显示屏生产过程中产生大量的废玻璃粉末,其中含CeO2、SiO2、Fe2O3等物质,某实验小组以此粉末为原料回收铈,设计流程如图所示。
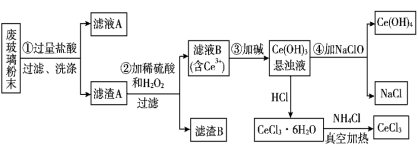
已知:CeO2具有强氧化性,一般不与常见的无机酸反应。
(1)滤渣B的主要成分化学式___________ ,说出该物质的主要应用___________ 。
(2)步骤②的离子方程式___________ ,为了加快步骤②的反应速率,有人提出在较高温度下进行,你认为___________ 恰当(填“是”或“否”),解释理由___________
(3)将NH4Cl固体与CeCl3·6H2O混合真空加热可得无水CeCl3,其加入NH4Cl的作用是___________ 。
(4)第④步反应的化学方程式是___________ 。

已知:CeO2具有强氧化性,一般不与常见的无机酸反应。
(1)滤渣B的主要成分化学式
(2)步骤②的离子方程式
(3)将NH4Cl固体与CeCl3·6H2O混合真空加热可得无水CeCl3,其加入NH4Cl的作用是
(4)第④步反应的化学方程式是
您最近一年使用:0次
名校
解题方法
4 . 酸性蚀刻液的主要成分是H2O2/HCl,腐蚀铜后的废液中主要含有CuCl2、HCl。一种以废铝屑为主要原料回收酸性蚀刻废液中的铜并生产AlCl3的工艺流程如下:
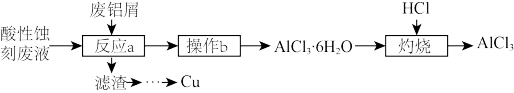
回答下列问题:
(1)在实验室,“反应a”过程需远离火源,其原因是_______ (用文字叙述)。
(2)“操作b”包括_______ 、过滤、洗涤,其中过滤需要用到的玻璃仪器有_______ 、烧杯。
(3)实验室可用食盐与浓硫酸在微热条件下反应制取HCl气体。
①HCl气体的发生装置应选择装置_______ (填字母,下同),用水吸收多余的HCl气体时,应该选择装置_______ ,其原因是_______ 。
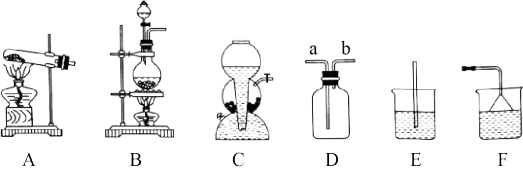
②写出制备HCl反应的化学方程式:_______ ,该反应利用了浓H2SO4的性质是_______ (填“脱水性”“氧化性”或“难挥发性”)
(4)“灼烧”时,若在无HCl的气氛中反应,最终是否生成 给出判断并说明理由:
给出判断并说明理由:_______ 。
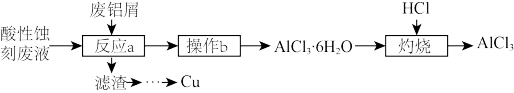
回答下列问题:
(1)在实验室,“反应a”过程需远离火源,其原因是
(2)“操作b”包括
(3)实验室可用食盐与浓硫酸在微热条件下反应制取HCl气体。
①HCl气体的发生装置应选择装置

②写出制备HCl反应的化学方程式:
(4)“灼烧”时,若在无HCl的气氛中反应,最终是否生成
 给出判断并说明理由:
给出判断并说明理由:
您最近一年使用:0次
2022-08-28更新
|
341次组卷
|
5卷引用:新疆乌鲁木齐市高级中学2022-2023学年高三第一次模拟考试化学试题
名校
5 . 化学与生活密切相关。下列说法不正确 的是
| A.高温可杀灭细菌,是由于高温可使蛋白质变性 |
| B.纯碱溶液可去油污,是由于NaHCO3水解使溶液显碱性 |
| C.石灰石可减少煤燃烧的SO2排放,是由于它可将SO2转化为CaSO4 |
| D.维生素C常与补铁剂(有效成分中铁元素为+2价)同服,是由于它具有还原性 |
您最近一年使用:0次
2021-01-23更新
|
379次组卷
|
3卷引用:新疆石河子第一中学2022-2023学年高三10月月考化学试题
解题方法
6 . 如表实验操作能达到实验目的的是
| 选项 | 实验操作 | 实验目的 |
| A | 向足量酸性KMnO4溶液中滴加少量FeCl2溶液,振荡 | 验证Fe2+具有还原性 |
| B | 用洁净的铂丝蘸取KCl溶液在酒精灯外焰上灼烧 | 观察钾元素的焰色 |
| C | 将FeCl3固体溶于浓盐酸后再稀释 | 配制FeCl3溶液 |
| D | 用玻璃棒蘸取饱和氯水点在pH试纸上,待变色后与标准比色卡对照 | 测定饱和氯水的pH |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
7 . 某研究小组为了探究NaClO溶液的性质,设计了下列实验,并记录实验现象。
则以下判断不正确的是
| 实验装置 | 实验序号 | 滴管试剂 | 试管试剂 | 实验现象 |
 | ① | 0.2 mol/L NaClO溶液 | 饱和Ag2SO4溶液 | 产生白色沉淀 |
| ② | CH3COOH溶液 | 光照管壁有无色气泡 | ||
| ③ | 0.2mol/LFeSO4酸性溶液和KSCN溶液 | 溶液变红 | ||
| ④ | 0.2mol/L的AlCl3溶液 | 产生白色沉淀 |
| A.实验①:发生的反应为Ag++ClO-+H2O=AgCl↓+2OH- | B.实验②:无色气体为O2 |
| C.实验③:还原性强弱顺序Fe2+>Cl- | D.实验④:ClO-与Al3+的水解相互促进 |
您最近一年使用:0次
2018-05-26更新
|
682次组卷
|
6卷引用:新疆维吾尔自治区巴州二中2021届高三第六次月考化学试题
8 . 黑色金属材料是工业上对铁、铬、锰的统称,Fe、Cr、Mn及其化合物在日常生活生产中的用途相当广泛。根据所学知识,回答下列问题:
(1)Fe2(SO4)3具有净水作用,Fe2(SO4)3净水的原理是______________________________ 。为节约成本,工业上用NaClO3氧化酸性FeSO4废液得到Fe2(SO4)3。若酸性FeSO4废液中c(Fe2+)=2.0 10-2 mol•L-1,c(Fe3+)=l.0×10-3 mol • L-1,c(SO
10-2 mol•L-1,c(Fe3+)=l.0×10-3 mol • L-1,c(SO )=2.65×10-2mol • L-1,则该溶液的pH约为
)=2.65×10-2mol • L-1,则该溶液的pH约为______________ 。
(2)向Fe2(SO4)3溶液中加入KOH溶液至过量,微热,再通入Cl2,可观察到溶液呈紫色(高铁酸钾:K2FeO4。写出此过程发生反应的离子方程式:______________ 。
(3)FeSO4可用于治疗缺铁性贫血症,为验证药品的还原性,某实验小组取少量药用FeSO4配制成溶液,并取2 mL FeSO4溶液于试管中,滴入几滴浓硝酸,振荡,试管中产生红棕 色气体,溶液变为深棕色。为探究溶液没有变为黄色的原因补充了如下实验:向FeSO4溶液和Fe2(SO4)3溶液中分别通入NO2,观察到FeSO4溶液变为深棕色,Fe2(SO4)3溶液无明显变化。
①“试管中产生红棕色气体,溶液变为深棕色”的原因是______________ 。
② 实验小组改进实验,观察到溶液变为黄色的实验操作是______________ 。
II.在K2Cr2O7溶液中存在下列平衡:
(4)下列有关K2Cr2O7溶液的说法正确的是 (填标号)。
III.MnCO3可用作电讯器材元件材料,还可用作瓷釉、颜料及制造锰盐的原料。它在空气中加热易转化为不同价态锰的氧化物,其固体残留率( )随温度的变化如图所示
)随温度的变化如图所示
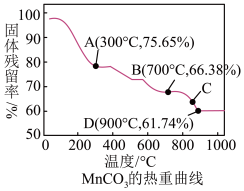
(5)300℃时,剩余固体中n(Mn): n(O)为______________ 。
(6)图中C点对应固体的成分为______________ (填化学式)。
(1)Fe2(SO4)3具有净水作用,Fe2(SO4)3净水的原理是
 10-2 mol•L-1,c(Fe3+)=l.0×10-3 mol • L-1,c(SO
10-2 mol•L-1,c(Fe3+)=l.0×10-3 mol • L-1,c(SO )=2.65×10-2mol • L-1,则该溶液的pH约为
)=2.65×10-2mol • L-1,则该溶液的pH约为(2)向Fe2(SO4)3溶液中加入KOH溶液至过量,微热,再通入Cl2,可观察到溶液呈紫色(高铁酸钾:K2FeO4。写出此过程发生反应的离子方程式:
(3)FeSO4可用于治疗缺铁性贫血症,为验证药品的还原性,某实验小组取少量药用FeSO4配制成溶液,并取2 mL FeSO4溶液于试管中,滴入几滴浓硝酸,振荡,试管中产生红棕 色气体,溶液变为深棕色。为探究溶液没有变为黄色的原因补充了如下实验:向FeSO4溶液和Fe2(SO4)3溶液中分别通入NO2,观察到FeSO4溶液变为深棕色,Fe2(SO4)3溶液无明显变化。
①“试管中产生红棕色气体,溶液变为深棕色”的原因是
② 实验小组改进实验,观察到溶液变为黄色的实验操作是
II.在K2Cr2O7溶液中存在下列平衡:

(4)下列有关K2Cr2O7溶液的说法正确的是 (填标号)。
| A.加入少量硫酸,溶液的橙色加深 |
| B.加入少量水稀释,溶液中离子总数增加 |
| C.加入少量NaOH溶液,平衡逆向移动 |
| D.加入少量K2Cr2O7固体,平衡正向移动,K2Cr2O7转化率变大 |
III.MnCO3可用作电讯器材元件材料,还可用作瓷釉、颜料及制造锰盐的原料。它在空气中加热易转化为不同价态锰的氧化物,其固体残留率(
 )随温度的变化如图所示
)随温度的变化如图所示
(5)300℃时,剩余固体中n(Mn): n(O)为
(6)图中C点对应固体的成分为
您最近一年使用:0次
2022-12-01更新
|
225次组卷
|
6卷引用:新疆兵团地州学校 2022-2023 学年高三上学期一轮期中调研考试化学试题
名校
解题方法
9 . 下列物质的性质和用途相对应的是
| 选项 | 性质 | 用途 |
| A | MgO的熔点高 | 可用作耐高温材料 |
| B |  具有强氧化性 具有强氧化性 | 可用作供氧剂 |
| C | 浓 具有吸水性 具有吸水性 | 可用作食品干燥剂 |
| D |  易溶于水 易溶于水 | 可用作洗涤剂 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-11-10更新
|
93次组卷
|
2卷引用:新疆生产建设兵团第三师图木舒克市第一中学2023-2024学年高二上学期第二次月考试化学试卷
名校
10 . 类比法是一种学习化学的重要方法。下列“类比”中不合理的是
A. 与HCl反应生成 与HCl反应生成 ,则 ,则 也可与HCl反应生成 也可与HCl反应生成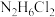 |
B. 溶液显碱性,则 溶液显碱性,则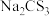 溶液显碱性 溶液显碱性 |
C.酸性: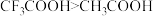 ,则碱性: ,则碱性: |
D. 沸点比 沸点比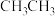 高,则苯酚的沸点比苯高 高,则苯酚的沸点比苯高 |
您最近一年使用:0次



