名校
解题方法
1 . I.配制100mL0.05mol·L-1Fe2(SO4)3溶液。
(1)该实验需要用到的玻璃仪器有:烧杯、量筒、玻璃棒、___________ 、___________ 。
(2)为了防止Fe2(SO4)3水解,在配置过程中可以加入少量___________ 。
Ⅱ.探究Fe2(SO4)3与Cu的反应。
原理预测:
(3)请写出Fe2(SO4)3与Cu的反应的离子方程式:___________ 。
开展实验并观察现象:
某实验小组在进行Fe2(SO4)3与Cu的反应时观察到了异常现象,决定对其进行进一步的探究。
实验I:
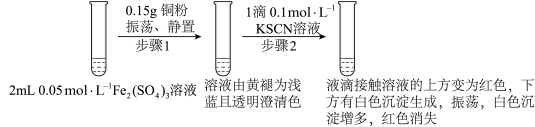
提出问题:
(4)实验前,小组同学预测步骤2后溶液不会变为红色,原因是___________ 。
查阅文献:i.CuSCN为难溶于水的白色固体;
ii.SCN-被称为拟卤素离子,性质与卤素离子相似。
提出猜想:经过实验测定白色固体为CuSCN,查阅资料后小组同学猜测CuSCN的生成有如下两种可能。
猜测1:Cu2+与KSCN发生了氧化还原反应。
猜测2:亚铁离子将其还原 ,
,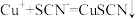 。
。
(5)猜测1的离子方程式为___________ 。
设计实验:
得出结论:
(6)实验Ⅱ中试管___________ (填字母)中的现象可以证实猜测1不成立。
(7)Fe3+的氧化性本应强于Cu2+,结合实验Ⅲ中的现象解释 能正向发生的原因:
能正向发生的原因:___________ 。
(1)该实验需要用到的玻璃仪器有:烧杯、量筒、玻璃棒、
(2)为了防止Fe2(SO4)3水解,在配置过程中可以加入少量
Ⅱ.探究Fe2(SO4)3与Cu的反应。
原理预测:
(3)请写出Fe2(SO4)3与Cu的反应的离子方程式:
开展实验并观察现象:
某实验小组在进行Fe2(SO4)3与Cu的反应时观察到了异常现象,决定对其进行进一步的探究。
实验I:

提出问题:
(4)实验前,小组同学预测步骤2后溶液不会变为红色,原因是
查阅文献:i.CuSCN为难溶于水的白色固体;
ii.SCN-被称为拟卤素离子,性质与卤素离子相似。
提出猜想:经过实验测定白色固体为CuSCN,查阅资料后小组同学猜测CuSCN的生成有如下两种可能。
猜测1:Cu2+与KSCN发生了氧化还原反应。
猜测2:亚铁离子将其还原
 ,
,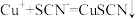 。
。(5)猜测1的离子方程式为
设计实验:
| 实验序号 | 对比实验及试剂 | 实验步骤 | 实验现象 |
| Ⅱ | A试管 2 mL 0.1 mol/LFeSO4溶液 | 加入1mL0.4mol·L-1KSCN溶液 | 开始时溶液的上方变为红色,一段时间后红色向下蔓延,最后充满整支试管 |
| B试管 2mL0.1mol/LCuSO4溶液 | 加入1mL0.4mol·L-1KSCN溶液 | 溶液变成绿色 | |
| Ⅲ | C试管 2mL0.1mol/LFeSO4溶液 | 加入2mL0.1mol·L-1CuSO4溶液 | 溶液变为淡蓝色 |
| 再加1mL0.4mol·L-1KSCN溶液 | 溶液的上层变为红色,有白色沉淀产生,一段时间后整支试管溶液呈深红色 |
(6)实验Ⅱ中试管
(7)Fe3+的氧化性本应强于Cu2+,结合实验Ⅲ中的现象解释
 能正向发生的原因:
能正向发生的原因:
您最近一年使用:0次
2023-11-01更新
|
972次组卷
|
4卷引用:广东省湛江市2024届高三上学期毕业班调研考试化学试题
名校
解题方法
2 . 某实验小组学生为探究氧化性: Br2 > Fe3+ > I2,设计下列实验方案。
【查阅资料】电极电势如下表:(已知:电极电势越高,氧化性越强)
(1)FeCl3溶液的配制:取FeCl3固体溶于___________ ,再稀释至指定浓度。配制250mL 0.1mol/L FeCl3溶液,需5.0 mol/L FeCl3溶液的体积为___________ mL,配制过程,图中不需要使用的仪器有___________ (填仪器名称)。

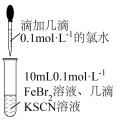
(2)利用FeBr2和氯水,设计实验证明氧化性:Br2 > Fe3+,实验如图所示,实验过程中,能证明氧化性:Br2 > Fe3+的现象是___________ 。
(3)利用0.1mol/L的FeCl3溶液和0.1mol/L的 溶液,不用任何试剂证明氧化性:Fe3+ > I2,FeCl3溶液和碘水颜色相近,设计的实验装置如图,实验过程中,电流计指针偏转,说明反应发生。
溶液,不用任何试剂证明氧化性:Fe3+ > I2,FeCl3溶液和碘水颜色相近,设计的实验装置如图,实验过程中,电流计指针偏转,说明反应发生。
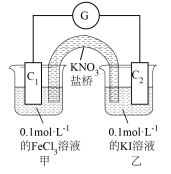
①通过外电路中电子流向:___________ (用C1、C2和→表示),可证明氧化性: 。
。
②也可通过甲池中颜色变化证明,甲池中颜色变化为___________ 。
(4)化学能可转化为电能,写出其在生活中常见的一种应用___________ 。
【查阅资料】电极电势如下表:(已知:电极电势越高,氧化性越强)
| 氧化还原电对(氧化型/还原型) | 电极反应式(氧化型+ne-=还原型) | 电极电势(E0/V) |
| Fe3+ +/ Fe2 | Fe3+ + e- = Fe2+ | 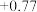 |
| I2 /I- | I2 + 2e- = 2I- | 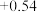 |
| Br2 /Br- | Br2 + 2e- = 2 Br- | 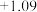 |

(2)利用FeBr2和氯水,设计实验证明氧化性:Br2 > Fe3+,实验如图所示,实验过程中,能证明氧化性:Br2 > Fe3+的现象是

(3)利用0.1mol/L的FeCl3溶液和0.1mol/L的
 溶液,不用任何试剂证明氧化性:Fe3+ > I2,FeCl3溶液和碘水颜色相近,设计的实验装置如图,实验过程中,电流计指针偏转,说明反应发生。
溶液,不用任何试剂证明氧化性:Fe3+ > I2,FeCl3溶液和碘水颜色相近,设计的实验装置如图,实验过程中,电流计指针偏转,说明反应发生。
①通过外电路中电子流向:
 。
。②也可通过甲池中颜色变化证明,甲池中颜色变化为
(4)化学能可转化为电能,写出其在生活中常见的一种应用
您最近一年使用:0次
3 . 某学习小组对“ 溶液的灼烧”进行实验探究。回答下列问题:
溶液的灼烧”进行实验探究。回答下列问题:
(1)如图所示将浸泡过 溶液的粉笔夹持于酒精灯上灼烧,加热过程中观察到粉笔表面颜色变化:黄色→红褐色→铁锈色→黑色。
溶液的粉笔夹持于酒精灯上灼烧,加热过程中观察到粉笔表面颜色变化:黄色→红褐色→铁锈色→黑色。 溶液的操作为先加
溶液的操作为先加____________ 溶解 ,再稀释至所需浓度。
,再稀释至所需浓度。
②用化学方程式解释粉笔表面出现红褐色的原因:________________ 。
③溶液变铁锈色是因为生成了______________ (填化学式)。
(2)针对粉笔表面颜色最终变为黑色的现象,设计实验探究黑色物质成分。
查阅资料: 是一种黑色粉末,不稳定,在空气中加热可被氧化为
是一种黑色粉末,不稳定,在空气中加热可被氧化为 ;隔绝空气加热歧化为
;隔绝空气加热歧化为 和
和 。
。
提出猜想:
猜想1:酒精与粉笔灼烧的产物;
猜想2:酒精还原铁锈色物质而得到的产物。
实验设计:
①实验1:利用一个简单的操作证明猜想1不成立,实验操作为________________ ,未呈现黑色。
②实验2:如图所示密闭装置中,先在浸泡过酒精的粉笔处加热,再在铁锈色物质处加热,观察到铁锈色物质变为黑色后持续加热 ,取下试管加热,观察到有砖红色沉淀产生,先在粉笔处加热的目的是
,取下试管加热,观察到有砖红色沉淀产生,先在粉笔处加热的目的是_______________ 。
限选试剂:黑色粉末样品、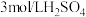 溶液、
溶液、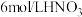 溶液、
溶液、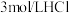 溶液、
溶液、 酸性
酸性 溶液、
溶液、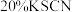 溶液、蒸馏水。
溶液、蒸馏水。
(4)由以上实验测得黑色粉末中铁元素的质量分数为_______________ (已知实验条件下所得 固体中
固体中 与
与 个数比为
个数比为 )。
)。
 溶液的灼烧”进行实验探究。回答下列问题:
溶液的灼烧”进行实验探究。回答下列问题:(1)如图所示将浸泡过
 溶液的粉笔夹持于酒精灯上灼烧,加热过程中观察到粉笔表面颜色变化:黄色→红褐色→铁锈色→黑色。
溶液的粉笔夹持于酒精灯上灼烧,加热过程中观察到粉笔表面颜色变化:黄色→红褐色→铁锈色→黑色。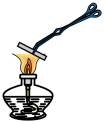
 溶液的操作为先加
溶液的操作为先加 ,再稀释至所需浓度。
,再稀释至所需浓度。②用化学方程式解释粉笔表面出现红褐色的原因:
③溶液变铁锈色是因为生成了
(2)针对粉笔表面颜色最终变为黑色的现象,设计实验探究黑色物质成分。
查阅资料:
 是一种黑色粉末,不稳定,在空气中加热可被氧化为
是一种黑色粉末,不稳定,在空气中加热可被氧化为 ;隔绝空气加热歧化为
;隔绝空气加热歧化为 和
和 。
。提出猜想:
猜想1:酒精与粉笔灼烧的产物;
猜想2:酒精还原铁锈色物质而得到的产物。
实验设计:
①实验1:利用一个简单的操作证明猜想1不成立,实验操作为
②实验2:如图所示密闭装置中,先在浸泡过酒精的粉笔处加热,再在铁锈色物质处加热,观察到铁锈色物质变为黑色后持续加热
 ,取下试管加热,观察到有砖红色沉淀产生,先在粉笔处加热的目的是
,取下试管加热,观察到有砖红色沉淀产生,先在粉笔处加热的目的是
限选试剂:黑色粉末样品、
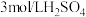 溶液、
溶液、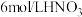 溶液、
溶液、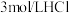 溶液、
溶液、 酸性
酸性 溶液、
溶液、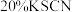 溶液、蒸馏水。
溶液、蒸馏水。实验序号 | 实验操作 | 实验现象 | 实验结论 |
| 3 | 取黑色粉末靠近磁铁 | 黑色粉末几乎全被磁铁吸引,未被吸收的黑色粉末经检验不含铁元素 | 黑色粉末不是 |
| 4 | 向盛有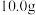 黑色粉末的试管中加入① 黑色粉末的试管中加入① | 固体全部溶解且无气泡产生 | ② |
| 5 | 将实验4的溶液分为四等份,用 酸性 酸性 溶液滴定至终点,重复三次平均消耗 溶液滴定至终点,重复三次平均消耗 溶液 溶液 | 滴定终点现象是 ③ | 黑色粉末是 |
| 6 | 取实验5中剩余一等份溶液于洁净试管中,加入④ | ⑤ |
(4)由以上实验测得黑色粉末中铁元素的质量分数为
 固体中
固体中 与
与 个数比为
个数比为 )。
)。
您最近一年使用:0次
2024-05-24更新
|
106次组卷
|
2卷引用:广东省部分学校2024届高三下学期5月份大联考化学试题
解题方法
4 . 劳动开创未来。下列日常劳动项目与所述化学知识没有关联的是
| 选项 | 劳动项目 | 化学知识 |
| A | 用洁厕灵(主要含浓盐酸)清洗马桶 | 盐酸具有还原性 |
| B | 用含过碳酸钠( )的“爆炸盐”洗涤衣物 )的“爆炸盐”洗涤衣物 | 其水溶液既有碱性又有强氧化性 |
| C | 以油脂为原料制作肥皂 | 油脂可以发生皂化反应 |
| D | 制作豆腐时加入石膏 | 电解质使胶体聚沉 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
解题方法
5 . 我国科学家发现某化合物(如图所示)可用于制造大功率固体激光器,填补国家空白。已知X、Y、Z、W为前20号元素且位于不同周期,原子序数依次递增,Y为地壳中含量最多的元素。下列有关说法正确的是


A.原子半径: |
| B.该化合物易溶于水且水溶液显碱性 |
| C.Z的最高价氧化物对应的水化物为强酸 |
D.单质的氧化性: ,单质的还原性: ,单质的还原性: |
您最近一年使用:0次
名校
解题方法
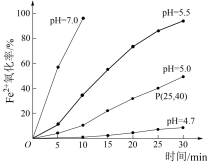
6 . 久置的FeSO4溶液变黄,一般认为是二价铁被氧化为三价铁的缘故。某研究小组为研究溶液中Fe2+被O2氧化的过程,查阅资料发现:溶液中Fe2+的氧化过程分为先后两步,首先是Fe2+水解,接着水解产物被O2氧化。于是小组同学决定研究常温下不同pH对Fe2+被O2氧化的影响,并测定了Fe2+氧化率随时间变化的关系,结果如图。
回答下列问题
(1)写出Fe2+水解的离子方程式是___________ ;要抑制FeSO4水解,可以的措施___________ 。
(2)若配制的FeSO4溶液浓度为0.01mol/L,反应过程中溶液体积不变,计算图中P点Fe2+氧化率的氧化速率___________ 。
(3)在酸性条件下,Fe2+被O2氧化的反应方程式为:___________ 。已知常温下该反应的平衡常数很大。则下列说法正确的是___________
a.Fe2+转化为Fe3+的趋势很大
b.Fe2+转化为Fe3+的速率很大
c.该反应进行得很完全
d.酸性条件下Fe2+不会被氧化
(4)结合图象分析可知,pH越大Fe2+氧化率越___________ 。
(5)研究小组在查阅资料时还得知:氧气的氧化性随溶液的酸性增强而增强。通过以上研究可知,配制FeSO4溶液的正确做法是___________ 。

回答下列问题
(1)写出Fe2+水解的离子方程式是
(2)若配制的FeSO4溶液浓度为0.01mol/L,反应过程中溶液体积不变,计算图中P点Fe2+氧化率的氧化速率
(3)在酸性条件下,Fe2+被O2氧化的反应方程式为:
a.Fe2+转化为Fe3+的趋势很大
b.Fe2+转化为Fe3+的速率很大
c.该反应进行得很完全
d.酸性条件下Fe2+不会被氧化
(4)结合图象分析可知,pH越大Fe2+氧化率越
(5)研究小组在查阅资料时还得知:氧气的氧化性随溶液的酸性增强而增强。通过以上研究可知,配制FeSO4溶液的正确做法是
您最近一年使用:0次
名校
解题方法
7 . 劳动创造美好生活。下列劳动项目与所述的化学知识有关联的是
| 选项 | 劳动项目 | 化学原理 |
| A | 洗涤餐具时可用热的纯碱溶液去油污 | 油脂在碱性条件下能发生水解反应 |
| B | 医生使用含微量硝酸银的滴眼液 | 硝酸根离子有强氧化性 |
| C | 面包师用小苏打作发泡剂烘焙面包 | Na2CO3可与酸反应 |
| D | 雕刻师用FeCl3溶液在铜板上刻出精美图案 | FeCl3溶液显酸性 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
解题方法
8 . 某工业废玻璃粉末含SiO2、Fe2O3、CeO2、FeO等。某课题小组设计如下工艺流程对资源进行回收,得到Ce(OH)4和硫酸铁铵矾。
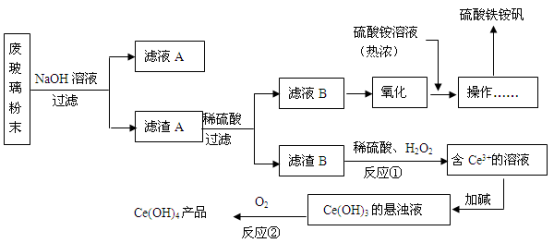
已知:CeO2不溶于稀硫酸;酸性条件下,Ce3+易水解,Ce4+有较强氧化性。
(1)硫酸铁铵矾可净水,其原理是(写离子方程式)________________________________ 。
(2)滤液A的主要成分_______________ (填写化学式)。
(3)反应①的离子方程式是_____________________________ 。
(4)反应②的化学反应方程式是__________________________ 。
(5)已知制硫酸铁铵矾晶体[Fe2(SO4) 3·(NH4) 2SO4·24H2O,式量964]的产率为80%,若加入13.2g (NH4) 2SO4(式量132),可制得晶体的质量是_________ 。
(6)化合物HT可作为萃取剂能将铈离子从水溶液中萃取出来,过程表示为:
Ce2(SO4)3(水层)+ 6HT(有机层) 2CeT3 (有机层)+3H2SO4(水层)
2CeT3 (有机层)+3H2SO4(水层)
分液得到CeT3(有机层),再加入H2SO4 获得较纯的含Ce3+的水溶液。可选择硫酸作反萃取剂的原因是___ (从平衡移动角度回答)。

已知:CeO2不溶于稀硫酸;酸性条件下,Ce3+易水解,Ce4+有较强氧化性。
(1)硫酸铁铵矾可净水,其原理是(写离子方程式)
(2)滤液A的主要成分
(3)反应①的离子方程式是
(4)反应②的化学反应方程式是
(5)已知制硫酸铁铵矾晶体[Fe2(SO4) 3·(NH4) 2SO4·24H2O,式量964]的产率为80%,若加入13.2g (NH4) 2SO4(式量132),可制得晶体的质量是
(6)化合物HT可作为萃取剂能将铈离子从水溶液中萃取出来,过程表示为:
Ce2(SO4)3(水层)+ 6HT(有机层)
 2CeT3 (有机层)+3H2SO4(水层)
2CeT3 (有机层)+3H2SO4(水层)分液得到CeT3(有机层),再加入H2SO4 获得较纯的含Ce3+的水溶液。可选择硫酸作反萃取剂的原因是
您最近一年使用:0次
2016-12-08更新
|
583次组卷
|
4卷引用:2015届广东湛江高三第二次模拟考试理综化学试卷
2015届广东湛江高三第二次模拟考试理综化学试卷2015届广东省湛江市高三普通高考测试(二)理综化学试卷2020届高三化学大二轮增分强化练—— 化学工艺流程题(已下线)专题七 工艺流程题(提分特训)-2020年高考二轮模块化复习之《元素化合物》名师讲案与提分特训
9 . 物质性质决定其用途,物质用途反映其性质。下列物质用途与性质对应关系不正确的是
| 选项 | 用途 | 性质 |
| A | SiO2用作光导纤维 | SiO2能把光的强弱转变为电流的强弱 |
| B | 工业上用纯碱去油污 | Na2CO3溶液水解呈碱性,油脂碱性条件下水解程度大 |
| C | 明矾用作净水剂 | 明矾溶于水形成Al(OH)3胶体,吸附水中悬浮杂质形成沉淀 |
| D | 三元催化器处理汽车尾气 | 尾气中CO有还原性,NOx有氧化性。在催化剂作用下转化为CO2和N2 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
解题方法
10 . 化学使生活更美好。下列生产生活对应化学原理解释错误的是
| 选项 | 生产生活 | 化学原理 |
| A | 焊接金属时用 溶液除锈 溶液除锈 |  加热易分解 加热易分解 |
| B |  可用于治疗胃酸过多 可用于治疗胃酸过多 |  能与酸反应 能与酸反应 |
| C |  是常用的自来水消毒剂 是常用的自来水消毒剂 |  具有强氧化性 具有强氧化性 |
| D | 酿制葡萄酒过程中添加适量二氧化硫 | 二氧化硫有还原性和杀菌作用 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次



