解题方法
1 . 钛是一种重要的金属,以钛铁矿[主要成分为钛酸亚铁(FeTiO3),还含有少量Fe2O3]为原料制备钛的工艺流程如图所示。
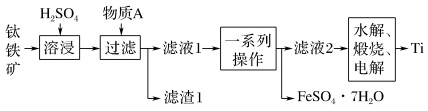
(1)溶浸过程中,为加快溶浸速率,通常可以采取的方法是___________ (写出1条即可)。物质A为___________ (填化学式)。
(2)滤液1中钛元素以TiO2+形式存在,则“溶浸”过程发生的主要反应的化学方程式为___________ 。“一系列操作”为蒸发浓缩、___________ 、过滤。
(3)“水解”步骤中生成TiO2·xH2O,“水解”反应为TiO2++(x+1)H2O=TiO2·xH2O↓+2H+,为提高TiO2·xH2O的产率,可采取的措施有___________ 。(写出1条即可)。
(4)“电解”是以石墨为阳极,TiO2为阴极,熔融CaO(含O2-)为电解质,阴极制得金属Ti 。阴极的电极反应式为___________ ;若阴极制得金属Ti 9.60g,则阳极产生气体___________ mol。
(5)将少量FeSO4·7H2O溶于水,加入一定量的NaHCO3溶液,可制得FeCO3,同时产生一种气体,请写出反应的离子方程式___________ 。

(1)溶浸过程中,为加快溶浸速率,通常可以采取的方法是
(2)滤液1中钛元素以TiO2+形式存在,则“溶浸”过程发生的主要反应的化学方程式为
(3)“水解”步骤中生成TiO2·xH2O,“水解”反应为TiO2++(x+1)H2O=TiO2·xH2O↓+2H+,为提高TiO2·xH2O的产率,可采取的措施有
(4)“电解”是以石墨为阳极,TiO2为阴极,熔融CaO(含O2-)为电解质,阴极制得金属Ti 。阴极的电极反应式为
(5)将少量FeSO4·7H2O溶于水,加入一定量的NaHCO3溶液,可制得FeCO3,同时产生一种气体,请写出反应的离子方程式
您最近一年使用:0次
解题方法
2 . 某实验小组通过以下实验,探究镀件表面镀铜的最佳条件。回答下列问题:
【查阅资料】①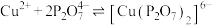
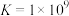 ;
;
② 在溶液中不稳定,容易发生歧化。
在溶液中不稳定,容易发生歧化。
【实验设计】用 、
、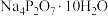 (焦磷酸钠)、添加剂配制一定浓度的电镀液,分别用纯铜和镀件作为两极材料,探究电镀液的pH、电流密度、电极板间距对镀层的影响。
(焦磷酸钠)、添加剂配制一定浓度的电镀液,分别用纯铜和镀件作为两极材料,探究电镀液的pH、电流密度、电极板间距对镀层的影响。
(1)要配制一定体积40 g/L的CuSO4溶液,以下仪器不需要用到的是___________ (填仪器名称)。
(2)镀件表面的油污可用热的纯碱溶液清洗,原因是___________ (填离子方程式)。
(3)电镀时阴极上发生的主要反应的电极反应式为___________ 。
【实验结果与数据分析】
i.其他条件不变时,电镀10 min,pH对电镀的影响如下表:
(4)实验3中,铜镀层的沉积速率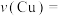
___________ mol/min(保留两位有效数字)。
(5)实验1和实验4中,酸性或碱性较强时,镀层出现斑驳的可能原因是___________ 。
ii.电流密度、电极板间距与镀膜质量的关系如图所示:
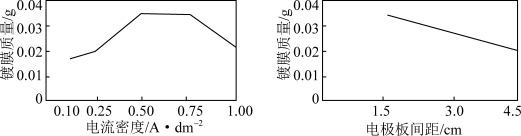
(6)电流密度小于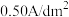 时,镀膜质量随电流密度增大而增大的原因是
时,镀膜质量随电流密度增大而增大的原因是___________ 。
(7)本实验电镀的最佳条件是pH为8.5、电流密度为___________ 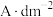 、电极板间距为
、电极板间距为___________ cm。
(8)使用最佳条件电镀时,在阳极附近的电镀液中出现红色固体沉积物,其可能原因是___________ (填离子方程式),通空气搅拌可防止红色固体沉积物形成。
【查阅资料】①
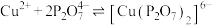
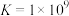 ;
;②
 在溶液中不稳定,容易发生歧化。
在溶液中不稳定,容易发生歧化。【实验设计】用
 、
、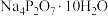 (焦磷酸钠)、添加剂配制一定浓度的电镀液,分别用纯铜和镀件作为两极材料,探究电镀液的pH、电流密度、电极板间距对镀层的影响。
(焦磷酸钠)、添加剂配制一定浓度的电镀液,分别用纯铜和镀件作为两极材料,探究电镀液的pH、电流密度、电极板间距对镀层的影响。(1)要配制一定体积40 g/L的CuSO4溶液,以下仪器不需要用到的是

(2)镀件表面的油污可用热的纯碱溶液清洗,原因是
(3)电镀时阴极上发生的主要反应的电极反应式为
【实验结果与数据分析】
i.其他条件不变时,电镀10 min,pH对电镀的影响如下表:
| 实验序号 | pH值 | 镀膜质量/g | 镀层外观 |
| 1 | 3 | 0.0136 | 表面斑驳 |
| 2 | 7 | 0.0258 | 光亮,不光滑 |
| 3 | 8.5 | 0.0356 | 光亮,光滑 |
| 4 | 10 | 0.0216 | 表面部分斑驳 |
(4)实验3中,铜镀层的沉积速率
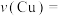
(5)实验1和实验4中,酸性或碱性较强时,镀层出现斑驳的可能原因是
ii.电流密度、电极板间距与镀膜质量的关系如图所示:

(6)电流密度小于
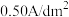 时,镀膜质量随电流密度增大而增大的原因是
时,镀膜质量随电流密度增大而增大的原因是(7)本实验电镀的最佳条件是pH为8.5、电流密度为
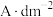 、电极板间距为
、电极板间距为(8)使用最佳条件电镀时,在阳极附近的电镀液中出现红色固体沉积物,其可能原因是
您最近一年使用:0次
3 . 按要求完成下题。
(1)写出H2S的电离方程式:______ 。
(2)0.1mol/LNa2CO3溶液中各离子浓度大小顺序为______ 。
(3)pH=3的醋酸溶液与pH=11的NaOH溶液等体积混合,所得溶液显______ 性。
(4)把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是______ 。
(5)常温下,NaCN溶液的pH>7,原因是______ (离子反应方程式)。
(6)常温下,pH=10的CH3COONa溶液中,由水电离出的c(OH-)=______ mol/L。
(7)常温下,0.05mol/LH2SO4溶液的pH=______ 。
(1)写出H2S的电离方程式:
(2)0.1mol/LNa2CO3溶液中各离子浓度大小顺序为
(3)pH=3的醋酸溶液与pH=11的NaOH溶液等体积混合,所得溶液显
(4)把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是
(5)常温下,NaCN溶液的pH>7,原因是
(6)常温下,pH=10的CH3COONa溶液中,由水电离出的c(OH-)=
(7)常温下,0.05mol/LH2SO4溶液的pH=
您最近一年使用:0次
4 . W、X、Y、Z为原子序数依次增大的四种短周期主族元素.W、X、Y简单离子的电子层结构相同,且Y离子半径在第三周期主族元素中最小;W的简单氢化物常温下呈液态且与Z同族,X和Z原子的最外层电子数之和为7。下列说法正确的是
| A.W与X形成的化合物中可能存在非极性键 |
| B.工业上采用电解Y的氯化物冶炼单质Y |
C.最高价氧化物对应的水化物碱性: |
| D.W、X、Z三种元素组成的化合物的水溶液一定显中性 |
您最近一年使用:0次
5 . 化学与生产、生活密切相关。下列叙述不涉及氧化还原反应的是
| A.电解饱和食盐水制烧碱 | B.用肥皂洗去衣服上的油污 |
| C.用碱液吸收二氧化氮 | D.聚乳酸包装材料完全降解 |
您最近一年使用:0次
2024-03-17更新
|
15次组卷
|
2卷引用:陕西省安康市高新中学2023-2024学年高三12月月考理科综合试题
名校
6 . 实验室利用含钴废渣[含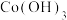 、
、 等]制备磁性材料
等]制备磁性材料 。回答下列问题:
。回答下列问题:
I.稀硫酸的配制。
(1)实验室里需要:450mL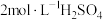 溶液,用98%浓硫酸(密度为
溶液,用98%浓硫酸(密度为 )配制该溶液时,所需的浓硫酸的体积为
)配制该溶液时,所需的浓硫酸的体积为_______ (保留1位小数)mL。
(2)下图关于容量瓶的操作,正确的是_______ 。
Ⅱ.浸取,将一定量的钴渣粉与 溶液配成悬浊液,加入三颈烧瓶中(装置如图),70℃通过仪器a缓慢滴加稀硫酸,充分反应,过滤。
溶液配成悬浊液,加入三颈烧瓶中(装置如图),70℃通过仪器a缓慢滴加稀硫酸,充分反应,过滤。_______ 作为最佳传热介质。
(5)该过程中,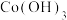 转化为
转化为 的离子方程式为
的离子方程式为_______ 。
Ⅲ.沉钴。Co(Ⅱ)盐溶液可以形成 、
、 和
和 等多种形式的沉淀。
等多种形式的沉淀。
已知:向0.100mol/L溶液中滴加NaOH溶液调节pH, 时开始出现
时开始出现 沉淀。
沉淀。
(6)向除杂后的 溶液中加入
溶液中加入 溶液或
溶液或 溶液作沉淀剂,可得到
溶液作沉淀剂,可得到 ,不能用同浓度的
,不能用同浓度的 溶液代替
溶液代替 溶液的原因是
溶液的原因是_______ 。
Ⅳ.制备 ,将所得的18.3g草酸钴晶体(
,将所得的18.3g草酸钴晶体( )高温灼烧,其热重分析图如图:
)高温灼烧,其热重分析图如图:_______ ,CD段发生反应的化学方程式为_______ 。
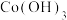 、
、 等]制备磁性材料
等]制备磁性材料 。回答下列问题:
。回答下列问题:I.稀硫酸的配制。
(1)实验室里需要:450mL
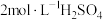 溶液,用98%浓硫酸(密度为
溶液,用98%浓硫酸(密度为 )配制该溶液时,所需的浓硫酸的体积为
)配制该溶液时,所需的浓硫酸的体积为(2)下图关于容量瓶的操作,正确的是
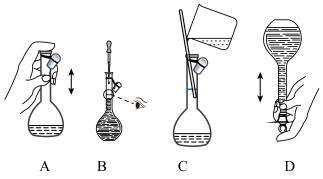
| A.定容时俯视容量瓶刻度线 |
| B.容量瓶未干燥处理 |
| C.定容加水时超过刻度线后,立即吸出多余的水 |
| D.将溶液从烧杯转移到容量瓶中后没有洗涤烧杯 |
Ⅱ.浸取,将一定量的钴渣粉与
 溶液配成悬浊液,加入三颈烧瓶中(装置如图),70℃通过仪器a缓慢滴加稀硫酸,充分反应,过滤。
溶液配成悬浊液,加入三颈烧瓶中(装置如图),70℃通过仪器a缓慢滴加稀硫酸,充分反应,过滤。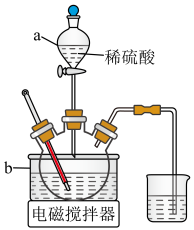
(5)该过程中,
 转化为
转化为 的离子方程式为
的离子方程式为Ⅲ.沉钴。Co(Ⅱ)盐溶液可以形成
 、
、 和
和 等多种形式的沉淀。
等多种形式的沉淀。已知:向0.100mol/L溶液中滴加NaOH溶液调节pH,
 时开始出现
时开始出现 沉淀。
沉淀。(6)向除杂后的
 溶液中加入
溶液中加入 溶液或
溶液或 溶液作沉淀剂,可得到
溶液作沉淀剂,可得到 ,不能用同浓度的
,不能用同浓度的 溶液代替
溶液代替 溶液的原因是
溶液的原因是Ⅳ.制备
 ,将所得的18.3g草酸钴晶体(
,将所得的18.3g草酸钴晶体( )高温灼烧,其热重分析图如图:
)高温灼烧,其热重分析图如图: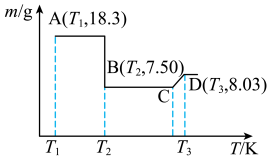
您最近一年使用:0次
2024-03-06更新
|
545次组卷
|
5卷引用:陕西省西安中学2023-2024学年高三下学期模拟预测(五)理综试题-高中化学
陕西省西安中学2023-2024学年高三下学期模拟预测(五)理综试题-高中化学2024届四川省成都市第七中学高三下学期二模诊断考试理综试题-高中化学(已下线) 2024届四川省成都市第七中学高三下学期二诊模拟考试理综试卷-高中化学2024届四川省仁寿第一中学校(北校区)二模理综试题-高中化学(已下线)提升练08 化学实验综合-【查漏补缺】2024年高考化学复习冲刺过关(新高考专用)
名校
7 . 我国沿海城市采用反渗透法将海水淡化,得到淡水供市民使用,剩余母液继续加工获得其他产品。某实验小组同学模拟工业生产流程,进行如图实验。

回答下列问题:
(1)海水淡化的方法还有___________ (写一种)。
(2)制取 第一次通入
第一次通入 时发生反应的离子方程式为
时发生反应的离子方程式为___________ 。
(3)步骤①包括加热蒸发浓缩、___________ 、过滤。
(4)若要验证所得无水 中不含
中不含 ,最简单的方法是
,最简单的方法是___________ 。
(5)通电时无水 在熔融状态下反应的化学方程式为
在熔融状态下反应的化学方程式为___________ 。
(6)写出钛铁矿在高温下经氧化得到四氯化铁的化学方程式___________ 。
(7)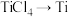 需要在氩气中进行的原因是
需要在氩气中进行的原因是___________ 。

回答下列问题:
(1)海水淡化的方法还有
(2)制取
 第一次通入
第一次通入 时发生反应的离子方程式为
时发生反应的离子方程式为(3)步骤①包括加热蒸发浓缩、
(4)若要验证所得无水
 中不含
中不含 ,最简单的方法是
,最简单的方法是(5)通电时无水
 在熔融状态下反应的化学方程式为
在熔融状态下反应的化学方程式为(6)写出钛铁矿在高温下经氧化得到四氯化铁的化学方程式
(7)
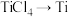 需要在氩气中进行的原因是
需要在氩气中进行的原因是
您最近一年使用:0次
名校
解题方法
8 . 下列关于化学原理的应用正确的是
A.用饱和 溶液清洗油污,加热可以增强去污效果,是因为升温能促进 溶液清洗油污,加热可以增强去污效果,是因为升温能促进 电离 电离 |
B.用 除去污水中的 除去污水中的 和 和 |
C.锅炉除垢的过程中把 转化为 转化为 |
D.可以用电解 溶液制取 溶液制取 |
您最近一年使用:0次
名校
9 . 下列相关条件下的离子方程式书写不正确的是
A. 溶液中通入适量氯气产生沉淀: 溶液中通入适量氯气产生沉淀: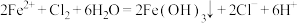 |
B.钢铁发生电化学腐蚀的负极反应: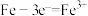 |
C.泡沫灭火器的灭火原理:Al3++3HCO =Al(OH)3↓+3CO2↑ =Al(OH)3↓+3CO2↑ |
D.氢氧酸性燃料电池的正极反应: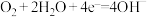 |
您最近一年使用:0次
2024-02-14更新
|
75次组卷
|
2卷引用:陕西省咸阳市武功县普集高级中学2023-2024学年高二上学期12月月考化学试题
名校
解题方法
10 . 化学与生产生活密切相关,下列事实与盐类水解无关的有几个
①长期施用铵态氮肥会使土壤酸化
②配制 溶液时,加入一定量Fe粉
溶液时,加入一定量Fe粉
③明矾可以作为净水剂
④碳酸钠的酚酞溶液中滴加氯化钡溶液,红色变浅
⑤泡沫灭火器的原理
⑥ 溶液蒸干灼烧得到
溶液蒸干灼烧得到
⑦ 胶体的制备
胶体的制备
⑧实验室配置 时将它溶解在盐酸中
时将它溶解在盐酸中
⑨用热的纯碱溶液去除油污
⑩碳酸钠不能盛放在带有磨口玻璃塞的试剂瓶中
①长期施用铵态氮肥会使土壤酸化
②配制
 溶液时,加入一定量Fe粉
溶液时,加入一定量Fe粉③明矾可以作为净水剂
④碳酸钠的酚酞溶液中滴加氯化钡溶液,红色变浅
⑤泡沫灭火器的原理
⑥
 溶液蒸干灼烧得到
溶液蒸干灼烧得到
⑦
 胶体的制备
胶体的制备 ⑧实验室配置
 时将它溶解在盐酸中
时将它溶解在盐酸中⑨用热的纯碱溶液去除油污
⑩碳酸钠不能盛放在带有磨口玻璃塞的试剂瓶中
| A.0个 | B.1个 | C.2个 | D.3个 |
您最近一年使用:0次



