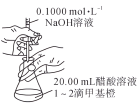
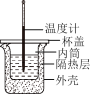
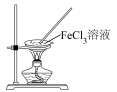
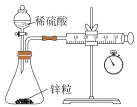
1 . 用下列装置进行的实验中,能达到其实验目的的是
|
|
|
|
| ① | ② | ③ | ④ |
| A.用装置①可准确测定醋酸溶液的浓度 |
| B.用装置②可测定中和反应的反应热 |
C.用装置③可由 溶液制无水 溶液制无水 固体 固体 |
| D.用装置④测定锌与稀硫酸的反应速率 |
您最近一年使用:0次
2024-08-17更新
|
32次组卷
|
2卷引用:三湘名校教育联盟2023-2024学年高二上学期中联考化学试卷
名校
2 . Ⅰ.由FeCl3·6H2O制备无水FeCl3,将FeCl3·6H2O与液体SOCl2混合并加热,制得无水FeCl3。已知SOCl2沸点为77℃,反应方程式为 ,装置如下图所示(夹持和加热装置略)。
,装置如下图所示(夹持和加热装置略)。___________ 。NaOH溶液的作用是___________ 。
(2)由下列结晶水合物制备无水盐,适宜使用上述方法的是___________ (填标号)。
a. b.
b.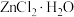 c.
c.
Ⅱ.世界环保联盟要求ClO2逐渐取代Cl2作为自来水消毒剂。
实验室用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料,通过以下过程制备ClO2:
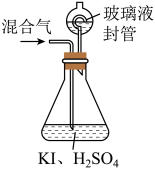
ⅱ.在玻璃液封装置中加入水,使液面没过玻璃液封管的管口;
ⅲ.将一定量的混合气体通入锥形瓶中吸收;
ⅳ.将玻璃液封装置中的水倒入锥形瓶中;
ⅴ.用 硫代硫酸钠标准溶液滴定锥形瓶中的溶液(
硫代硫酸钠标准溶液滴定锥形瓶中的溶液( ),指示剂显示终点时共用去10.00mL硫代硫酸钠溶液。
),指示剂显示终点时共用去10.00mL硫代硫酸钠溶液。
(3)在此过程中:
①锥形瓶内ClO2与碘化钾反应的离子方程式为___________ 。
②ⅴ中加入的指示剂通常为淀粉溶液,滴定至终点的现象是___________ 。
③测得混合气中ClO2的质量为___________ g(保留四位有效数字)。
(4)用ClO2处理过的饮用水会含有一定量的亚氯酸盐。若要除去超标的亚氯酸盐,下列物质最适宜的是___________ (填标号)。
a.明矾 b.碘化钾 c.硫酸亚铁 d.盐酸
 ,装置如下图所示(夹持和加热装置略)。
,装置如下图所示(夹持和加热装置略)。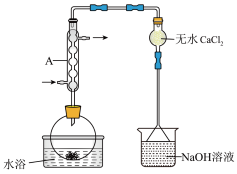
(2)由下列结晶水合物制备无水盐,适宜使用上述方法的是
a.
 b.
b.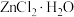 c.
c.
Ⅱ.世界环保联盟要求ClO2逐渐取代Cl2作为自来水消毒剂。
实验室用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料,通过以下过程制备ClO2:
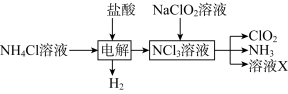
ⅱ.在玻璃液封装置中加入水,使液面没过玻璃液封管的管口;
ⅲ.将一定量的混合气体通入锥形瓶中吸收;
ⅳ.将玻璃液封装置中的水倒入锥形瓶中;
ⅴ.用
 硫代硫酸钠标准溶液滴定锥形瓶中的溶液(
硫代硫酸钠标准溶液滴定锥形瓶中的溶液( ),指示剂显示终点时共用去10.00mL硫代硫酸钠溶液。
),指示剂显示终点时共用去10.00mL硫代硫酸钠溶液。(3)在此过程中:
①锥形瓶内ClO2与碘化钾反应的离子方程式为
②ⅴ中加入的指示剂通常为淀粉溶液,滴定至终点的现象是
③测得混合气中ClO2的质量为
(4)用ClO2处理过的饮用水会含有一定量的亚氯酸盐。若要除去超标的亚氯酸盐,下列物质最适宜的是
a.明矾 b.碘化钾 c.硫酸亚铁 d.盐酸
您最近一年使用:0次
名校
解题方法
3 . 高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺如下图所示。回答下列问题: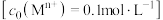 形成氢氧化物沉淀的pH范围如下:
形成氢氧化物沉淀的pH范围如下:
(1)“滤渣1”含有S和___________ 。
(2)写出基态 的价层电子排布式:
的价层电子排布式:___________ 。
(3)在“溶浸”工艺中,为了提高浸取效果,可采取的措施有___________ (写一种)。
(4)“调pH”除铁和铝,溶液的pH范围应调节为___________ ~6之间。
(5)“除杂1”的目的是除去 和
和 ,“滤渣3”的主要成分是
,“滤渣3”的主要成分是___________ 。
(6)“除杂2”的目的是生成 沉淀除去
沉淀除去 ,若溶液酸度过高,
,若溶液酸度过高, 沉淀不完全,原因是
沉淀不完全,原因是___________ 。
(7)写出“沉锰”的离子方程式:___________ 。
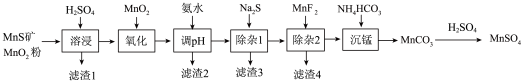
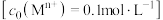 形成氢氧化物沉淀的pH范围如下:
形成氢氧化物沉淀的pH范围如下:| 金属离子 |  |  |  |  |  |  |  |
| 开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 | 6.9 |
| 沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 | 8.9 |
(1)“滤渣1”含有S和
(2)写出基态
 的价层电子排布式:
的价层电子排布式:(3)在“溶浸”工艺中,为了提高浸取效果,可采取的措施有
(4)“调pH”除铁和铝,溶液的pH范围应调节为
(5)“除杂1”的目的是除去
 和
和 ,“滤渣3”的主要成分是
,“滤渣3”的主要成分是(6)“除杂2”的目的是生成
 沉淀除去
沉淀除去 ,若溶液酸度过高,
,若溶液酸度过高, 沉淀不完全,原因是
沉淀不完全,原因是(7)写出“沉锰”的离子方程式:
您最近一年使用:0次
名校
4 . 下列实验过程可以达到实验目的的是
| 实验目的 | 实验过程 | |
| A | 配制氯化铁溶液 | 将氯化铁溶解在较浓的盐酸中再加水稀释 |
| B | 证明酸性HX>CH3COOH | 用pH计测定NaX溶液、CH3COONa溶液的pH,pH前者小 |
| C | 制备纯净的Cl2 | 将Cl2与HCl混合气体通过饱和食盐水即可得到 |
| D | 探究浓度对反应速率的影响 | 向2支盛有5mL不同浓度Na2SO3溶液的试管中同时加入2mL5%H2O2溶液,观察实验现象 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2024-05-08更新
|
74次组卷
|
2卷引用:湖南省雅礼教育集团2023-2024学年高二下学期期中考试化学试题
名校
解题方法
5 . 关于化学在生活中的应用,下列说法错误的是
| A.热的纯碱溶液去油污,效果更好 |
| B.BaCO3不溶于水,可用作医疗上检查肠胃的钡餐 |
| C.常温下,NH4F溶液不能保存在玻璃试剂瓶中 |
| D.使用含氟牙膏,可以使牙齿表面的羟基磷灰石转化成更坚固的氟磷灰石 |
您最近一年使用:0次
2023-12-31更新
|
163次组卷
|
4卷引用:湖南省石门县第一中学2023-2024学年高二上学期期中考试化学试题
湖南省石门县第一中学2023-2024学年高二上学期期中考试化学试题湖北省荆荆襄宜七校考试联盟2023-2024学年高二上学期期中联考化学试题(已下线)专题06 沉淀溶解平衡-【寒假自学课】2024年高二化学寒假提升学与练(人教版2019)广西钦州市第四中学2023-2024学年高二上学期11月考试化学试卷
6 . 下列有关实验现象和解释或结论都正确的是
选项 | 实验操作 | 现象 | 解释或结论 |
A | 将氯化铁溶液加热灼烧 | 有固体析出 | 该固体是氯化铁 |
B | 室温下,用pH试纸分别测定等物质的量浓度的 溶液和 溶液和 溶液的pH 溶液的pH |  溶液对应的pH更大 溶液对应的pH更大 | 酸性: |
C | 将充满 的密闭玻璃球浸泡在热水中 的密闭玻璃球浸泡在热水中 | 红棕色变深 | 反应 的 的 |
D | 向 的 的 溶液中加入4滴 溶液中加入4滴 的 的 溶液,再加10滴 溶液,再加10滴 的 的 溶液,再振荡 溶液,再振荡 | 先生成白色沉淀,后产生黄色沉淀 | 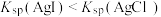 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
7 . 氧化钪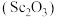 可用作半导体镀层的蒸镀材料,也可制成可变波长的固体激光器和高清晰度的电视电子枪、金属卤化物灯等。从钛铁矿(主要成分为
可用作半导体镀层的蒸镀材料,也可制成可变波长的固体激光器和高清晰度的电视电子枪、金属卤化物灯等。从钛铁矿(主要成分为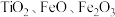 ,还含有
,还含有 等元素)中提取
等元素)中提取 的流程如下图。
的流程如下图。
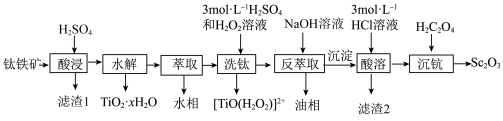
已知:
①当离子浓度减小至 时可认为沉淀完全。
时可认为沉淀完全。
②室温下 完全沉淀的
完全沉淀的 为1.05。
为1.05。
③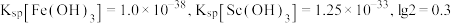 。
。
回答下列问题:
(1)“酸浸”后 元素转化为
元素转化为 ,其水解反应的离子方程式是
,其水解反应的离子方程式是_______ 。
(2) 既有氧化性又有还原性,还有弱酸性,请写出它的电离方程式
既有氧化性又有还原性,还有弱酸性,请写出它的电离方程式_______ 。
(3)萃取剂萃取 的反应原理为阳离子交换:
的反应原理为阳离子交换: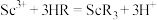 (
( 代表萃取剂)。在“反萃取”中反应生成含
代表萃取剂)。在“反萃取”中反应生成含 化合物的化学方程式是
化合物的化学方程式是_______ 。
(4)“酸溶”后滤液中存在的金属阳离子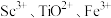 浓度均小于
浓度均小于 ,再用氨水调节溶液
,再用氨水调节溶液 使
使 、
、 沉淀完全而
沉淀完全而 不沉淀,则调
不沉淀,则调 应控制的范围是
应控制的范围是_______ 。
(5)由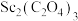 在空气中煅烧生成
在空气中煅烧生成 的化学反应方程式
的化学反应方程式_______ 。
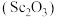 可用作半导体镀层的蒸镀材料,也可制成可变波长的固体激光器和高清晰度的电视电子枪、金属卤化物灯等。从钛铁矿(主要成分为
可用作半导体镀层的蒸镀材料,也可制成可变波长的固体激光器和高清晰度的电视电子枪、金属卤化物灯等。从钛铁矿(主要成分为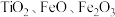 ,还含有
,还含有 等元素)中提取
等元素)中提取 的流程如下图。
的流程如下图。
已知:
①当离子浓度减小至
 时可认为沉淀完全。
时可认为沉淀完全。②室温下
 完全沉淀的
完全沉淀的 为1.05。
为1.05。③
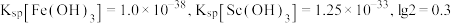 。
。回答下列问题:
(1)“酸浸”后
 元素转化为
元素转化为 ,其水解反应的离子方程式是
,其水解反应的离子方程式是(2)
 既有氧化性又有还原性,还有弱酸性,请写出它的电离方程式
既有氧化性又有还原性,还有弱酸性,请写出它的电离方程式(3)萃取剂萃取
 的反应原理为阳离子交换:
的反应原理为阳离子交换: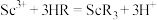 (
( 代表萃取剂)。在“反萃取”中反应生成含
代表萃取剂)。在“反萃取”中反应生成含 化合物的化学方程式是
化合物的化学方程式是(4)“酸溶”后滤液中存在的金属阳离子
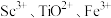 浓度均小于
浓度均小于 ,再用氨水调节溶液
,再用氨水调节溶液 使
使 、
、 沉淀完全而
沉淀完全而 不沉淀,则调
不沉淀,则调 应控制的范围是
应控制的范围是(5)由
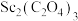 在空气中煅烧生成
在空气中煅烧生成 的化学反应方程式
的化学反应方程式
您最近一年使用:0次
2023-12-19更新
|
326次组卷
|
2卷引用:湖南省雅礼教育集团2023-2024学年高二上学期期中考试化学试题
名校
解题方法
8 . 下列离子方程式不正确的是
A.向 溶液中加入小粒金属钠: 溶液中加入小粒金属钠: |
B. 溶液与足量的 溶液与足量的 溶液混合: 溶液混合: |
C.向溴水中滴加少量 溶液中: 溶液中: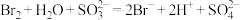 |
D.泡沫灭火器的反应原理: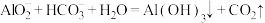 |
您最近一年使用:0次
2023-11-23更新
|
257次组卷
|
3卷引用:湖南省雅礼教育集团2023-2024学年高二上学期期中考试化学试题
解题方法
9 .  、CuCl是重要的化工原料,常用来作为有机合成的催化剂。实验室常用如下装置来制备
、CuCl是重要的化工原料,常用来作为有机合成的催化剂。实验室常用如下装置来制备 。
。

已知: 易潮解;CuCl不溶于乙醇和稀盐酸;
易潮解;CuCl不溶于乙醇和稀盐酸; 在酸性条件下被还原成
在酸性条件下被还原成 。
。
Ⅰ. 的制备
的制备
(1)实验开始时需要先打开A装置中分液漏斗活塞滴加浓盐酸,一段时间后再点燃D处酒精灯,目的是___________ 。
(2)装置A中发生反应的化学方程式是___________ ;该反应氧化剂与还原剂的物质的量之比为___________ 。
(3)B装置所盛试剂为___________ ;E装置的作用是___________ 。
Ⅱ.CuCl的制备
将上述实验制得的粉末加水溶解,滴加少量稀盐酸,向溶液中通入适量的 气体,加热即可得到白色沉淀,将过滤后的白色沉淀用乙醇洗涤2~3次后,干燥即可得到CuCl晶体。
气体,加热即可得到白色沉淀,将过滤后的白色沉淀用乙醇洗涤2~3次后,干燥即可得到CuCl晶体。
(4)加少量盐酸的作用是___________ 。
(5)用 和
和 ,制备CuCl的离子方程式为
,制备CuCl的离子方程式为___________ 。
(6)用乙醇洗而不用水洗的原因是___________ 。
 、CuCl是重要的化工原料,常用来作为有机合成的催化剂。实验室常用如下装置来制备
、CuCl是重要的化工原料,常用来作为有机合成的催化剂。实验室常用如下装置来制备 。
。
已知:
 易潮解;CuCl不溶于乙醇和稀盐酸;
易潮解;CuCl不溶于乙醇和稀盐酸; 在酸性条件下被还原成
在酸性条件下被还原成 。
。Ⅰ.
 的制备
的制备(1)实验开始时需要先打开A装置中分液漏斗活塞滴加浓盐酸,一段时间后再点燃D处酒精灯,目的是
(2)装置A中发生反应的化学方程式是
(3)B装置所盛试剂为
Ⅱ.CuCl的制备
将上述实验制得的粉末加水溶解,滴加少量稀盐酸,向溶液中通入适量的
 气体,加热即可得到白色沉淀,将过滤后的白色沉淀用乙醇洗涤2~3次后,干燥即可得到CuCl晶体。
气体,加热即可得到白色沉淀,将过滤后的白色沉淀用乙醇洗涤2~3次后,干燥即可得到CuCl晶体。(4)加少量盐酸的作用是
(5)用
 和
和 ,制备CuCl的离子方程式为
,制备CuCl的离子方程式为(6)用乙醇洗而不用水洗的原因是
您最近一年使用:0次
名校
10 . 化学与生产、生活和科技息息相关,下列说法错误的是
A.杭州亚运会的火炬燃烧时,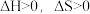 |
| B.汽油燃油车上的三元催化器中的催化剂能提高反应物中活化分子百分数,加快反应速率 |
C. 溶液呈酸性,可用于除铁锈 溶液呈酸性,可用于除铁锈 |
D.工业一般选择 合成氨,原因之一是铁触媒在500℃左右时活性最大 合成氨,原因之一是铁触媒在500℃左右时活性最大 |
您最近一年使用:0次
2023-11-04更新
|
331次组卷
|
5卷引用:湖南省株洲市炎陵县第一中学 炎陵县湘山高级中学2023-2024学年高二上学期12月期中联考化学试题