1 . 硫单质及其化合物应用广泛。硫的一种单质 难溶于水,易溶于
难溶于水,易溶于 溶液。
溶液。 可用于制作锂硫电池,放电总反应为
可用于制作锂硫电池,放电总反应为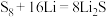 。硫的重要化合物还包括
。硫的重要化合物还包括 、甲硫醇
、甲硫醇 、
、 、多硫化钠
、多硫化钠 、过二硫酸钠
、过二硫酸钠 等。
等。 下,锂硫剂
下,锂硫剂 与
与 共同作用可用于脱除
共同作用可用于脱除 生成
生成 和
和 ;
; 具有强氧化性,在酸性条件下能将
具有强氧化性,在酸性条件下能将 氧化为
氧化为 。下列化学反应表示正确的是
。下列化学反应表示正确的是
 难溶于水,易溶于
难溶于水,易溶于 溶液。
溶液。 可用于制作锂硫电池,放电总反应为
可用于制作锂硫电池,放电总反应为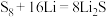 。硫的重要化合物还包括
。硫的重要化合物还包括 、甲硫醇
、甲硫醇 、
、 、多硫化钠
、多硫化钠 、过二硫酸钠
、过二硫酸钠 等。
等。 下,锂硫剂
下,锂硫剂 与
与 共同作用可用于脱除
共同作用可用于脱除 生成
生成 和
和 ;
; 具有强氧化性,在酸性条件下能将
具有强氧化性,在酸性条件下能将 氧化为
氧化为 。下列化学反应表示正确的是
。下列化学反应表示正确的是A. 水解: 水解: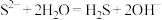 |
B.锂硫电池放电时的正极反应: |
C.脱硫剂除烟气中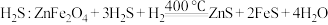 |
D. 氧化 氧化 |
您最近一年使用:0次
名校
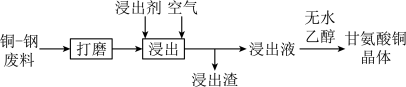
2 . 铜-钢双金属废料和铜烟灰是铜的重要二次资源。
Ⅰ.从铜-钢双金属废料中浸出铜的工艺流程如下:
 不同,甘氨酸在水溶液中分别以
不同,甘氨酸在水溶液中分别以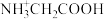 、
、 或
或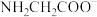 为主要形式存在。内盐
为主要形式存在。内盐 是两性化合物,请用离子方程式表示其水解使水溶液呈碱性的原因:
是两性化合物,请用离子方程式表示其水解使水溶液呈碱性的原因:(2)浸出剂的制备:主要原料有甘氨酸(简写为
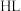 )、
)、 溶液和
溶液和 固体。取一定量
固体。取一定量 固体溶于水,随后依次加入
固体溶于水,随后依次加入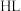 ”或“
”或“ ”,下同)、
”,下同)、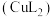 、
、 等。
等。(3)浸出:将经打磨的铜钢废料投入浸出剂,控制温度50℃,通入空气,并搅拌。浸出剂不与钢作用,但与铜反应,最终铜全部转化为
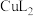 进入溶液,从而实现铜、钢分离。
进入溶液,从而实现铜、钢分离。①浸出时发生的反应过程为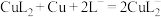 、
、
②其它条件不变时,空气流量对铜浸出速率的影响如图1所示。当空气流量超过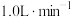 时,铜浸出速率急剧下降的可能原因是
时,铜浸出速率急剧下降的可能原因是

Ⅱ.从铜烟灰(主要成分为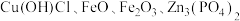 )中回收铜的主要步骤为:酸浸→萃取→反萃取→电解。
)中回收铜的主要步骤为:酸浸→萃取→反萃取→电解。
已知: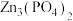 溶于无机酸。
溶于无机酸。
(5)萃取、反萃取:向浸出液(
 浓度为
浓度为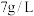 )中加入有机萃取剂
)中加入有机萃取剂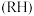 萃取,其原理可表示为:
萃取,其原理可表示为: (水层)
(水层) (有机层)
(有机层)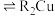 (有机层)
(有机层) (水层)。
(水层)。向萃取所得有机相中加入硫酸,反萃取得到水相( 浓度达
浓度达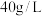 )。该工艺中设计萃取、反萃取的目的是
)。该工艺中设计萃取、反萃取的目的是
您最近一年使用:0次
2023-06-28更新
|
361次组卷
|
5卷引用:江苏省常州市教育学会2022-2023学年高二下学期期末学业水平监测化学试题
江苏省常州市教育学会2022-2023学年高二下学期期末学业水平监测化学试题(已下线)工业流程题江苏省扬州市2024届高三上学期期初考试化学模拟试题(已下线)高二化学下学期期末押题卷01-【好题汇编】备战2023-2024学年高二化学下学期期末真题分类汇编(江苏专用)宁夏回族自治区银川一中2024届高三下学期考前热身训练化学试卷2
解题方法
3 . Na2S2O3俗称大苏打(海波),是重要的化工原料,无色易溶于水,不溶于乙醇,在中性或碱性环境中稳定,在40~45℃熔化,48℃分解。实验室用Na2SO3和过量硫粉(不溶于水,可溶于乙醇)在水溶液中加热反应制取Na2S2O3•5H2O晶体的步骤如下:
(图1是有关物质的溶解度曲线)[反应原理:Na2SO3(aq)+S(s) Na2S2O3(aq)]
Na2S2O3(aq)]
①称取一定量的Na2SO3于烧杯中,溶于水。
②另取过量的硫粉,用少许乙醇润湿后,加到上述溶液中。
③如图2所示(部分装置略去),水浴加热,微沸,反应后趁热过滤。
④滤液在经过相关实验操作后析出Na2S2O3•5H2O晶体。
⑤进行减压过滤并低温干燥。

(1)Na2S2O3是一种强碱弱酸盐,则其溶液显________ (填“酸性”、“中性”、“碱性”),原因是________ (用离子方程式表示)。
(2)图2中,仪器B的名称是________ 。
(3)实验步骤②中,加入的硫粉用乙醇润湿的目的是________ 。
(4)实验步骤③中,趁热过滤的原因是________ 。
(5)实验步骤④中,应采取的相关实验操作为________ 。
(6)实验步骤⑤中,采用低温干燥的目的是________ 。
(7)产品中除了有未反应的Na2SO3外,最可能存在的无机杂质是________ 。
(图1是有关物质的溶解度曲线)[反应原理:Na2SO3(aq)+S(s)
 Na2S2O3(aq)]
Na2S2O3(aq)]①称取一定量的Na2SO3于烧杯中,溶于水。
②另取过量的硫粉,用少许乙醇润湿后,加到上述溶液中。
③如图2所示(部分装置略去),水浴加热,微沸,反应后趁热过滤。
④滤液在经过相关实验操作后析出Na2S2O3•5H2O晶体。
⑤进行减压过滤并低温干燥。

(1)Na2S2O3是一种强碱弱酸盐,则其溶液显
(2)图2中,仪器B的名称是
(3)实验步骤②中,加入的硫粉用乙醇润湿的目的是
(4)实验步骤③中,趁热过滤的原因是
(5)实验步骤④中,应采取的相关实验操作为
(6)实验步骤⑤中,采用低温干燥的目的是
(7)产品中除了有未反应的Na2SO3外,最可能存在的无机杂质是
您最近一年使用:0次
真题
名校
4 . 以软锰矿粉(含MnO2及少量Fe、Al、Si、Ca、Mg等的氧化物)为原料制备电池级MnO2。
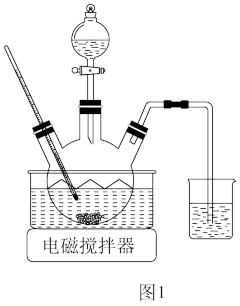
(1)浸取。将一定量软锰矿粉与Na2SO3、H2SO4溶液中的一种配成悬浊液,加入到三颈瓶中(图1),70℃下通过滴液漏斗缓慢滴加另一种溶液,充分反应,过滤。滴液漏斗中的溶液是___ ;MnO2转化为Mn2+的离子方程式为___ 。
(2)除杂。向已经除去Fe、Al、Si的MnSO4溶液(pH约为5)中加入NH4F溶液,溶液中的Ca2+、Mg2+形成氟化物沉淀。若沉淀后上层清液中c(F-)=0.05mol·L-1,则 =
=___ 。[Ksp(MgF2)=5×10-11,Ksp(CaF2)=5×10-9]
(3)制备MnCO3。在搅拌下向100mL1mol·L-1MnSO4溶液中缓慢滴加1mol·L-1NH4HCO3溶液,过滤、洗涤、干燥,得到MnCO3固体。需加入NH4HCO3溶液的体积约为___ 。
(4)制备MnO2。MnCO3经热解、酸浸等步骤可制备MnO2。MnCO3在空气气流中热解得到三种价态锰的氧化物,锰元素所占比例(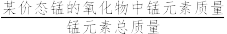 ×100%)随热解温度变化的曲线如图2所示。已知:MnO与酸反应生成Mn2+;Mn2O3氧化性强于Cl2,加热条件下Mn2O3在酸性溶液中转化为MnO2和Mn2+。
×100%)随热解温度变化的曲线如图2所示。已知:MnO与酸反应生成Mn2+;Mn2O3氧化性强于Cl2,加热条件下Mn2O3在酸性溶液中转化为MnO2和Mn2+。
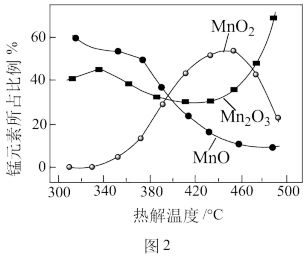
为获得较高产率的MnO2,请补充实验方案:取一定量MnCO3置于热解装置中,通空气气流,___ ,固体干燥,得到MnO2。(可选用的试剂:1mol·L-1H2SO4溶液、2mol·L-1HCl溶液、BaCl2溶液、AgNO3溶液)。
(1)浸取。将一定量软锰矿粉与Na2SO3、H2SO4溶液中的一种配成悬浊液,加入到三颈瓶中(图1),70℃下通过滴液漏斗缓慢滴加另一种溶液,充分反应,过滤。滴液漏斗中的溶液是

(2)除杂。向已经除去Fe、Al、Si的MnSO4溶液(pH约为5)中加入NH4F溶液,溶液中的Ca2+、Mg2+形成氟化物沉淀。若沉淀后上层清液中c(F-)=0.05mol·L-1,则
 =
=(3)制备MnCO3。在搅拌下向100mL1mol·L-1MnSO4溶液中缓慢滴加1mol·L-1NH4HCO3溶液,过滤、洗涤、干燥,得到MnCO3固体。需加入NH4HCO3溶液的体积约为
(4)制备MnO2。MnCO3经热解、酸浸等步骤可制备MnO2。MnCO3在空气气流中热解得到三种价态锰的氧化物,锰元素所占比例(
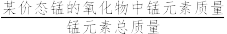 ×100%)随热解温度变化的曲线如图2所示。已知:MnO与酸反应生成Mn2+;Mn2O3氧化性强于Cl2,加热条件下Mn2O3在酸性溶液中转化为MnO2和Mn2+。
×100%)随热解温度变化的曲线如图2所示。已知:MnO与酸反应生成Mn2+;Mn2O3氧化性强于Cl2,加热条件下Mn2O3在酸性溶液中转化为MnO2和Mn2+。
为获得较高产率的MnO2,请补充实验方案:取一定量MnCO3置于热解装置中,通空气气流,
您最近一年使用:0次
2022-01-04更新
|
6645次组卷
|
7卷引用:2021年新高考江苏化学高考真题
2021年新高考江苏化学高考真题(已下线)黄金卷3-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(江苏卷)江苏省盐城市阜宁中学2021-2022学年高三下学期第三次综合测试化学试题(已下线)押江苏卷第17题 化学实验综合题 -备战2022年高考化学临考题号押题(江苏卷)(已下线)易错点34 化学实验方案的设计与评价-备战2023年高考化学考试易错题(已下线)专题19 实验综合题(已下线)专题19 实验综合题
5 . 硫化钠( )是一种重要的化工原料,生产方法有:硫化氢(
)是一种重要的化工原料,生产方法有:硫化氢( )吸收法,该方法是用NaOH溶液或
)吸收法,该方法是用NaOH溶液或 溶液吸收
溶液吸收 ,已知酸性:
,已知酸性: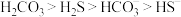 ;下列化学反应表示正确的是
;下列化学反应表示正确的是
 )是一种重要的化工原料,生产方法有:硫化氢(
)是一种重要的化工原料,生产方法有:硫化氢( )吸收法,该方法是用NaOH溶液或
)吸收法,该方法是用NaOH溶液或 溶液吸收
溶液吸收 ,已知酸性:
,已知酸性: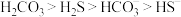 ;下列化学反应表示正确的是
;下列化学反应表示正确的是A. 溶液呈碱性: 溶液呈碱性: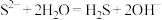 |
B. 与NaOH溶液反应: 与NaOH溶液反应: |
C. 与 与 溶液反应: 溶液反应: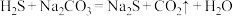 |
D.用足量炭还原硫酸钡制取硫化钡: |
您最近一年使用:0次
2022-11-11更新
|
199次组卷
|
3卷引用:江苏省连云港市2022-2023学年高三上学期期中调研考试化学试题
名校
解题方法
6 . Ⅰ:为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的焓变,并采取相应措施。化学反应的焓变通常用实验进行测定,也可进行理论推算。
(1)实验测得,1 g甲醇在氧气中充分燃烧生成二氧化碳和液态水释放出22.7 kJ的热量,试写出甲醇燃烧的热化学方程式___________ 。
(2)已知反应CH3—CH3(g) → CH2=CH2(g)+H2(g),有关化学键的键能如下。
试计算该反应的反应热___________ 。
Ⅱ:某二元酸(化学式用H2A表示)在水中的电离方程式是:H2A=H++HA-,HA- H++A2-
H++A2-
回答下列问题:
(1)Na2A溶液显___________ (填“酸性”“中性”或“碱性”),用离子方程式表示其原因___________ 。
(2)在0.1 mol·L-1的Na2A溶液中,下列微粒浓度关系式正确的是___________ 。
A.c(A2-)+c(HA-)+c(H2A)=0.1 mol·L-1
B.c(OH-)=c(H+)+c(HA-)+2c(H2A)
C.c(Na+)+c(H+)=c(OH-)+c(HA-)+2c(A2-)
D.c(Na+)>c(A2-)>c(HA-)>c(OH-)>c(H+)
(3)常温下,已知0.1 mol·L-1NaHA溶液的pH=2,则0.1 mol·L-1H2A溶液中c(H+)可能___________ (填“>”、“<”或“=”)0.11 mol·L-1;理由是___________ 。
(4)比较①0.1 mol·L-1 Na2A溶液 ②0.1 mol·L-1 Na2SO4溶液,两种溶液中阴离子总浓度的大小①___________ ②(填“>”、“<”或“=”)。
(1)实验测得,1 g甲醇在氧气中充分燃烧生成二氧化碳和液态水释放出22.7 kJ的热量,试写出甲醇燃烧的热化学方程式
(2)已知反应CH3—CH3(g) → CH2=CH2(g)+H2(g),有关化学键的键能如下。
| 化学键 | C—H | C=C | C—C | H—H |
| 键能/kJ·mol-1 | 414.4 | 615.3 | 347.4 | 435.3 |
试计算该反应的反应热
Ⅱ:某二元酸(化学式用H2A表示)在水中的电离方程式是:H2A=H++HA-,HA-
 H++A2-
H++A2-回答下列问题:
(1)Na2A溶液显
(2)在0.1 mol·L-1的Na2A溶液中,下列微粒浓度关系式正确的是
A.c(A2-)+c(HA-)+c(H2A)=0.1 mol·L-1
B.c(OH-)=c(H+)+c(HA-)+2c(H2A)
C.c(Na+)+c(H+)=c(OH-)+c(HA-)+2c(A2-)
D.c(Na+)>c(A2-)>c(HA-)>c(OH-)>c(H+)
(3)常温下,已知0.1 mol·L-1NaHA溶液的pH=2,则0.1 mol·L-1H2A溶液中c(H+)可能
(4)比较①0.1 mol·L-1 Na2A溶液 ②0.1 mol·L-1 Na2SO4溶液,两种溶液中阴离子总浓度的大小①
您最近一年使用:0次
解题方法
7 . 工业废水中常含有酚类、重金属、氰类、三氯甲烷及砷类等有害物质,必须处理后才可排放。
(1)处理废水时常需加入混凝剂,如明矾、PAN 等。
①写出明矾中Al3+水解的离子方程式___________ 。
②PAN化学式为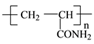 ,其单体的结构简式为
,其单体的结构简式为___________ 。
(2)处理高浓度的含酚废水的方法之一是萃取回收法,其流程如下:
①该流程中涉及分液操作___________ 次(填数字)。
②“操作Z”中发生反应的化学方程式为___________ 。
(3)用FeS除去废水中汞盐的反应为Hg2++FeS HgS + Fe2+,该反应的平衡常数为K=
HgS + Fe2+,该反应的平衡常数为K=____________ [填数值,已知:Ksp(FeS)=6.4×10-15,Ksp(HgS)=1.6×10-52]。
(4)处理含CN-废水有惰性电极电解法、NaClO氧化法等。
已知:HCN的Ka=6.3×10-10,沸点为25.7℃,有剧毒。
①电解前需将废水的pH调至10~11,其目的是___________ 。
②惰性电极电解时,CN-在阳极最终氧化为CO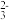 、CO2和N2。则1mol CN-在阳极被完全氧化,同时在阴极上产生H2的物质的量为
、CO2和N2。则1mol CN-在阳极被完全氧化,同时在阴极上产生H2的物质的量为___________ (不考虑副反应)。
③电解后期需在废水中加入食盐继续电解,加食盐除可提高电流效率外,还因为___________ 。
(5)纳米零价铁除去酸性废水中的三氯乙烯、五价砷的原理如下图所示:
纳米零价铁中Fe为负极, C2HCl3在其表面被还原的电极反应式为___________ ;在含高浓度SO 的酸性溶液中脱除砷的化学方程式为
的酸性溶液中脱除砷的化学方程式为___________ 。
(1)处理废水时常需加入混凝剂,如明矾、PAN 等。
①写出明矾中Al3+水解的离子方程式
②PAN化学式为
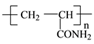 ,其单体的结构简式为
,其单体的结构简式为(2)处理高浓度的含酚废水的方法之一是萃取回收法,其流程如下:
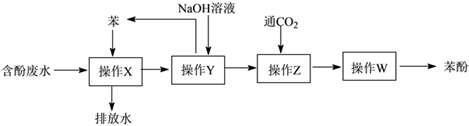
①该流程中涉及分液操作
②“操作Z”中发生反应的化学方程式为
(3)用FeS除去废水中汞盐的反应为Hg2++FeS
 HgS + Fe2+,该反应的平衡常数为K=
HgS + Fe2+,该反应的平衡常数为K=(4)处理含CN-废水有惰性电极电解法、NaClO氧化法等。
已知:HCN的Ka=6.3×10-10,沸点为25.7℃,有剧毒。
①电解前需将废水的pH调至10~11,其目的是
②惰性电极电解时,CN-在阳极最终氧化为CO
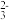 、CO2和N2。则1mol CN-在阳极被完全氧化,同时在阴极上产生H2的物质的量为
、CO2和N2。则1mol CN-在阳极被完全氧化,同时在阴极上产生H2的物质的量为③电解后期需在废水中加入食盐继续电解,加食盐除可提高电流效率外,还因为
(5)纳米零价铁除去酸性废水中的三氯乙烯、五价砷的原理如下图所示:
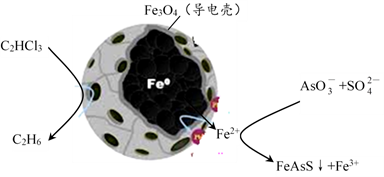
纳米零价铁中Fe为负极, C2HCl3在其表面被还原的电极反应式为
 的酸性溶液中脱除砷的化学方程式为
的酸性溶液中脱除砷的化学方程式为
您最近一年使用:0次



