1 . 为了探究温度对水解平衡的影响,用手持技术测定一定浓度 溶液的pH随温度变化的关系如图所示,下列说法不正确的是
溶液的pH随温度变化的关系如图所示,下列说法不正确的是
 溶液的pH随温度变化的关系如图所示,下列说法不正确的是
溶液的pH随温度变化的关系如图所示,下列说法不正确的是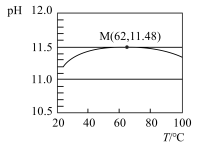
| A.该实验能证明升温促进水解 | B.点M之后 水解放热 水解放热 |
C.点M处溶液中 略大于 略大于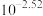 mol/L mol/L | D.点M后pH下降是因为升温对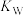 的影响更大 的影响更大 |
您最近一年使用:0次
名校
2 . (I)常温下,有四种溶液:①0.1 mol·L-1 CH3COOH溶液 ②0.1 mol·L-1 CH3COONa溶液 ③0.1 mol·L-1 NaHSO3溶液 ④0.1 mol·L-1 NaHCO3溶液
(1)溶液②呈___________ (填“酸”“碱”或“中”)性。其原因___________ (用离子方程式说明)。
(2)下列有关①和②两种溶液的说法正确的是___________ (填字母)。
a.两种溶液中c(CH3COO-)都等于0.1 mol·L-1
b.两种溶液中c(CH3COO-)都小于0.1 mol·L-1
c.CH3COOH溶液中c(CH3COO-)小于CH3COONa溶液中c(CH3COO-)
(3)Na2S2O5溶于水即生成NaHSO3。证明NaHSO3中HSO 的电离程度大于水解程度,可采用的实验方法是
的电离程度大于水解程度,可采用的实验方法是___________ (填字母)。
a.测定溶液的pH b.加入Ba(OH)2溶液 c.加入盐酸 d.加入品红溶液 e.用蓝色石蕊试纸检测
(II)已知25 ℃时弱电解质的电离平衡常数:Ka(CH3COOH)=1.8×10-5,Ka(HSCN)=0.13。使20 mL 0.10 mol·L-1的CH3COOH溶液和20 mL 0.10 mol·L-1的HSCN溶液分别与20 mL 0.10 mol·L-1的NaHCO3溶液反应。
(4)反应结束后,所得溶液中c(SCN-)___________ (填“>”“=”或“<”)c(CH3COO-)。
(5)现有2.0×10-3 mol·L-1的氢氟酸溶液,调节溶液pH(忽略调节时体积变化),测得25 ℃时平衡体系中c(F-)、c(HF)与溶液pH的关系如图所示:
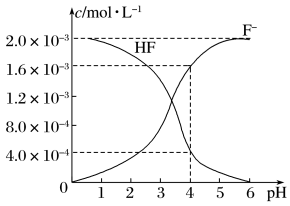
25 ℃时,HF的电离平衡常数Ka(HF)=___________ 。
(6)已知:25 ℃时,HCOOH的电离平衡常数K=1.77×10-4,H2CO3的电离平衡常数K1=4.4×10-7,K2=4.7×10-11。下列说法正确的是___________(填字母)。
(1)溶液②呈
(2)下列有关①和②两种溶液的说法正确的是
a.两种溶液中c(CH3COO-)都等于0.1 mol·L-1
b.两种溶液中c(CH3COO-)都小于0.1 mol·L-1
c.CH3COOH溶液中c(CH3COO-)小于CH3COONa溶液中c(CH3COO-)
(3)Na2S2O5溶于水即生成NaHSO3。证明NaHSO3中HSO
 的电离程度大于水解程度,可采用的实验方法是
的电离程度大于水解程度,可采用的实验方法是a.测定溶液的pH b.加入Ba(OH)2溶液 c.加入盐酸 d.加入品红溶液 e.用蓝色石蕊试纸检测
(II)已知25 ℃时弱电解质的电离平衡常数:Ka(CH3COOH)=1.8×10-5,Ka(HSCN)=0.13。使20 mL 0.10 mol·L-1的CH3COOH溶液和20 mL 0.10 mol·L-1的HSCN溶液分别与20 mL 0.10 mol·L-1的NaHCO3溶液反应。
(4)反应结束后,所得溶液中c(SCN-)
(5)现有2.0×10-3 mol·L-1的氢氟酸溶液,调节溶液pH(忽略调节时体积变化),测得25 ℃时平衡体系中c(F-)、c(HF)与溶液pH的关系如图所示:

25 ℃时,HF的电离平衡常数Ka(HF)=
(6)已知:25 ℃时,HCOOH的电离平衡常数K=1.77×10-4,H2CO3的电离平衡常数K1=4.4×10-7,K2=4.7×10-11。下列说法正确的是___________(填字母)。
| A.向Na2CO3溶液中加入甲酸溶液无明显现象产生 |
| B.25 ℃时,向甲酸溶液中加入NaOH溶液,甲酸的电离程度和K均增大 |
C.向0.1 mol·L-1甲酸溶液中加入蒸馏水, 增大 增大 |
D.向碳酸中加入NaHCO3固体,溶液的pH、溶液中c(HCO )均增大 )均增大 |
您最近一年使用:0次
3 . 下列实验操作、现象及结论均正确的是
实验操作 | 现象 | 结论 | |
A | 用石墨电极电解等浓度的 | 阴极开始会析出红色固体物质 | 金属活动性: |
B | 向2mL | 溶液变为血红色 | 能证明 |
C | 向盛有2mL | 先产生白色沉淀,后沉淀变为黄色 |
|
D | 常温下,用 |
|
|
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
4 . 某小组学习了盐类水解,对 溶液与
溶液与 溶液的反应产生了兴趣,进行如下探究。
溶液的反应产生了兴趣,进行如下探究。
(1)理论预测
甲同学认为两溶液的水解平衡相互促进并完全水解,实验中会观察到___________ 并闻到臭鸡蛋气味;
乙同学认为会发生氧化还原反应,并预测了还原产物为___________ (填化学式)。
(2)实验探究
已知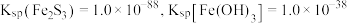 。
。
①实验中生成黑色沉淀 的反应类型是
的反应类型是___________ ; 溶解生成的黄色固体为
溶解生成的黄色固体为___________ 。
②实验中首先观察到黑色沉淀出现,可能的原因是___________ ; 溶液滴加至一定量时,
溶液滴加至一定量时, 溶解的原因是
溶解的原因是___________ 。
③针对实验过程中未观察到红褐色沉淀,甲同学认为可能是产生的量比较少,被黑色所遮盖。乙同学根据 数据分析,认为就算产生红褐色沉淀,也会转化为黑色沉淀,写出沉淀转化的离子方程式
数据分析,认为就算产生红褐色沉淀,也会转化为黑色沉淀,写出沉淀转化的离子方程式___________ 。
④丙同学设计实验证明③中乙同学的猜想,方案是:向洁净试管中加入新制并洗净的 沉淀,若
沉淀,若___________ (填实验操作及现象)则证明猜想正确。
 溶液与
溶液与 溶液的反应产生了兴趣,进行如下探究。
溶液的反应产生了兴趣,进行如下探究。(1)理论预测
甲同学认为两溶液的水解平衡相互促进并完全水解,实验中会观察到
乙同学认为会发生氧化还原反应,并预测了还原产物为
(2)实验探究
| 实验操作 | 实验现象 |
向稀的 溶液中逐滴加入 溶液中逐滴加入 稀溶液,直至过量 稀溶液,直至过量 | 立即产生黑色沉淀并逐渐增加, 溶液过量后黑色沉淀部分溶解,观察到黄褐色浑浊 溶液过量后黑色沉淀部分溶解,观察到黄褐色浑浊 |
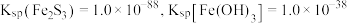 。
。①实验中生成黑色沉淀
 的反应类型是
的反应类型是 溶解生成的黄色固体为
溶解生成的黄色固体为②实验中首先观察到黑色沉淀出现,可能的原因是
 溶液滴加至一定量时,
溶液滴加至一定量时, 溶解的原因是
溶解的原因是③针对实验过程中未观察到红褐色沉淀,甲同学认为可能是产生的量比较少,被黑色所遮盖。乙同学根据
 数据分析,认为就算产生红褐色沉淀,也会转化为黑色沉淀,写出沉淀转化的离子方程式
数据分析,认为就算产生红褐色沉淀,也会转化为黑色沉淀,写出沉淀转化的离子方程式④丙同学设计实验证明③中乙同学的猜想,方案是:向洁净试管中加入新制并洗净的
 沉淀,若
沉淀,若
您最近一年使用:0次
名校
解题方法
5 . 某班同学用如下实验探究 、
、 的性质。回答下列问题:
的性质。回答下列问题:
(1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1 mol⋅L 的溶液。在
的溶液。在 溶液中需加入少量铁屑,其目的是
溶液中需加入少量铁屑,其目的是___________ 。
(2)甲组同学取2 mL 溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明
溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明 可将
可将 氧化。
氧化。 溶液与氯水反应的离子方程式为
溶液与氯水反应的离子方程式为___________ 。
(3)乙组同学认为甲组的实验不够严谨,该组同学在2 mL 溶液中先加入0.5 mL煤油,再于液面下依次加入几滴氯水和1滴KSCN溶液,溶液变红,煤油的作用是
溶液中先加入0.5 mL煤油,再于液面下依次加入几滴氯水和1滴KSCN溶液,溶液变红,煤油的作用是___________ 。
(4)丙组同学取10 mL 0.1 mol⋅L KI溶液,加入6 mL 0.1 mol⋅L
KI溶液,加入6 mL 0.1 mol⋅L
 溶液混合。分别取2 mL此溶液于3支试管中进行如下实验:
溶液混合。分别取2 mL此溶液于3支试管中进行如下实验:
①第一支试管中加入1 mL 充分振荡、静置,
充分振荡、静置, 层显紫色:
层显紫色:
②第二支试管中加入1滴 溶液,生成蓝色沉淀;
溶液,生成蓝色沉淀;
③第三支试管中加入1滴KSCN溶液,溶液变红。
实验②生成蓝色沉淀的离子方程式___________ ;
实验①和③说明:在 过量的情况下,溶液中仍含有
过量的情况下,溶液中仍含有___________ (填离子符号),由此可以证明该氧化还原反应的离子方程式为___________ 。
(5)丁组同学向盛有 溶液的试管中加入几滴酸化的
溶液的试管中加入几滴酸化的 溶液,溶液变成棕黄色,发生反应的离子方程式为
溶液,溶液变成棕黄色,发生反应的离子方程式为___________ ;一段时间后,溶液中有气泡出现,并放热,随后有红褐色沉淀生成,产生气泡的原因是___________ ,生成沉淀的原因是___________ (用平衡移动原理解释)。
 、
、 的性质。回答下列问题:
的性质。回答下列问题:(1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1 mol⋅L
 的溶液。在
的溶液。在 溶液中需加入少量铁屑,其目的是
溶液中需加入少量铁屑,其目的是(2)甲组同学取2 mL
 溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明
溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明 可将
可将 氧化。
氧化。 溶液与氯水反应的离子方程式为
溶液与氯水反应的离子方程式为(3)乙组同学认为甲组的实验不够严谨,该组同学在2 mL
 溶液中先加入0.5 mL煤油,再于液面下依次加入几滴氯水和1滴KSCN溶液,溶液变红,煤油的作用是
溶液中先加入0.5 mL煤油,再于液面下依次加入几滴氯水和1滴KSCN溶液,溶液变红,煤油的作用是(4)丙组同学取10 mL 0.1 mol⋅L
 KI溶液,加入6 mL 0.1 mol⋅L
KI溶液,加入6 mL 0.1 mol⋅L
 溶液混合。分别取2 mL此溶液于3支试管中进行如下实验:
溶液混合。分别取2 mL此溶液于3支试管中进行如下实验:①第一支试管中加入1 mL
 充分振荡、静置,
充分振荡、静置, 层显紫色:
层显紫色:②第二支试管中加入1滴
 溶液,生成蓝色沉淀;
溶液,生成蓝色沉淀;③第三支试管中加入1滴KSCN溶液,溶液变红。
实验②生成蓝色沉淀的离子方程式
实验①和③说明:在
 过量的情况下,溶液中仍含有
过量的情况下,溶液中仍含有(5)丁组同学向盛有
 溶液的试管中加入几滴酸化的
溶液的试管中加入几滴酸化的 溶液,溶液变成棕黄色,发生反应的离子方程式为
溶液,溶液变成棕黄色,发生反应的离子方程式为
您最近一年使用:0次
22-23高二下·四川·期中
名校
6 . 下列实验能达到预期目的是
| 编号 | 实验内容 | 实验目的 |
| A | 等 等体积 等体积 和 和 分别与 分别与 溶液反应, 溶液反应, 消耗的 消耗的 溶液体积多 溶液体积多 | 证明 是强酸 是强酸 |
| B | 分别测定室温下等物质的量浓度的 与 与 溶液的 溶液的 ,后者较大 ,后者较大 | 证明非金属性: |
| C | 向含有酚酞的 溶液中加入少量 溶液中加入少量 固体,溶液红色变浅 固体,溶液红色变浅 | 证明 溶液中存在水解平衡 溶液中存在水解平衡 |
| D | 向 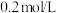  溶液中滴2滴 溶液中滴2滴  溶液,产生白色沉淀后再滴加2滴 溶液,产生白色沉淀后再滴加2滴  又生成红褐色沉淀 又生成红褐色沉淀 | 证明相同温度下 : : |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
解题方法
7 . 下列实验操作规范且能达到实验目的的是
| 选项 | 实验目的 | 操作 |
| A | 检验蔗糖水解生成葡萄糖 | 取适量蔗糖溶于盛有蒸馏水的试管中,滴入稀硫酸水浴加热5min后取少量溶液,滴入新制氢氧化铜悬浊液,加热至沸腾,观察有无砖红色沉 |
| B | 需要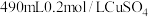 溶液 溶液 | 将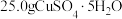 溶于蒸馏水,再配成500mL溶液 溶于蒸馏水,再配成500mL溶液 |
| C | 证明 的酸性强于 的酸性强于 | 用pH试纸分别测量物质的量浓度相等的 和NaClO溶液的pH 和NaClO溶液的pH |
| D | 验证 和 和 的 的 大小 大小 | 取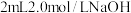 溶液,先滴3滴 溶液,先滴3滴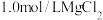 溶液,再滴3滴 溶液,再滴3滴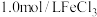 溶液 溶液 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
8 . 室温下,下列实验能达到实验目的是
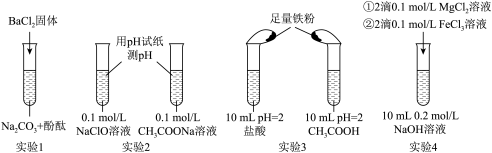

A.实验1 证明 溶液中存在水解平衡 溶液中存在水解平衡 |
B.实验2 比较HClO和 的酸性强弱 的酸性强弱 |
| C.实验3 不能证明盐酸酸性比醋酸强 |
D.实验4 证明在相同温度下 : :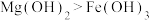 |
您最近一年使用:0次
2023-02-16更新
|
220次组卷
|
3卷引用:四川省成都外国语学校2022-2023学年高二下学期3月月考化学试题
名校
解题方法
9 . 下列实验能达到预期目的是
A.向含有酚酞的 溶液中加入少量 溶液中加入少量 固体,溶液红色变浅,证明 固体,溶液红色变浅,证明 溶液中存在水解平衡 溶液中存在水解平衡 |
B.室温下,用pH试纸测定浓度为0.1mol/LNaClO溶液和 溶液的pH,比较HClO和 溶液的pH,比较HClO和 的酸性强弱 的酸性强弱 |
C.等体积 的HX和HY两种酸分别与足量的锌粒反应,排水法收集气体,HX反应结束后放出的氢气多且反应过程中反应速率快,证明HX酸性比HY强 的HX和HY两种酸分别与足量的锌粒反应,排水法收集气体,HX反应结束后放出的氢气多且反应过程中反应速率快,证明HX酸性比HY强 |
D.向10mL0.2mol/LNaOH溶液中滴加2滴 溶液,产生白色沉淀后,再滴加2滴 溶液,产生白色沉淀后,再滴加2滴 溶液,又生成红褐色沉淀,证明在相同温度下Ksp: 溶液,又生成红褐色沉淀,证明在相同温度下Ksp: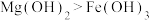 |
您最近一年使用:0次
2023-06-21更新
|
132次组卷
|
16卷引用:四川省遂宁市射洪中学校2023-2024学年高二上学期(强基班)11月月考化学试题
四川省遂宁市射洪中学校2023-2024学年高二上学期(强基班)11月月考化学试题山西省长治市第二中学2019-2020学年高二上学期第一次月考化学试题鲁科版(2019)选择性必修1 模块综合测评人教版(2019)高二选择性必修第一册 模块综合测评广东省梅州市2021-2022学年高二上学期期末考试化学试题河南省南乐县第一高级中学2021-2022学年高二下学期3月月考化学试题江苏省泰州中学2021-2022学年高二下学期期中考试化学试题湖南省吉首市泸溪一中2022届高三第三次联合检测化学试题河南省安阳市第一中学2020-2021学年高二上学期期末考试化学试题湖南省长沙市南雅中学2022-2023学年高二上学期第三次月考化学试题江苏省南通市海安李堡中学2021-2022学年高二上学期期中考试化学试题宁夏回族自治区银川一中2022-2023学年高二上学期期末考试化学试题江苏省徐州市沛县2022-2023学年高二下学期5月月考化学试题广西南宁市2022-2023学年高二下学期开学考试化学试题新疆石河子第一中学2023-2024学年高二上学期12月月考化学试题安徽省合肥市第一中学2023-2024学年高二上学期12月月考化学试题
名校
10 . 下列实验过程可以达到实验目的的是
实验目的 | 实验过程 | |
| A | 根据褪色时间来研究浓度对反应速率的影响 | 往2支试管中分别加入同体积、等浓度的草酸溶液,再分别加入同体积、不同浓度的KMnO4溶液 |
| B | 比较HClO和CH3COOH酸性的强弱 | 常温下,用pH计分别测定等物质的量浓度的NaClO溶液和CH3COONa溶液的pH |
| C | 证明HA是弱酸 | 等体积、浓度均为0.1mol/L的HA和HB两种酸分别与足量Zn反应,HA放出的H2多 |
| D | 制备Al2O3固体 | 将NaAlO2溶液蒸干并灼烧 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次

 混合溶液
混合溶液

 溶液充分反应,取少量混合液滴加
溶液充分反应,取少量混合液滴加 溶液
溶液 溶液的试管中滴加2滴
溶液的试管中滴加2滴 溶液,振荡后再滴加4滴
溶液,振荡后再滴加4滴
 溶液的
溶液的 酸性强于
酸性强于


