1 . 为了探究温度对水解平衡的影响,用手持技术测定一定浓度 溶液的pH随温度变化的关系如图所示,下列说法不正确的是
溶液的pH随温度变化的关系如图所示,下列说法不正确的是
 溶液的pH随温度变化的关系如图所示,下列说法不正确的是
溶液的pH随温度变化的关系如图所示,下列说法不正确的是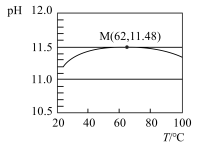
| A.该实验能证明升温促进水解 | B.点M之后 水解放热 水解放热 |
C.点M处溶液中 略大于 略大于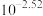 mol/L mol/L | D.点M后pH下降是因为升温对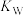 的影响更大 的影响更大 |
您最近一年使用:0次
名校
2 .  遇水极易发生水解。某化学兴趣小组设计实验制备
遇水极易发生水解。某化学兴趣小组设计实验制备 并探究其性质。
并探究其性质。
Ⅰ.氯化铁的制备:
(1)图1为湿法制备的装置,仪器A的名称为___________ ,烧杯中发生反应的离子方程式为___________ 。

(2)图2为干法制备的装置。反应前后都要鼓入氮气,目的是___________ 。
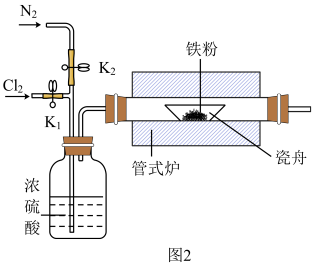
Ⅱ.氯化铁的性质探究:
(3)查阅资料:氯化铁在水溶液中分多步水解,生成净水性能更好的聚合氯化铁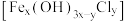 。写出氯化铁水解生成聚合氯化铁的总化学方程式
。写出氯化铁水解生成聚合氯化铁的总化学方程式___________ 。
(4)为了探究外界条件对氯化铁水解平衡的影响,该兴趣小组设计实验方案(忽略溶液体积的变化, 的浓度为1mol/L),获得以下数据:
的浓度为1mol/L),获得以下数据:
①实验1和实验2说明 的水解是
的水解是___________ (填“吸热”或“放热”)反应。
②由实验1和3可知,稀释 溶液,
溶液, 水解平衡
水解平衡___________ (填“正”或“逆”)向移动;结合表中数据,给出判断理由:___________ 。
③查阅资料,加入强电解质后,由于溶液中离子总浓度增大,离子间的相互牵制作用增强,水解离子的活性会改变。该兴趣小组同学求助老师,利用计算机手持技术得到实验4和实验5的结果分别如图3和图4所示。
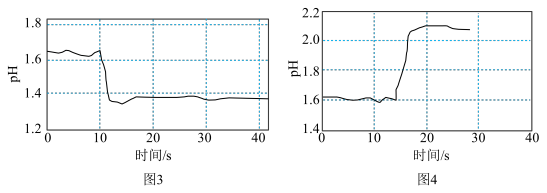
ⅰ.根据上述实验数据和结果,下列说法不正确的是___________ (填标号)。
A.实验过程中量取 溶液时应选用酸式滴定管
溶液时应选用酸式滴定管
B.实验4和实验5中a与b的关系式为
C.根据图3与图4结果可知,离子的水解活性强弱还受离子种类的影响
ⅱ.有同学猜想图3结果是因为氯离子促进了 的水解,请你设计其他简单实验证明该猜想成立:
的水解,请你设计其他简单实验证明该猜想成立:___________ (写出实验操作、现象或结果)。
 遇水极易发生水解。某化学兴趣小组设计实验制备
遇水极易发生水解。某化学兴趣小组设计实验制备 并探究其性质。
并探究其性质。Ⅰ.氯化铁的制备:
(1)图1为湿法制备的装置,仪器A的名称为

(2)图2为干法制备的装置。反应前后都要鼓入氮气,目的是

Ⅱ.氯化铁的性质探究:
(3)查阅资料:氯化铁在水溶液中分多步水解,生成净水性能更好的聚合氯化铁
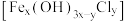 。写出氯化铁水解生成聚合氯化铁的总化学方程式
。写出氯化铁水解生成聚合氯化铁的总化学方程式(4)为了探究外界条件对氯化铁水解平衡的影响,该兴趣小组设计实验方案(忽略溶液体积的变化,
 的浓度为1mol/L),获得以下数据:
的浓度为1mol/L),获得以下数据:| 实验 | 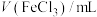 | 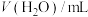 | n(NaCl)/mol | 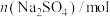 | 温度/℃ | pH |
| 1 | 10.00 | 90.00 | 0 | 0 | 25 | 1.62 |
| 2 | 10.00 | 90.00 | 0 | 0 | 35 | 1.47 |
| 3 | 10.00 | 0 | 0 | 0 | 25 | 0.74 |
| 4 | 10.00 | 90.00 | a | 0 | 25 | x |
| 5 | 10.00 | 90.00 | 0 | b | 25 | y |
 的水解是
的水解是②由实验1和3可知,稀释
 溶液,
溶液, 水解平衡
水解平衡③查阅资料,加入强电解质后,由于溶液中离子总浓度增大,离子间的相互牵制作用增强,水解离子的活性会改变。该兴趣小组同学求助老师,利用计算机手持技术得到实验4和实验5的结果分别如图3和图4所示。

ⅰ.根据上述实验数据和结果,下列说法不正确的是
A.实验过程中量取
 溶液时应选用酸式滴定管
溶液时应选用酸式滴定管B.实验4和实验5中a与b的关系式为

C.根据图3与图4结果可知,离子的水解活性强弱还受离子种类的影响
ⅱ.有同学猜想图3结果是因为氯离子促进了
 的水解,请你设计其他简单实验证明该猜想成立:
的水解,请你设计其他简单实验证明该猜想成立:
您最近一年使用:0次
2024-01-22更新
|
90次组卷
|
2卷引用:广东省深圳市南山区2023-2024学年高二上学期期末考试化学试题
名校
解题方法
3 . 盐碱地是土壤表层集聚过多盐碱成分,对农作物有害的土地。回答下列问题:
(1)盐碱地(含较多 、NaCl)不利于植物生长,盐碱地呈碱性的原因为
、NaCl)不利于植物生长,盐碱地呈碱性的原因为______ (用离子方程式说明);已知25℃时, 的
的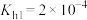 ,则当
,则当 溶液中
溶液中 时,溶液的
时,溶液的
______ 。
(2)已知:常温下,碳酸的电离平衡常数 ,
, 。常温下,向100 mL 0.1 mol⋅L
。常温下,向100 mL 0.1 mol⋅L
 溶液中缓慢滴加100 mL 0.2 mol⋅L
溶液中缓慢滴加100 mL 0.2 mol⋅L 盐酸,溶液中各离子的物质的量随加入盐酸的物质的量的变化如图所示(
盐酸,溶液中各离子的物质的量随加入盐酸的物质的量的变化如图所示( 和
和 未画出)。根据图回答下列问题:
未画出)。根据图回答下列问题:
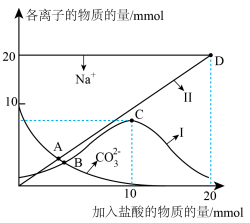
①曲线Ⅰ代表的离子是______ 。
②A、B两点水的电离程度大小为A______ B(填“<”“>”或“=”)。
③根据上图,下列有关说法不正确的是______ 。
a.滴加至B点时,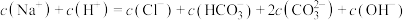
b.滴加至C点时,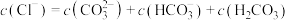
c.滴加至D点时,溶液
④下列事实中,能证明HCN是弱电解质的是______ 。
a.室温下NaCN溶液的
b.HCN溶液导电能力比盐酸弱
c.10 mL 0.1 mol/L的HCN溶液恰好与10 mL 0.1 mol/L的NaOH溶液完全反应
d.取 的HCN溶液,稀释10倍,稀释后
的HCN溶液,稀释10倍,稀释后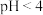
⑤已知HCN电离平衡常数约为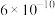 ,用一个离子方程式说明
,用一个离子方程式说明 和
和 结合
结合 能力的相对强弱
能力的相对强弱______ 。
(1)盐碱地(含较多
 、NaCl)不利于植物生长,盐碱地呈碱性的原因为
、NaCl)不利于植物生长,盐碱地呈碱性的原因为 的
的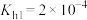 ,则当
,则当 溶液中
溶液中 时,溶液的
时,溶液的
(2)已知:常温下,碳酸的电离平衡常数
 ,
, 。常温下,向100 mL 0.1 mol⋅L
。常温下,向100 mL 0.1 mol⋅L
 溶液中缓慢滴加100 mL 0.2 mol⋅L
溶液中缓慢滴加100 mL 0.2 mol⋅L 盐酸,溶液中各离子的物质的量随加入盐酸的物质的量的变化如图所示(
盐酸,溶液中各离子的物质的量随加入盐酸的物质的量的变化如图所示( 和
和 未画出)。根据图回答下列问题:
未画出)。根据图回答下列问题:
①曲线Ⅰ代表的离子是
②A、B两点水的电离程度大小为A
③根据上图,下列有关说法不正确的是
a.滴加至B点时,
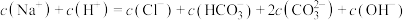
b.滴加至C点时,
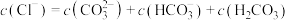
c.滴加至D点时,溶液

④下列事实中,能证明HCN是弱电解质的是
a.室温下NaCN溶液的

b.HCN溶液导电能力比盐酸弱
c.10 mL 0.1 mol/L的HCN溶液恰好与10 mL 0.1 mol/L的NaOH溶液完全反应
d.取
 的HCN溶液,稀释10倍,稀释后
的HCN溶液,稀释10倍,稀释后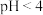
⑤已知HCN电离平衡常数约为
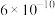 ,用一个离子方程式说明
,用一个离子方程式说明 和
和 结合
结合 能力的相对强弱
能力的相对强弱
您最近一年使用:0次
名校
4 . 下列有关电解质溶液的说法正确的是


A.某温度下, 溶液显中性,所以 溶液显中性,所以 不水解 不水解 |
B.在常温下稀释两种酸溶液时pH变化如图,其中HX为较弱酸,且a点与b点的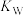 数值相同 数值相同 |
C.25℃时,等体积 的HA和HB两种酸溶液分别与足量的锌充分反应,HA溶液与Zn反应生成的氢气更多,HA是较弱酸 的HA和HB两种酸溶液分别与足量的锌充分反应,HA溶液与Zn反应生成的氢气更多,HA是较弱酸 |
D.常温下, 的HA溶液中由水电离出的 的HA溶液中由水电离出的 为 为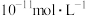 ,则能证明HA为弱酸 ,则能证明HA为弱酸 |
您最近一年使用:0次
名校
5 . 下列说法能证明HA是弱电解质的是
| A.往HA溶液中滴加甲基橙,溶液显红色 |
| B.常温下测得0.0lmol·L−1HA溶液的pH=2 |
| C.HA的导电性比醋酸弱 |
| D.常温下测得NaA溶液呈碱性 |
您最近一年使用:0次
名校
6 . 回答下列问题。
(1)下列物质的水溶液因水解而呈碱性的是___________。
(2)0.1mol•L﹣1的醋酸溶液中存在电离平衡:CH3COOH⇌CH3COO﹣+H+,要使溶液中 值增大,可以采取的措施是___________。
值增大,可以采取的措施是___________。
①加少量烧碱固体②升高温度③加少量冰醋酸④加水
(3)氢氰酸(HCN)的下列性质中,可以证明它是弱电解质的是___________。
(4)溶液的pH与水的电离密切相关,以下说法一定正确的是___________。
(5)室温下,在10mL浓度均为0.1mol•L﹣1的醋酸和盐酸混合液中,滴加0.1mol•L﹣1的NaOH溶液VmL,则下列关系正确的是___________。
(6)NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品;NH4HSO4在分析试剂、医药、电子工业中用途广泛。请回答下列问题:
①相同条件下,0.1mol•L﹣1NH4Al(SO4)2溶液中的c( )
)___________ (填“等于”“大于”或“小于”)0.1mol•L﹣1NH4HSO4溶液中的c( )。
)。
②浓度均为0.1mol•L﹣1的几种电解质溶液的pH随温度变化的曲线如图1所示:
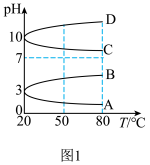
i.其中符合0.1mol•L﹣1NH4Al(SO4)2溶液的pH随温度变化的曲线是___________ ,导致pH随温度变化的原因是___________ 。
ii.20℃时,0.1mol•L﹣1NH4Al(SO4)2溶液中2c( )﹣c(
)﹣c( )﹣3c(A13+)=
)﹣3c(A13+)=___________ mol•L﹣1(填精确数值表达式)。
③室温时,向100mL0.1mol•L﹣1NH4HSO4溶液中滴加0.1mol•L﹣1NaOH溶液,溶液pH与NaOH溶液体积的关系如图2所示。试分析图中a、b、c、d四个点,水的电离程度最大的是___________ 点;在b点,溶液中各离子浓度由大到小的排列顺序是___________ 。

④难溶电解质在水溶液中存在溶解平衡。25℃,某NH4Al(SO4)2溶液里c(A13+)=0.1mol•L﹣1,使Al3+开始沉淀的pH为___________ 。[25℃时,Al(OH)3的Ksp=1×10﹣34]
⑤向AgNO3溶液中加入过量NaCl溶液,会有白色沉淀产生,接着加入NaI溶液,发现白色沉淀变为黄色,请用平衡移动原理来解释颜色变化与溶液中c(Cl﹣)升高的原因:___________ 。
(1)下列物质的水溶液因水解而呈碱性的是___________。
| A.Na2S | B.NH3 | C.KOH | D.NH4Cl |
(2)0.1mol•L﹣1的醋酸溶液中存在电离平衡:CH3COOH⇌CH3COO﹣+H+,要使溶液中
 值增大,可以采取的措施是___________。
值增大,可以采取的措施是___________。①加少量烧碱固体②升高温度③加少量冰醋酸④加水
| A.②③ | B.②④ | C.①④ | D.①③ |
(3)氢氰酸(HCN)的下列性质中,可以证明它是弱电解质的是___________。
| A.1mol•L﹣1氢氰酸(HCN)溶液的pH约为3 |
| B.HCN易溶于水 |
| C.10mL1mol•L﹣1HCN恰好与10mL1mol•L﹣1NaOH溶液完全反应 |
| D.HCN溶液的导电性比强酸溶液的弱 |
(4)溶液的pH与水的电离密切相关,以下说法一定正确的是___________。
| A.90℃的纯水pH=7 |
| B.将醋酸滴入氢氧化钠溶液,促进了水的电离 |
| C.电解质溶液中都存在水的电离平衡 |
| D.室温下pH相同的盐酸和明矾溶液,水的电离程度相同 |
(5)室温下,在10mL浓度均为0.1mol•L﹣1的醋酸和盐酸混合液中,滴加0.1mol•L﹣1的NaOH溶液VmL,则下列关系正确的是___________。
| A.V=0时:c(H+)>c(Cl﹣)=c(CH3COOH) |
| B.V=10mL时:c(OH﹣)+c(CH3COO﹣)=c(H+) |
| C.V=20mL时:c(Na+)<c(CH3COO﹣)+c(Cl﹣) |
| D.加入NaOH溶液至pH=7时,V>20mL |
(6)NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品;NH4HSO4在分析试剂、医药、电子工业中用途广泛。请回答下列问题:
①相同条件下,0.1mol•L﹣1NH4Al(SO4)2溶液中的c(
 )
) )。
)。②浓度均为0.1mol•L﹣1的几种电解质溶液的pH随温度变化的曲线如图1所示:

i.其中符合0.1mol•L﹣1NH4Al(SO4)2溶液的pH随温度变化的曲线是
ii.20℃时,0.1mol•L﹣1NH4Al(SO4)2溶液中2c(
 )﹣c(
)﹣c( )﹣3c(A13+)=
)﹣3c(A13+)=③室温时,向100mL0.1mol•L﹣1NH4HSO4溶液中滴加0.1mol•L﹣1NaOH溶液,溶液pH与NaOH溶液体积的关系如图2所示。试分析图中a、b、c、d四个点,水的电离程度最大的是

④难溶电解质在水溶液中存在溶解平衡。25℃,某NH4Al(SO4)2溶液里c(A13+)=0.1mol•L﹣1,使Al3+开始沉淀的pH为
⑤向AgNO3溶液中加入过量NaCl溶液,会有白色沉淀产生,接着加入NaI溶液,发现白色沉淀变为黄色,请用平衡移动原理来解释颜色变化与溶液中c(Cl﹣)升高的原因:
您最近一年使用:0次
解题方法
7 . 某小组为探究 溶解于
溶解于 溶液的反应机理,提出下列两种观点:
溶液的反应机理,提出下列两种观点:
观点一: 的水解导致
的水解导致 溶液呈酸性,
溶液呈酸性, 与
与 反应,从而促进了
反应,从而促进了 的沉淀溶解平衡
的沉淀溶解平衡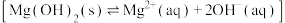 ]向溶解方向移动。
]向溶解方向移动。
观点二: 直接结合了
直接结合了 电离产生
电离产生 ,从而使得
,从而使得 的沉淀溶解平衡向溶解方向移动。
的沉淀溶解平衡向溶解方向移动。
资料:① 溶液呈中性;②
溶液呈中性;② 对该反应几乎无影响。
对该反应几乎无影响。
实验过程:各取 固体
固体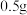 ,分别加入选取的实验试剂中。
,分别加入选取的实验试剂中。
(1)经检验,实验2中刺激性气味气体为 ,其具体方案为
,其具体方案为___________ 。
(2)甲同学对比实验1、2,认为实验2固体能溶解的原因是 溶液中
溶液中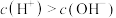 ,能与
,能与 反应。用化学用语解释
反应。用化学用语解释 溶液显酸性的原因
溶液显酸性的原因___________ 。
(3)乙同学通过实验3证明甲同学的说法不合理。
①X是___________ (填写溶质的化学式)。
②由实验3获取的证据为___________ 。
(4)为进一步探究实验2固体能溶解的原因,进行实验4.
乙依据上述实验,可以得出 能与
能与 直接反应。丙同学认为该方案不严谨,需要补充的实验方案是
直接反应。丙同学认为该方案不严谨,需要补充的实验方案是___________ 。
(5)由以上实验可以得出的结论是___________ 。
(6)为进一步分析 溶液浓度对沉淀溶解的实验效果,丁同学设计如下实验:
溶液浓度对沉淀溶解的实验效果,丁同学设计如下实验:
分析上述实验数据从平衡移动的角度解释上述现象___________ 。
 溶解于
溶解于 溶液的反应机理,提出下列两种观点:
溶液的反应机理,提出下列两种观点:观点一:
 的水解导致
的水解导致 溶液呈酸性,
溶液呈酸性, 与
与 反应,从而促进了
反应,从而促进了 的沉淀溶解平衡
的沉淀溶解平衡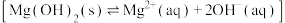 ]向溶解方向移动。
]向溶解方向移动。观点二:
 直接结合了
直接结合了 电离产生
电离产生 ,从而使得
,从而使得 的沉淀溶解平衡向溶解方向移动。
的沉淀溶解平衡向溶解方向移动。资料:①
 溶液呈中性;②
溶液呈中性;② 对该反应几乎无影响。
对该反应几乎无影响。实验过程:各取
 固体
固体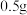 ,分别加入选取的实验试剂中。
,分别加入选取的实验试剂中。| 实验 | 实验试剂 | 实验现象 |
| 1 |  蒸馏水 蒸馏水 | 白色固体不溶解 |
| 2 | 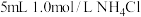 溶液 溶液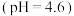 | 在微热下,产生刺激性气味气体且白色固体溶解 |
 ,其具体方案为
,其具体方案为(2)甲同学对比实验1、2,认为实验2固体能溶解的原因是
 溶液中
溶液中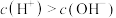 ,能与
,能与 反应。用化学用语解释
反应。用化学用语解释 溶液显酸性的原因
溶液显酸性的原因(3)乙同学通过实验3证明甲同学的说法不合理。
| 实验 | 实验试剂 | 实验现象 |
| 3 | 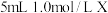 溶液 溶液 |
②由实验3获取的证据为
(4)为进一步探究实验2固体能溶解的原因,进行实验4.
| 实验 | 实验试剂 | 实验现象 |
| 4 | 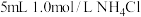 乙醇溶液 乙醇溶液 | 在微热下,白色固体溶解 |
 能与
能与 直接反应。丙同学认为该方案不严谨,需要补充的实验方案是
直接反应。丙同学认为该方案不严谨,需要补充的实验方案是(5)由以上实验可以得出的结论是
(6)为进一步分析
 溶液浓度对沉淀溶解的实验效果,丁同学设计如下实验:
溶液浓度对沉淀溶解的实验效果,丁同学设计如下实验: 溶液的浓度 溶液的浓度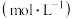 | 现象 |
| 0.05 | 白色浑浊, 后仍有部分不溶解 后仍有部分不溶解 |
| 0.07 | 少量白色浑浊, 左右完全溶解 左右完全溶解 |
| 0.10 | 振荡 后完全溶解 后完全溶解 |
| 0.15 | 振荡 后完全溶解 后完全溶解 |
| 0.20 | 振荡后迅速溶解 |
| 0.30 | 振荡后迅速溶解 |
您最近一年使用:0次
名校
8 . (I)常温下,有四种溶液:①0.1 mol·L-1 CH3COOH溶液 ②0.1 mol·L-1 CH3COONa溶液 ③0.1 mol·L-1 NaHSO3溶液 ④0.1 mol·L-1 NaHCO3溶液
(1)溶液②呈___________ (填“酸”“碱”或“中”)性。其原因___________ (用离子方程式说明)。
(2)下列有关①和②两种溶液的说法正确的是___________ (填字母)。
a.两种溶液中c(CH3COO-)都等于0.1 mol·L-1
b.两种溶液中c(CH3COO-)都小于0.1 mol·L-1
c.CH3COOH溶液中c(CH3COO-)小于CH3COONa溶液中c(CH3COO-)
(3)Na2S2O5溶于水即生成NaHSO3。证明NaHSO3中HSO 的电离程度大于水解程度,可采用的实验方法是
的电离程度大于水解程度,可采用的实验方法是___________ (填字母)。
a.测定溶液的pH b.加入Ba(OH)2溶液 c.加入盐酸 d.加入品红溶液 e.用蓝色石蕊试纸检测
(II)已知25 ℃时弱电解质的电离平衡常数:Ka(CH3COOH)=1.8×10-5,Ka(HSCN)=0.13。使20 mL 0.10 mol·L-1的CH3COOH溶液和20 mL 0.10 mol·L-1的HSCN溶液分别与20 mL 0.10 mol·L-1的NaHCO3溶液反应。
(4)反应结束后,所得溶液中c(SCN-)___________ (填“>”“=”或“<”)c(CH3COO-)。
(5)现有2.0×10-3 mol·L-1的氢氟酸溶液,调节溶液pH(忽略调节时体积变化),测得25 ℃时平衡体系中c(F-)、c(HF)与溶液pH的关系如图所示:
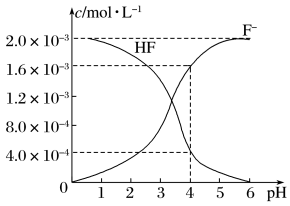
25 ℃时,HF的电离平衡常数Ka(HF)=___________ 。
(6)已知:25 ℃时,HCOOH的电离平衡常数K=1.77×10-4,H2CO3的电离平衡常数K1=4.4×10-7,K2=4.7×10-11。下列说法正确的是___________(填字母)。
(1)溶液②呈
(2)下列有关①和②两种溶液的说法正确的是
a.两种溶液中c(CH3COO-)都等于0.1 mol·L-1
b.两种溶液中c(CH3COO-)都小于0.1 mol·L-1
c.CH3COOH溶液中c(CH3COO-)小于CH3COONa溶液中c(CH3COO-)
(3)Na2S2O5溶于水即生成NaHSO3。证明NaHSO3中HSO
 的电离程度大于水解程度,可采用的实验方法是
的电离程度大于水解程度,可采用的实验方法是a.测定溶液的pH b.加入Ba(OH)2溶液 c.加入盐酸 d.加入品红溶液 e.用蓝色石蕊试纸检测
(II)已知25 ℃时弱电解质的电离平衡常数:Ka(CH3COOH)=1.8×10-5,Ka(HSCN)=0.13。使20 mL 0.10 mol·L-1的CH3COOH溶液和20 mL 0.10 mol·L-1的HSCN溶液分别与20 mL 0.10 mol·L-1的NaHCO3溶液反应。
(4)反应结束后,所得溶液中c(SCN-)
(5)现有2.0×10-3 mol·L-1的氢氟酸溶液,调节溶液pH(忽略调节时体积变化),测得25 ℃时平衡体系中c(F-)、c(HF)与溶液pH的关系如图所示:

25 ℃时,HF的电离平衡常数Ka(HF)=
(6)已知:25 ℃时,HCOOH的电离平衡常数K=1.77×10-4,H2CO3的电离平衡常数K1=4.4×10-7,K2=4.7×10-11。下列说法正确的是___________(填字母)。
| A.向Na2CO3溶液中加入甲酸溶液无明显现象产生 |
| B.25 ℃时,向甲酸溶液中加入NaOH溶液,甲酸的电离程度和K均增大 |
C.向0.1 mol·L-1甲酸溶液中加入蒸馏水, 增大 增大 |
D.向碳酸中加入NaHCO3固体,溶液的pH、溶液中c(HCO )均增大 )均增大 |
您最近一年使用:0次
名校
解题方法
9 . 室温下,通过下列实验探究NaHS溶液的性质。
实验1:向0.1 mol/L NaHS溶液中滴加几滴酚酞试剂,溶液变红
实验2:向0.1 mol/L NaHS溶液中通入过量氯气,无淡黄色沉淀产生
实验3:向0.1 mol/L NaHS溶液中加入等体积0.1 mol/L NaOH溶液充分混合
实验4:向0.1 mol/L NaHS溶液中滴加过量 溶液,产生黑色沉淀
溶液,产生黑色沉淀
下列有关说法正确的是
实验1:向0.1 mol/L NaHS溶液中滴加几滴酚酞试剂,溶液变红
实验2:向0.1 mol/L NaHS溶液中通入过量氯气,无淡黄色沉淀产生
实验3:向0.1 mol/L NaHS溶液中加入等体积0.1 mol/L NaOH溶液充分混合
实验4:向0.1 mol/L NaHS溶液中滴加过量
 溶液,产生黑色沉淀
溶液,产生黑色沉淀下列有关说法正确的是
A.实验1证明: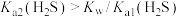 |
B.实验2证明: 不能被 不能被 氧化 氧化 |
C.实验3中所得溶液中: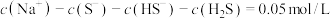 |
D.实验4反应静置后的上层清液中有 |
您最近一年使用:0次
2023-01-08更新
|
565次组卷
|
3卷引用:江苏省决胜新高考2023届高三上学期12月大联考化学试题
名校
10 . 下列说法不能证明醋酸(醋酸浓度约为0.1mol/L)为弱电解质的是
| A.醋酸钠的水溶液呈现碱性 | B.醋酸的电离平衡常数为1.75×10-5 |
| C.蛋壳浸泡在醋酸中有气体放出 | D.pH试纸显示醋酸的pH为2.3 |
您最近一年使用:0次
2023-09-08更新
|
93次组卷
|
2卷引用:安徽省芜湖市无为襄安中学2022-2023学年高二上学期12月月考化学试题



