10-11高二·吉林长春·阶段练习
名校
1 . 物质的量浓度相同的NaX、NaY和NaZ溶液,其pH依次为7、9、11,则HX、HY、HZ的酸性由强到弱的顺序是( )
| A.HX HY HZ | B.HX HZ HY | C.HZ HY HX | D.HY HZ HX |
您最近一年使用:0次
2020-01-02更新
|
200次组卷
|
38卷引用:2016-2017学年青海师大附中高二上期中化学试卷
2016-2017学年青海师大附中高二上期中化学试卷(已下线)2011-2012学年吉林省长春外国语学校高二第二次月考化学试卷(已下线)2011-2012学年内蒙古巴彦淖尔市中学高二期中考试化学试卷(已下线)2012-2013学年呼伦贝尔牙林一中高二上学期期中理科考试化学试卷(已下线)2012年鲁科版高中化学选修4 3.2弱电解质的电离、盐类的水练习卷(已下线)黑龙江省哈尔滨市第十二中学2012-2013学年高二上学期期末考试化学试卷(已下线)2012-2013学年四川省资阳市高二下学期期末检测化学试卷2014-2015辽宁省大连市高二上学期期末考试化学(理)试卷2014-2015浙江省杭州市西湖中学高二12月月考化学试卷2014-2015四川省重点中学高二下学期期中考试化学试卷2014-2015学年浙江省江山实验中学高二4月教学质量检测化学试卷2015-2016学年吉林省汪清中学高二上学期第二次月考化学试卷2015-2016学年贵州省凯里一中高二上学期期末化学试卷2015-2016学年广东省惠州市高二上学期期末理化学试卷2015-2016学年福建省长泰县第一中学高二上学期期末化学试卷2015-2016学年山西省孝义市高二上学期期末考试化学试卷2016-2017学年甘肃省武威二中高二上10月月考化学试卷2016-2017学年宁夏育才中学高二上月考二化学卷22016-2017学年天津市宝坻区高二11月联考化学试卷2016-2017学年黑龙江省鸡西市第十九中学高二上学期期末考试化学试卷黑龙江省齐齐哈尔市第八中学2017-2018学年高二12月月考化学试题河北省永年县第二中学2017-2018学年高二12月月考化学试题宁夏青铜峡市高级中学2017-2018学年高二上学期期末考试化学试题【全国省级联考】广东省蓝精灵中学2017-2018 学年度高二上学期期末联考化学试题黑龙江省哈尔滨师范大学青冈实验中学2017-2018学年高二上学期期中考试化学试题(已下线)2018年10月30日 《每日一题》人教选修4-盐溶液酸碱性的判断吉林省长春市九台区师范高级中学2018-2019学年高二上学期期中考试化学试题山东省微山县第二中学2018-2019学年高二上学期第三学段教学质量监测化学试题陕西省黄陵中学2018-2019学年高二(普通班)上学期期末考试化学试题【全国百强校】内蒙古杭锦后旗奋斗中学2018-2019学年高二下学期第一次月考化学试题福建省莆田市第二十五中学2018-2019学年高二下学期第一次月考化学试题步步为赢 高二化学暑假作业:作业十 水溶液中的离子平衡云南省峨山彝族自治县第一中学2018-2019学年高二6月月考化学试题宁夏吴忠中学2019-2020学年高二上学期期中考试化学试题重庆市云阳县2019-2020学年高二上学期期中考试化学试题吉林省普通高中联合体2018-2019学年高二下学期期末联考化学试题江西省上饶中学2019-2020学年高二上学期期中考试(零班、培优班)化学试题北京市昌平区新学道临川学校2019-2020学年高二上学期期末考试化学试题
名校
2 . 下列有关盐类水解的说法中,不正确的是
| A.盐类的水解过程破坏了纯水的电离平衡 | B.盐类的水解是酸碱中和反应的逆反应 |
| C.溶液中c(Na+)是c(S2-)的两倍 | D.盐类水解后的溶液不一定显中性 |
您最近一年使用:0次
名校
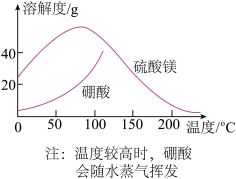
3 . 富硼渣中含有镁硼酸盐(2MgO·B2O3)、镁硅酸盐(2MgO·SiO2)及少量Al2O3、FeO等杂质。由富硼渣湿法制备硫酸镁晶体和硼酸(H3BO3)晶体的一种工艺流程如下:
已知:生成氢氧化物沉淀的pH(金属离子的起始浓度为0.1mol/L)
(1)上述流程中能加快反应速率的措施有__________ 、__________ 等。
(2)酸浸时发生反应:2MgO·SiO2 + 2H2SO4=2MgSO4 + SiO2 + 2H2O,2MgO·B2O3+ 2H2SO4 + H2O=2H3BO3 + 2MgSO4。
① 上述反应体现出酸性强弱:H2SO4__________ H3BO3(填“>”或“<”)。
② 酸浸时,富硼渣中所含Al2O3和FeO也同时溶解,写出相关反应的离子方程式:______ 、____ 。
③ 已知硼酸与过量NaOH溶液发生的中和反应为:H3BO3 + OH-= BO2- + 2H2O,下列关于硼酸的说法正确的是___ (填序号)。(已知:H2CO3 Ka1=4.2×10-7,Ka2=5.6×10-11 H3BO3 Ka=5.8×10-10)
a. 硼酸是三元酸
b. 硼酸的电离方程式可表示为:H3BO3⇌ BO2- + H2O +H+
c. 向NaHCO3固体中滴加饱和硼酸溶液,有气泡产生
d.室温下同浓度的NaBO2溶液和Na2CO3 溶液,Na2CO3 溶液pH较大。
(3)褐色浸出液中加入H2O2目的是:________________ 。
(4)用MgO调节溶液的pH至________ 以上,使杂质离子转化为沉淀,过滤。
(5)获取晶体:ⅰ.浓缩滤液,使MgSO4和H3BO3接近饱和;ⅱ.控制温度使两种晶体分别从溶液中结晶。结合如图溶解度曲线,简述ⅱ的方法:将浓缩液加入到高压釜中,_________________ (将方法补充完整)。

已知:生成氢氧化物沉淀的pH(金属离子的起始浓度为0.1mol/L)
| Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 | |
| 开始沉淀时 | 1.9 | 3.4 | 7.0 | 9.1 |
| 完全沉淀时 | 3.2 | 4.7 | 9.0 | 11.1 |
(2)酸浸时发生反应:2MgO·SiO2 + 2H2SO4=2MgSO4 + SiO2 + 2H2O,2MgO·B2O3+ 2H2SO4 + H2O=2H3BO3 + 2MgSO4。
① 上述反应体现出酸性强弱:H2SO4
② 酸浸时,富硼渣中所含Al2O3和FeO也同时溶解,写出相关反应的离子方程式:
③ 已知硼酸与过量NaOH溶液发生的中和反应为:H3BO3 + OH-= BO2- + 2H2O,下列关于硼酸的说法正确的是
a. 硼酸是三元酸
b. 硼酸的电离方程式可表示为:H3BO3⇌ BO2- + H2O +H+
c. 向NaHCO3固体中滴加饱和硼酸溶液,有气泡产生
d.室温下同浓度的NaBO2溶液和Na2CO3 溶液,Na2CO3 溶液pH较大。
(3)褐色浸出液中加入H2O2目的是:
(4)用MgO调节溶液的pH至
(5)获取晶体:ⅰ.浓缩滤液,使MgSO4和H3BO3接近饱和;ⅱ.控制温度使两种晶体分别从溶液中结晶。结合如图溶解度曲线,简述ⅱ的方法:将浓缩液加入到高压釜中,
您最近一年使用:0次
11-12高二上·湖北荆州·期末
名校
4 . 物质的量浓度相同的下列溶液中,c(NH4+)最大的是
| A.NH4Cl | B.CH3COONH4 | C.NH4HCO3 | D.NH4HSO4 |
您最近一年使用:0次
2019-02-25更新
|
1624次组卷
|
26卷引用:青海省西宁市湟源县第一中学2020-2021学年高二上学期期中考试化学试题
青海省西宁市湟源县第一中学2020-2021学年高二上学期期中考试化学试题(已下线)2010—2011学年湖北省荆州中学高二上学期期末考试化学试卷(已下线)2010—2011学年云南省昆明三中高二下学期期末考试化学试卷(已下线)2011-2012年湖南株洲市南方中学高二上学期期末考试理科化学试卷(已下线)2012年鲁科版高中化学选修4 3.2弱电解质的电离、盐类的水练习卷(已下线)2012-2013学年江苏省淮安市涟水县第一中学高一下期末考试化学卷(已下线)2013-2014学年江苏省南师附中江宁分校高二上学期选修期末化学试卷(已下线)2013-2014学年甘肃省兰州一中高二上学期期末考试化学试卷2014-2015福建省八县一中高二上学期期末考试化学试卷2014-2015江苏省扬中高级中学高二第一学期化学试卷2015-2016学年河北邯郸魏县一中、曲周县一中高二上期中化学试卷2015-2016学年河北省邢台二中高二上学期第二次月考化学试卷2015-2016学年河北省永年县第二中学高二上学期12月月考化学试卷2015-2016学年河北省唐山市高二上学期期末考试化学试卷2016-2017学年甘肃省武威二中高二上10月月考化学试卷(已下线)2018年11月11日——《每日一题》 人教 必修4-每周一测【全国百强校】山西省太原市第五中学2018-2019学年高二(理)上学期12月月考化学试题【区级联考】重庆市九龙坡区2018-2019学年高二上学期教育质量全面监测化学试题黑龙江省绥化市青冈县第一中学2019-2020学年高二上学期期中考试(B班)化学试题河南省项城市第三高级中学2020-2021学年高二上学期第三次考试化学试题宁夏青铜峡市高级中学2020-2021学年高二下学期开学考试化学试题广西南宁市上林县中学2020-2021学年高二上学期期末考试化学试题上海市上海中学东校2020届高三上学期期中考试化学试题陕西省渭南市咸林中学2021-2022学年高二上学期第三阶段检测化学试题宁夏银川市唐徕中学2022-2023学年高二下学期3月月考化学试题江西省宜春市宜丰中学2023-2024学年高二上学期12月月考化学试题
名校
5 . 下列物质的溶液中所含离子种类最多的是
| A.KCl | B.Na2CO3 | C.NaCl | D.CH3COONa |
您最近一年使用:0次
2019-01-01更新
|
517次组卷
|
5卷引用:青海省海东市第二中学2018-2019学年高二下学期第二次月考化学试题
解题方法
6 . 碲(Te)是VIA族非金属元素,其单质和化合物在太阳能、电子、橡胶生产方面具有广泛的应用。
(1)根据碲(Te)在元素周期表中的位置,判断H2TeO4的酸性_____ (填“大于”、“小于”或“无法判断”)H2SO4酸性。
(2)已知TeO2是两性氧化物,微溶于水,可溶于强酸或强碱。TeO2和NaOH溶液发生反应的化学方程式为_________________ 。
(3)已知25℃时,亚碲酸(H2TeO3)的电离常数K1=1×10-3,K2=2×10-8。计算:
①0.1mol/L H2TeO3的电离度α约为_______ (α=已电离弱电解质分子数/电解质分子总数×100%);
②NaHTeO3溶液的pH_____ 7(填“>”、“=”或“<”)。
(4)从粗铜精炼的阳极泥(主要含有Cu2Te)中提取粗碲的一种工芝流程如下:_____________ 。
④防止局部酸度过大的操作方法是___________ 。
⑤对滤渣“酸浸”后,将Na2SO3加入Te(SO4)2溶液中进行“还原”得到固态碲,该反应的离子方程式是____________ 。
⑥“还原”得到固态碲后分离出粗碲的方法是________ ,对粗碲进行洗涤,判断洗涤干净的实验操作和现象是_____________ 。
(1)根据碲(Te)在元素周期表中的位置,判断H2TeO4的酸性
(2)已知TeO2是两性氧化物,微溶于水,可溶于强酸或强碱。TeO2和NaOH溶液发生反应的化学方程式为
(3)已知25℃时,亚碲酸(H2TeO3)的电离常数K1=1×10-3,K2=2×10-8。计算:
①0.1mol/L H2TeO3的电离度α约为
②NaHTeO3溶液的pH
(4)从粗铜精炼的阳极泥(主要含有Cu2Te)中提取粗碲的一种工芝流程如下:

④防止局部酸度过大的操作方法是
⑤对滤渣“酸浸”后,将Na2SO3加入Te(SO4)2溶液中进行“还原”得到固态碲,该反应的离子方程式是
⑥“还原”得到固态碲后分离出粗碲的方法是
您最近一年使用:0次
名校
解题方法
7 . 常温下有浓度均为0.1 mol 的四种溶液:①Na2CO3 ②NaHCO3 ③HCl ④NH3·H2O
的四种溶液:①Na2CO3 ②NaHCO3 ③HCl ④NH3·H2O
(1)有人称溶液①是油污的“清道夫”,原因是_______ (用离子方程式解释)
(2)这四种溶液中水的电离程度由大到小的顺序是(用序号填写)_______
(3)向④中加入少量氯化铵固体,此时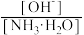 的值
的值_______ (填“增大”“减小”或“不变”)。
(4)等体积混合③和④的溶液,此时溶液中[NH ]+[NH3·H2O]=
]+[NH3·H2O]=_______ mol·L-1(填数值);此时溶液中离子浓度的大小顺序是:_______ ;若将③和④的溶液混合后溶液恰好呈中性,则混合前③的体积_______ ④的体积(填“大于”小于”或“等于”)
(5)将10 mL溶液③加水稀释至100 mL,则此时溶液中由水电离出的c( H+)=_______ mol·L-1。
 的四种溶液:①Na2CO3 ②NaHCO3 ③HCl ④NH3·H2O
的四种溶液:①Na2CO3 ②NaHCO3 ③HCl ④NH3·H2O (1)有人称溶液①是油污的“清道夫”,原因是
(2)这四种溶液中水的电离程度由大到小的顺序是(用序号填写)
(3)向④中加入少量氯化铵固体,此时
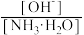 的值
的值(4)等体积混合③和④的溶液,此时溶液中[NH
 ]+[NH3·H2O]=
]+[NH3·H2O]=(5)将10 mL溶液③加水稀释至100 mL,则此时溶液中由水电离出的c( H+)=
您最近一年使用:0次
2018-01-02更新
|
496次组卷
|
3卷引用:青海省海东市第二中学2018-2019学年高二下学期第二次月考化学试题
13-14高二下·湖南衡阳·期末
名校
8 . 下列各溶液中,微粒的物质的量浓度关系正确的是( )
| A.1.0mol/L Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+c(H2CO3) |
| B.1.0mol/LNH4Cl溶液:c(NH4+)=c(Cl-) |
| C.向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液: c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| D.向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液:c(Na+)=c(NO3-) |
您最近一年使用:0次
2016-12-09更新
|
407次组卷
|
6卷引用:青海省湟川中学2020-2021学年高二下学期第一次月考化学试题



