名校
解题方法
1 . 已知常温下部分弱电解质的电离平衡常数如下表:
(1)常温下,物质的量浓度相同的三种溶液①NaF溶液②NaClO溶液③Na2CO3溶液,其pH由大到小的顺序是_______ (填序号)
(2)25℃时,pH=4的NH4Cl溶液中各离子浓度的大小关系为_______
(3)NaClO溶液中的质子守恒关系为_______
(4)向NaClO溶液中通入少量的CO2,所发生的离子方程式为_______
(5)常温下,0.1mol/L的氨水和0.1mol/L的NH4Cl溶液等体积混合,判断混合溶液的酸碱性_______ (填“酸性”“碱性”“中性”)
(6)25℃时,将amol·L-1的氨水与0.01mol·L-1的盐酸等体积混合,反应完后溶液中c(NH )=c(Cl-),用含a的代数式表示NH3·H2O的电离平衡常数Kb=
)=c(Cl-),用含a的代数式表示NH3·H2O的电离平衡常数Kb=_______ 。
| 化学式 | HF | HClO | H2CO3 | NH3·H2O |
| 电离常数 | 6.8×10−4 | 4.7×10−8 | K1=4.3×10−7 K2=5.6×10−11 | Kb=1.7×10−5 |
(1)常温下,物质的量浓度相同的三种溶液①NaF溶液②NaClO溶液③Na2CO3溶液,其pH由大到小的顺序是
(2)25℃时,pH=4的NH4Cl溶液中各离子浓度的大小关系为
(3)NaClO溶液中的质子守恒关系为
(4)向NaClO溶液中通入少量的CO2,所发生的离子方程式为
(5)常温下,0.1mol/L的氨水和0.1mol/L的NH4Cl溶液等体积混合,判断混合溶液的酸碱性
(6)25℃时,将amol·L-1的氨水与0.01mol·L-1的盐酸等体积混合,反应完后溶液中c(NH
 )=c(Cl-),用含a的代数式表示NH3·H2O的电离平衡常数Kb=
)=c(Cl-),用含a的代数式表示NH3·H2O的电离平衡常数Kb=
您最近一年使用:0次
解题方法
2 . 已知某溶液中只存在OH-、H+、 、Cl-四种离子,某同学推测其离子浓度大小顺序有以下几种,请回答后面问题:
、Cl-四种离子,某同学推测其离子浓度大小顺序有以下几种,请回答后面问题:
①c(Cl-)>c( )>c(H+)>c(OH-) ②c(Cl-)>c(
)>c(H+)>c(OH-) ②c(Cl-)>c( )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
③c( )>c(Cl-)>c(OH-)>c(H+) ④c(Cl-)>c(H+)>c(
)>c(Cl-)>c(OH-)>c(H+) ④c(Cl-)>c(H+)>c( )>c(OH-)
)>c(OH-)
(1)上述关系一定不正确的是_______________ (填序号)
(2)若溶液中只有一种溶质,则该溶质为____________ ,该溶液中离子浓度的大小关系为__________________________ (填序号)
(3)若关系③正确,则溶液中溶质为_______________________ 。
(4)若四种离子浓度关系有c( )=c(Cl-),则该溶液显
)=c(Cl-),则该溶液显_____ (填“酸性”、“碱性”、“中性”)。
(5)25℃,pH=a的盐酸VamL与pH=14-a的氨水VbmL混合,若溶液显中性,则Va____ Vb(填>、<、=、无法确定)
 、Cl-四种离子,某同学推测其离子浓度大小顺序有以下几种,请回答后面问题:
、Cl-四种离子,某同学推测其离子浓度大小顺序有以下几种,请回答后面问题:①c(Cl-)>c(
 )>c(H+)>c(OH-) ②c(Cl-)>c(
)>c(H+)>c(OH-) ②c(Cl-)>c( )>c(OH-)>c(H+)
)>c(OH-)>c(H+)③c(
 )>c(Cl-)>c(OH-)>c(H+) ④c(Cl-)>c(H+)>c(
)>c(Cl-)>c(OH-)>c(H+) ④c(Cl-)>c(H+)>c( )>c(OH-)
)>c(OH-)(1)上述关系一定不正确的是
(2)若溶液中只有一种溶质,则该溶质为
(3)若关系③正确,则溶液中溶质为
(4)若四种离子浓度关系有c(
 )=c(Cl-),则该溶液显
)=c(Cl-),则该溶液显(5)25℃,pH=a的盐酸VamL与pH=14-a的氨水VbmL混合,若溶液显中性,则Va
您最近一年使用:0次
19-20高二·浙江·期末
解题方法
3 . 含有弱酸HA和其钠盐NaA的混合溶液,在化学上用作缓冲溶液。向其中加入少量酸或碱时溶液的酸碱性变化不大。
(1)向该溶液中加入少量盐酸时,发生反应的离子方程式是____________________ ;向其中加入少量KOH溶液时,发生反应的离子方程式是____________________ 。
(2)现将 HA溶液和
HA溶液和 NaOH溶液等体积混合,得到缓冲溶液。
NaOH溶液等体积混合,得到缓冲溶液。
①若HA为 ,该溶液显酸性,则溶液中
,该溶液显酸性,则溶液中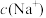
________ 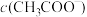 (填“
(填“ ”、“
”、“ ”或“
”或“ ”)。
”)。
②若HA为 ,该溶液显碱性,溶液中所有的离子按浓度由大到小排列的顺序是
,该溶液显碱性,溶液中所有的离子按浓度由大到小排列的顺序是_______________ 。
(1)向该溶液中加入少量盐酸时,发生反应的离子方程式是
(2)现将
 HA溶液和
HA溶液和 NaOH溶液等体积混合,得到缓冲溶液。
NaOH溶液等体积混合,得到缓冲溶液。①若HA为
 ,该溶液显酸性,则溶液中
,该溶液显酸性,则溶液中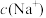
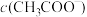 (填“
(填“ ”、“
”、“ ”或“
”或“ ”)。
”)。②若HA为
 ,该溶液显碱性,溶液中所有的离子按浓度由大到小排列的顺序是
,该溶液显碱性,溶液中所有的离子按浓度由大到小排列的顺序是
您最近一年使用:0次
名校
4 . I.铁镁合金是一种性能优异的储氢材料。关于铁镁两种元素,请回答下列问题:
(1)同周期元素中,第一电离能小于镁的元素有_______ 种。
(2)基态Fe原子的简化电子排布式为_______ ,空间运动状态有_______ 种,Fe位于元周期表的_______ 区,基态原子的电子有_______ 种伸展方向。
(3)与Fe元素同周期,基态原子有2个未成对电子的金属元素有_______ 种,下列状态的铁中,电离最外层一个电子所需能量最大的是_______ (填标号)。
a.[Ar] b.[Ar]
b.[Ar]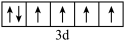
c.[Ar] d.[Ar]
d.[Ar]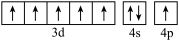
(4)试从结构角度解释 易被氧化为
易被氧化为
_______ 。
(5)对于呋喃: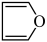 和吡咯:
和吡咯: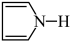 )所含的元素中,电负性最大的是
)所含的元素中,电负性最大的是_______ ,最小的是_______ ;第一电离能最大的是_______ 。
Ⅱ. 在食品、医药、电子工业中用途广泛。回答下列问题:
在食品、医药、电子工业中用途广泛。回答下列问题:
(6) 可做净水剂,其理由是
可做净水剂,其理由是_______ (用离子方程式表示)。
(7)下图是0.1mol/L电解质溶液的pH随温度变化的图像。其中符合0.1mol/L 溶液的是
溶液的是_______ (填罗马数字)。
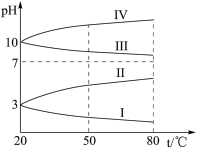
(8)20℃时,0.1mol/L 溶液中,
溶液中, =
=_______ mol/L(写出准确数值)。
Ⅲ、某同学用酸性KMnO4溶液测定绿矾产品中Fe2+含量:请回答下列问题:
反应原理为: (Mn2+在溶液中为无色)
(Mn2+在溶液中为无色)
a.称取11.5g绿矾产品,溶解,配制成1000mL溶液;
b.量取25.00mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01000mol/LKMnO4溶液滴定至终点
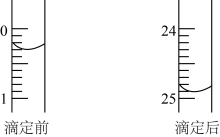
(9)若甲学生在实验过程中,记录滴定前后滴定管内液面读数如图所示,则此时消耗标准溶液的体积为_______ mL。
(10)此滴定实验达到终点的颜色变化为_______ 。
(11)重复滴定4次,每次消耗酸性KMnO4标准溶液的体积如表所示:
计算上述样品中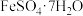 的质量分数为
的质量分数为_______ 。( ,小数点后保留一位)
,小数点后保留一位)
(12)若滴定前平视读数,滴定终点时仰视读数,则所测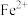 含量:
含量:_______ 。(填“无影响”、“偏高”或“偏低”)。
(1)同周期元素中,第一电离能小于镁的元素有
(2)基态Fe原子的简化电子排布式为
(3)与Fe元素同周期,基态原子有2个未成对电子的金属元素有
a.[Ar]
 b.[Ar]
b.[Ar]
c.[Ar]
 d.[Ar]
d.[Ar]
(4)试从结构角度解释
 易被氧化为
易被氧化为
(5)对于呋喃:
 和吡咯:
和吡咯: )所含的元素中,电负性最大的是
)所含的元素中,电负性最大的是Ⅱ.
 在食品、医药、电子工业中用途广泛。回答下列问题:
在食品、医药、电子工业中用途广泛。回答下列问题:(6)
 可做净水剂,其理由是
可做净水剂,其理由是(7)下图是0.1mol/L电解质溶液的pH随温度变化的图像。其中符合0.1mol/L
 溶液的是
溶液的是

(8)20℃时,0.1mol/L
 溶液中,
溶液中, =
=Ⅲ、某同学用酸性KMnO4溶液测定绿矾产品中Fe2+含量:请回答下列问题:
反应原理为:
 (Mn2+在溶液中为无色)
(Mn2+在溶液中为无色)a.称取11.5g绿矾产品,溶解,配制成1000mL溶液;
b.量取25.00mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01000mol/LKMnO4溶液滴定至终点
(9)若甲学生在实验过程中,记录滴定前后滴定管内液面读数如图所示,则此时消耗标准溶液的体积为
(10)此滴定实验达到终点的颜色变化为
(11)重复滴定4次,每次消耗酸性KMnO4标准溶液的体积如表所示:
| 第一次 | 第二次 | 第三次 | 第四次 | |
| V(KMnO4溶液)/mL | 17.10 | 19.98 | 20.00 | 20.02 |
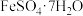 的质量分数为
的质量分数为 ,小数点后保留一位)
,小数点后保留一位)(12)若滴定前平视读数,滴定终点时仰视读数,则所测
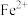 含量:
含量:
您最近一年使用:0次
9-10高二下·福建·期末
5 . 含有弱酸HA和其钠盐NaA的混合溶液,在化学上用作缓冲溶液。向其中加入少量酸或碱时,溶液的酸碱性变化不大。
(1)向该溶液中加入少量盐酸时,发生反应的离子方程式是_________________________
向其中加入少量KOH溶液时,发生反应的离子方程是___________________________
(2)现将0.04 mol·L-1HA溶液和0.02 mol·L-1NaOH 溶液等体积混合,得到缓冲溶液。
①若HA为HCN,该溶液显碱性,则溶液中c(Na+)_______ c(CN−)(填“<”“=”“>”)
②若HA为CH3COOH ,该溶液显酸性。溶液中所有的离子按浓度由大到小排列的顺序是_____________________________________________ 。
(1)向该溶液中加入少量盐酸时,发生反应的离子方程式是
向其中加入少量KOH溶液时,发生反应的离子方程是
(2)现将0.04 mol·L-1HA溶液和0.02 mol·L-1NaOH 溶液等体积混合,得到缓冲溶液。
①若HA为HCN,该溶液显碱性,则溶液中c(Na+)
②若HA为CH3COOH ,该溶液显酸性。溶液中所有的离子按浓度由大到小排列的顺序是
您最近一年使用:0次



