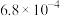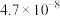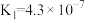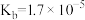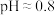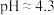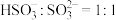名校
解题方法
1 . 自然界是各类物质相互依存的复杂体系,水溶液的离子平衡是一个重要方面。
(1) 时,在
时,在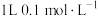 的
的 溶液中,有
溶液中,有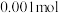 的
的 电离成离子,则该温度下的电离平衡常数为
电离成离子,则该温度下的电离平衡常数为_____ 。
(2)在 时,将
时,将 的
的 溶液
溶液 与
与 的
的 溶液
溶液 混合,若所得溶液为中性,则
混合,若所得溶液为中性,则
_______ 。
(3)常温下将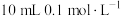 的
的 溶液与
溶液与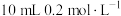 的醋酸溶液混合后溶液显酸性,则混合后溶液中各离子浓度的大小顺序为
的醋酸溶液混合后溶液显酸性,则混合后溶液中各离子浓度的大小顺序为________________ 。
(4)已知常温下部分弱电解质的电离平衡常数如下表:
常温下, 相同的三种溶液①
相同的三种溶液① 溶液;②
溶液;② 溶液;③
溶液;③ 溶液,其物质的量浓度由大到小的顺序是
溶液,其物质的量浓度由大到小的顺序是________ (填序号)。
(5)已知 时,
时, 的溶度积常数
的溶度积常数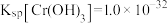 。则使
。则使 恰好完全沉淀,即溶液中
恰好完全沉淀,即溶液中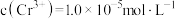 时,应调节
时,应调节 的最小值a为多少
的最小值a为多少________ 。
(6)查阅资料获得 时部分弱酸
时部分弱酸 的数据:
的数据: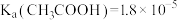 、
、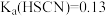 、
、 。
。
①已知 溶液呈弱碱性,试用离子反应方程式解释原因
溶液呈弱碱性,试用离子反应方程式解释原因________________ 。
②常温下,氢氟酸溶液加水稀释过程中,下列表达式数据变大的是________ (填序号)。
A. B.
B. C.
C.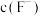 D.
D.
(7)已知在 时,将浓度相等的
时,将浓度相等的 与
与 溶液等体积混合,溶液呈酸性。解释溶液呈酸性的原因
溶液等体积混合,溶液呈酸性。解释溶液呈酸性的原因________________________ 。
(8)同浓度的 溶液和
溶液和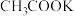 溶液相比:(选填“<”、“=”或“>”)后者溶液中:
溶液相比:(选填“<”、“=”或“>”)后者溶液中: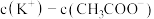
_____ 前者溶液中
(9)已加 溶液为中性,又知
溶液为中性,又知 溶液加到
溶液加到 溶液中有无色无味气体放出,现有
溶液中有无色无味气体放出,现有 时等浓度的5种溶液:请回答下列问题:
时等浓度的5种溶液:请回答下列问题:
a. b.
b. c.
c. d.
d. e.
e.
问题1:试推断 溶液的
溶液的
______ 7(填“>”、“<”或=)
问题2:将5种溶液按 浓度由大到小的顺序排列是:
浓度由大到小的顺序排列是:________ (填序号)。
(10)已知常温下,相同物质的量浓度的 溶液和
溶液和 溶液相比,
溶液相比, 溶液的
溶液的 较小。现将
较小。现将 溶液和
溶液和 溶液等体积混合,各离子浓度关系正确的是________(填序号)。
溶液等体积混合,各离子浓度关系正确的是________(填序号)。
(1)
 时,在
时,在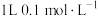 的
的 溶液中,有
溶液中,有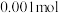 的
的 电离成离子,则该温度下的电离平衡常数为
电离成离子,则该温度下的电离平衡常数为(2)在
 时,将
时,将 的
的 溶液
溶液 与
与 的
的 溶液
溶液 混合,若所得溶液为中性,则
混合,若所得溶液为中性,则
(3)常温下将
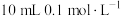 的
的 溶液与
溶液与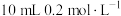 的醋酸溶液混合后溶液显酸性,则混合后溶液中各离子浓度的大小顺序为
的醋酸溶液混合后溶液显酸性,则混合后溶液中各离子浓度的大小顺序为(4)已知常温下部分弱电解质的电离平衡常数如下表:
化学式 |
|
|
|
|
电离常数 |
|
|
|
|
 相同的三种溶液①
相同的三种溶液① 溶液;②
溶液;② 溶液;③
溶液;③ 溶液,其物质的量浓度由大到小的顺序是
溶液,其物质的量浓度由大到小的顺序是(5)已知
 时,
时, 的溶度积常数
的溶度积常数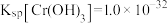 。则使
。则使 恰好完全沉淀,即溶液中
恰好完全沉淀,即溶液中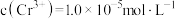 时,应调节
时,应调节 的最小值a为多少
的最小值a为多少(6)查阅资料获得
 时部分弱酸
时部分弱酸 的数据:
的数据: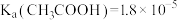 、
、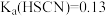 、
、 。
。①已知
 溶液呈弱碱性,试用离子反应方程式解释原因
溶液呈弱碱性,试用离子反应方程式解释原因②常温下,氢氟酸溶液加水稀释过程中,下列表达式数据变大的是
A.
 B.
B. C.
C.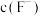 D.
D.
(7)已知在
 时,将浓度相等的
时,将浓度相等的 与
与 溶液等体积混合,溶液呈酸性。解释溶液呈酸性的原因
溶液等体积混合,溶液呈酸性。解释溶液呈酸性的原因(8)同浓度的
 溶液和
溶液和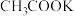 溶液相比:(选填“<”、“=”或“>”)后者溶液中:
溶液相比:(选填“<”、“=”或“>”)后者溶液中: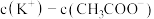

(9)已加
 溶液为中性,又知
溶液为中性,又知 溶液加到
溶液加到 溶液中有无色无味气体放出,现有
溶液中有无色无味气体放出,现有 时等浓度的5种溶液:请回答下列问题:
时等浓度的5种溶液:请回答下列问题:a.
 b.
b. c.
c. d.
d. e.
e.
问题1:试推断
 溶液的
溶液的
问题2:将5种溶液按
 浓度由大到小的顺序排列是:
浓度由大到小的顺序排列是:(10)已知常温下,相同物质的量浓度的
 溶液和
溶液和 溶液相比,
溶液相比, 溶液的
溶液的 较小。现将
较小。现将 溶液和
溶液和 溶液等体积混合,各离子浓度关系正确的是________(填序号)。
溶液等体积混合,各离子浓度关系正确的是________(填序号)。A.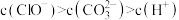 |
B. |
C. |
D.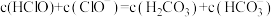 |
您最近一年使用:0次
解题方法
2 . 采用硫磺熏蒸处理药材会产生一定量的硫残留(其中S元素为+4价),以下是一种简便且准确的分析测定硫含量的方法。
Ⅰ.样品预处理(均在室温下进行):
对xg药材进行处理后,将逸出的 全部收集溶于水形成溶液X。加NaOH溶液将溶液X调为
全部收集溶于水形成溶液X。加NaOH溶液将溶液X调为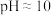 ,此时溶液总体积为V mL(记为溶液Y)。
,此时溶液总体积为V mL(记为溶液Y)。
资料:不同pH下,含硫微粒在溶液中的主要存在形式:
(1) 溶于水后溶液显酸性,用化学用语表示其原因:
溶于水后溶液显酸性,用化学用语表示其原因:___________ 。
(2)用少量NaOH溶液将X溶液pH调至4.3的过程中发生反应的离子方程式是___________ 。
(3)将X溶液pH调至10时, 与消耗的NaOH物质的量之比
与消耗的NaOH物质的量之比
___________ 。
(4)关于室温下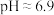 的溶液说法正确的是
的溶液说法正确的是___________ 。
a.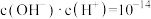
b.
c.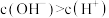
Ⅱ.电化学测定:利用如图电解装置进行测定。
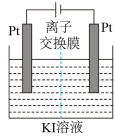
通电片刻后停止通电,加入淀粉溶液。根据电流大小和电解效率理论计算共产生 。用溶液Y对停止通电后的阳极区电解质溶液进行滴定,到达终点时,共用去
。用溶液Y对停止通电后的阳极区电解质溶液进行滴定,到达终点时,共用去 。
。
(5)阳极的电极反应式是___________ 。
(6)确定滴定终点的现象是___________ 。
(7)药材中硫残留量(其中含硫微粒均按 计,
计,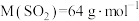 )为
)为___________ mg/g。
Ⅰ.样品预处理(均在室温下进行):
对xg药材进行处理后,将逸出的
 全部收集溶于水形成溶液X。加NaOH溶液将溶液X调为
全部收集溶于水形成溶液X。加NaOH溶液将溶液X调为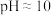 ,此时溶液总体积为V mL(记为溶液Y)。
,此时溶液总体积为V mL(记为溶液Y)。资料:不同pH下,含硫微粒在溶液中的主要存在形式:
| pH |
|
|
|
|
| 含硫微粒在溶液中的主要存在形式 |
|
|
|
|
 溶于水后溶液显酸性,用化学用语表示其原因:
溶于水后溶液显酸性,用化学用语表示其原因:(2)用少量NaOH溶液将X溶液pH调至4.3的过程中发生反应的离子方程式是
(3)将X溶液pH调至10时,
 与消耗的NaOH物质的量之比
与消耗的NaOH物质的量之比
(4)关于室温下
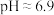 的溶液说法正确的是
的溶液说法正确的是a.
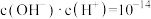
b.

c.
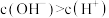
Ⅱ.电化学测定:利用如图电解装置进行测定。

通电片刻后停止通电,加入淀粉溶液。根据电流大小和电解效率理论计算共产生
 。用溶液Y对停止通电后的阳极区电解质溶液进行滴定,到达终点时,共用去
。用溶液Y对停止通电后的阳极区电解质溶液进行滴定,到达终点时,共用去 。
。(5)阳极的电极反应式是
(6)确定滴定终点的现象是
(7)药材中硫残留量(其中含硫微粒均按
 计,
计,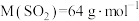 )为
)为
您最近一年使用:0次
名校
解题方法
3 . 已知:25℃时,CH3COOH和NH3·H2O的电离平衡常数近似相等。
(1)关于0.1 mol/LCH3COOH溶液,回答下列问题。
①25℃时,测得0.1 mol/LCH3COOH溶液的pH= 3,则由水电离出的H+的浓度为______ mol/L。
②CH3COONa溶液显____ (填“酸性”“碱性”或“中性”),用离子方程式表示其原因:_____ 。
③能证明醋酸是弱酸的实验事实是_____ (填字母)。
a.同浓度的CH3COOH溶液和盐酸分别与相同的Mg条反应。放出H2的初始速率醋酸慢
b.常温下0.1 mol/LCH3COONa溶液的pH >7
c.CH3COOH溶液与Na2CO3反应生成CO2
d.0.1 mol/LCH3COOH溶液可使紫色石蕊溶液变红
e.常温下0.1mol/L醋酸溶液的pH > 1
(2)关于0.1 mol/L氨水,回答下列问题。
①NH3·H2O的电离方程式为,NH3·H2O的电离平衡常数表达式Kb=_______ 。
②25℃时,0.1 mol/L氨水的pH=___________ 。
③25℃时,向10 mL0.1 mol/L氨水中加入同体积同浓度的盐酸。下列说法正确的是________ 。
a.c(Cl-)>c( )>c(OH-)>c(H+) b.c(Cl-) = c(
)>c(OH-)>c(H+) b.c(Cl-) = c( ) + c(NH3·H2O)
) + c(NH3·H2O)
(1)关于0.1 mol/LCH3COOH溶液,回答下列问题。
①25℃时,测得0.1 mol/LCH3COOH溶液的pH= 3,则由水电离出的H+的浓度为
②CH3COONa溶液显
③能证明醋酸是弱酸的实验事实是
a.同浓度的CH3COOH溶液和盐酸分别与相同的Mg条反应。放出H2的初始速率醋酸慢
b.常温下0.1 mol/LCH3COONa溶液的pH >7
c.CH3COOH溶液与Na2CO3反应生成CO2
d.0.1 mol/LCH3COOH溶液可使紫色石蕊溶液变红
e.常温下0.1mol/L醋酸溶液的pH > 1
(2)关于0.1 mol/L氨水,回答下列问题。
①NH3·H2O的电离方程式为,NH3·H2O的电离平衡常数表达式Kb=
②25℃时,0.1 mol/L氨水的pH=
③25℃时,向10 mL0.1 mol/L氨水中加入同体积同浓度的盐酸。下列说法正确的是
a.c(Cl-)>c(
 )>c(OH-)>c(H+) b.c(Cl-) = c(
)>c(OH-)>c(H+) b.c(Cl-) = c( ) + c(NH3·H2O)
) + c(NH3·H2O)
您最近一年使用:0次
名校
解题方法
4 . 室温下,通过下列实验探究 溶液的性质。
溶液的性质。
下列有关说法错误的是
 溶液的性质。
溶液的性质。| 选项 | 实验操作和现象 |
| 1 | 向  溶液中滴加酸性高锰酸钾溶液,溶液紫红色褪去 溶液中滴加酸性高锰酸钾溶液,溶液紫红色褪去 |
| 2 | 用pH试纸测定  溶液的pH,测得pH约为8 溶液的pH,测得pH约为8 |
| 3 | 向  溶液中加入过量 溶液中加入过量  溶液,产生白色沉淀 溶液,产生白色沉淀 |
| 4 | 向  溶液中滴加等体积的 溶液中滴加等体积的 HCl溶液,测得pH约为5.5 HCl溶液,测得pH约为5.5 |
A.实验1说明 具有还原性 具有还原性 |
B.  溶液中存在 溶液中存在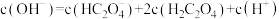 |
C.实验3反应静置后的上层清液中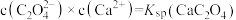 |
D.实验4得到的溶液中 |
您最近一年使用:0次
2022-01-19更新
|
193次组卷
|
4卷引用:湖北省新高考联考协作体2021-2022学年高二上学期期末考试化学试题
湖北省新高考联考协作体2021-2022学年高二上学期期末考试化学试题天津市第四十二中学2022-2023学年高二上学期末考试化学试题(已下线)专项03 四大平衡常数的综合应用-【好题汇编】备战2023-2024学年高二化学上学期期末真题分类汇编(天津专用)天津市第四十二中学2023-2024学年高二上学期第二次月考化学试题
5 . Ⅰ.已知25℃时部分弱电解质的电离平衡常数如下表所示,请回答下列问题:
(1)25℃时 溶液显
溶液显___________ (填“酸性”、“碱性”或“中性”)。
(2)25℃时物质的量浓度均为0.1mol/L的 、NaClO、
、NaClO、 三种溶液中pH最小的是
三种溶液中pH最小的是___________ (填化学式)。
(3)常温下,向HCN溶液中加入等体积、等浓度的NaCN溶液,所得混合溶液中所有离子的浓度由大到小的顺序为___________ 。
(4)25℃时,向 溶液中加入NaOH固体到pH=7,则
溶液中加入NaOH固体到pH=7,则
___________ 。
Ⅱ.某科研单位利用NO-空气质子交换膜燃料电池制备高纯铬和硫酸的简单装置如下图所示:

(5)①Pt(Ⅰ)电极上发生的电极反应式为___________ 。
②X膜为___________ 离子交换膜(填“阴”或“阳”)。
③理论上,若Pt(Ⅱ)电极上参加反应的NO在标况下的体积为4.48L,则Cr棒增重___________ g。
| 化学式 |  |  |  |  |  |
| 电离常数 |  |  |  |  |   |
(1)25℃时
 溶液显
溶液显(2)25℃时物质的量浓度均为0.1mol/L的
 、NaClO、
、NaClO、 三种溶液中pH最小的是
三种溶液中pH最小的是(3)常温下,向HCN溶液中加入等体积、等浓度的NaCN溶液,所得混合溶液中所有离子的浓度由大到小的顺序为
(4)25℃时,向
 溶液中加入NaOH固体到pH=7,则
溶液中加入NaOH固体到pH=7,则
Ⅱ.某科研单位利用NO-空气质子交换膜燃料电池制备高纯铬和硫酸的简单装置如下图所示:

(5)①Pt(Ⅰ)电极上发生的电极反应式为
②X膜为
③理论上,若Pt(Ⅱ)电极上参加反应的NO在标况下的体积为4.48L,则Cr棒增重
您最近一年使用:0次
名校
6 . Ⅰ. 在染料、造纸、制革、化学合成等工业中作为还原剂,在酿造、饮料行业中用作杀菌剂,还可用于生产糖精、香料等。其水溶液中含硫微粒随pH的分布曲线如图所示。
在染料、造纸、制革、化学合成等工业中作为还原剂,在酿造、饮料行业中用作杀菌剂,还可用于生产糖精、香料等。其水溶液中含硫微粒随pH的分布曲线如图所示。
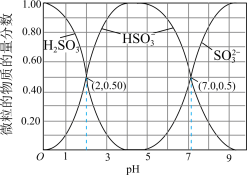
请回答以下问题:
(1)下列说法正确的是_______。
(2)若向 溶液中滴入NaOH溶液使pH恰好为7,此时测得
溶液中滴入NaOH溶液使pH恰好为7,此时测得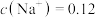 mol∙L−1,则溶液中
mol∙L−1,则溶液中
_______ mol∙L−1;
(3)已知几种酸的Ka如下表所示,下列化学方程式正确的是_______。
Ⅱ.工业上可用纯碱吸收二氧化硫法制备 ,流程如下图所示。
,流程如下图所示。
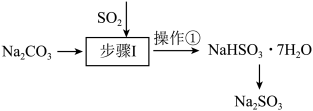
(4)步骤I中边搅拌边向 溶液中通入
溶液中通入 制备
制备 溶液,结合
溶液,结合 的分布系数图,确定停止通入
的分布系数图,确定停止通入 的最佳pH范围是
的最佳pH范围是_______ ,操作①的名称为_______ ;
(5)某小组同学用0.1000 mol∙L−1的酸性 溶液测定产品中
溶液测定产品中 的含量,具体流程:
的含量,具体流程:
①称量1 g样品,溶解,配置成250 mL的溶液;
②用滴定管量取25.00 mL样品溶液于锥形瓶中,用酸性 溶液滴定;
溶液滴定;
③消耗 溶液体积为20.00 mL;
溶液体积为20.00 mL;
试计算样品中 的纯度
的纯度_______ 。
(6)连二亚硫酸钠( )俗称保险粉,是一种强还原剂。工业常用惰性电极电解酸性亚硫酸氢钠溶液制备连二亚硫酸钠,原理及装置如图所示,a电极反应为
)俗称保险粉,是一种强还原剂。工业常用惰性电极电解酸性亚硫酸氢钠溶液制备连二亚硫酸钠,原理及装置如图所示,a电极反应为_______ 。

 在染料、造纸、制革、化学合成等工业中作为还原剂,在酿造、饮料行业中用作杀菌剂,还可用于生产糖精、香料等。其水溶液中含硫微粒随pH的分布曲线如图所示。
在染料、造纸、制革、化学合成等工业中作为还原剂,在酿造、饮料行业中用作杀菌剂,还可用于生产糖精、香料等。其水溶液中含硫微粒随pH的分布曲线如图所示。
请回答以下问题:
(1)下列说法正确的是_______。
A. 溶液显碱性 溶液显碱性 |
B. 时,溶液中 时,溶液中 |
C. 溶液中 溶液中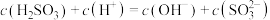 |
D. 溶液中 溶液中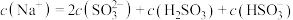 |
 溶液中滴入NaOH溶液使pH恰好为7,此时测得
溶液中滴入NaOH溶液使pH恰好为7,此时测得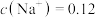 mol∙L−1,则溶液中
mol∙L−1,则溶液中
(3)已知几种酸的Ka如下表所示,下列化学方程式正确的是_______。
| 碳酸 | 次氯酸 | 醋酸 |
 |  | 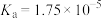 |
 |
A.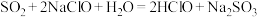 |
B.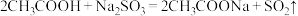 |
C. |
D. |
Ⅱ.工业上可用纯碱吸收二氧化硫法制备
 ,流程如下图所示。
,流程如下图所示。
(4)步骤I中边搅拌边向
 溶液中通入
溶液中通入 制备
制备 溶液,结合
溶液,结合 的分布系数图,确定停止通入
的分布系数图,确定停止通入 的最佳pH范围是
的最佳pH范围是(5)某小组同学用0.1000 mol∙L−1的酸性
 溶液测定产品中
溶液测定产品中 的含量,具体流程:
的含量,具体流程:①称量1 g样品,溶解,配置成250 mL的溶液;
②用滴定管量取25.00 mL样品溶液于锥形瓶中,用酸性
 溶液滴定;
溶液滴定;③消耗
 溶液体积为20.00 mL;
溶液体积为20.00 mL;试计算样品中
 的纯度
的纯度(6)连二亚硫酸钠(
 )俗称保险粉,是一种强还原剂。工业常用惰性电极电解酸性亚硫酸氢钠溶液制备连二亚硫酸钠,原理及装置如图所示,a电极反应为
)俗称保险粉,是一种强还原剂。工业常用惰性电极电解酸性亚硫酸氢钠溶液制备连二亚硫酸钠,原理及装置如图所示,a电极反应为
您最近一年使用:0次
名校
解题方法
7 . 根据水溶液的离子平衡知识,填写下题:
(1)下列物质中,属于强电解质的是_______ (均填序号);属于弱电解质的是_______ 。
①水②氨水③盐酸④冰醋酸⑤硫酸钡⑥氯化银⑦氯化钠⑧氢气⑨醋酸铵
(2)苏打水溶液显碱性原因(用离子方程式表示)_______ 。
(3)醋酸溶液呈_______ (填“酸性”,“中性”或“碱性”),其电离方程式为:_______ ;
(4)常温下,0.lmol·L-1NaHCO3溶液的pH大于8,则溶液中c(H2CO3)_______ c(CO )(填“>”、“=”或“<”)。
)(填“>”、“=”或“<”)。
(5)在25℃下,将amol·L-1的氨水与0.01mol·L-1的盐酸等体积混合,反应完成后溶液中c(NH )=c(Cl-),则溶液显
)=c(Cl-),则溶液显_______ 性(填“酸”“碱”或“中”),a_______ 0.01mol·L-1(填“>”、“=”或“<”)。
(6)若分别将pH=2的盐酸和醋酸稀释100倍,则稀释后溶液的pH:盐酸_______ 醋酸(填“>”、“=”或“<”)。
(1)下列物质中,属于强电解质的是
①水②氨水③盐酸④冰醋酸⑤硫酸钡⑥氯化银⑦氯化钠⑧氢气⑨醋酸铵
(2)苏打水溶液显碱性原因(用离子方程式表示)
(3)醋酸溶液呈
(4)常温下,0.lmol·L-1NaHCO3溶液的pH大于8,则溶液中c(H2CO3)
 )(填“>”、“=”或“<”)。
)(填“>”、“=”或“<”)。(5)在25℃下,将amol·L-1的氨水与0.01mol·L-1的盐酸等体积混合,反应完成后溶液中c(NH
 )=c(Cl-),则溶液显
)=c(Cl-),则溶液显(6)若分别将pH=2的盐酸和醋酸稀释100倍,则稀释后溶液的pH:盐酸
您最近一年使用:0次
2022-11-16更新
|
167次组卷
|
2卷引用:黑龙江省佳木斯市第十二中学2022-2023学年高二上学期期中考试化学试题
2021高二·全国·专题练习
8 . 某二元酸(化学式用H2A表示)在水中的电离方程式是:H2A=H++HA- HA-⇌H++A2-,完成以下问题:
(1)Na2A溶液显_______ (填“酸性”、“中性”或“碱性”),理由是_______ (用离子方程式表示)。
(2)已知0.1 mol·L-1的NaHA溶液pH=2,则0.1 mol·L-1的H2A溶液中氢离子的物质的量浓度_______ 0.11mol·L-1(填“>”、“=”或“<”)。
(1)Na2A溶液显
(2)已知0.1 mol·L-1的NaHA溶液pH=2,则0.1 mol·L-1的H2A溶液中氢离子的物质的量浓度
您最近一年使用:0次
名校
9 . 回答下列问题
(1)含有弱酸HA和其钠盐NaA的混合溶液,在化学上用作缓冲溶液。向其中加入少量酸或碱时,溶液的酸碱性变化不大。
①写出该混合溶液中存在的电荷守恒关系式_______ 。
②向其中加入少量KOH溶液时,发生反应的离子方程式是_______ 。
③现将 溶液和
溶液和 溶液等体积混合,得到缓冲溶液。
溶液等体积混合,得到缓冲溶液。
a.若HA为HCN,该溶液显碱性,则溶液中c(Na+)_______ c(CN-) (填“<”、“=”或“>”)。
b.若HA为 ,该溶液显酸性,则溶液中所有的离子按浓度由大到小排列的顺序是
,该溶液显酸性,则溶液中所有的离子按浓度由大到小排列的顺序是_______ 。
(2)常温下,向 溶液中逐滴加入
溶液中逐滴加入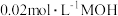 溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计)。回答下列问题:
溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计)。回答下列问题:

①常温下一定浓度的MCl稀溶液的pH_______ (填“>”“<”或“=”)7,用离子方程式表示其原因_______ 。
②K点对应的溶液中,c(M+)+c(MOH)_______ (填“>”“<”或“=”)2c(Cl-)
(1)含有弱酸HA和其钠盐NaA的混合溶液,在化学上用作缓冲溶液。向其中加入少量酸或碱时,溶液的酸碱性变化不大。
①写出该混合溶液中存在的电荷守恒关系式
②向其中加入少量KOH溶液时,发生反应的离子方程式是
③现将
 溶液和
溶液和 溶液等体积混合,得到缓冲溶液。
溶液等体积混合,得到缓冲溶液。a.若HA为HCN,该溶液显碱性,则溶液中c(Na+)
b.若HA为
 ,该溶液显酸性,则溶液中所有的离子按浓度由大到小排列的顺序是
,该溶液显酸性,则溶液中所有的离子按浓度由大到小排列的顺序是(2)常温下,向
 溶液中逐滴加入
溶液中逐滴加入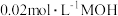 溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计)。回答下列问题:
溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计)。回答下列问题:
①常温下一定浓度的MCl稀溶液的pH
②K点对应的溶液中,c(M+)+c(MOH)
您最近一年使用:0次
名校
解题方法
10 . I.请按要求完成下列问题:
(1)某温度时,测得0.01mol/LNaOH溶液的pH=11,该温度下水的离子积Kw=_____ 。该温度下,将pH=12的NaOH溶液Va mL与pH=2的H2SO4溶液Vb mL混合,混合后溶液的pH=11,则Va:Vb=_____
Ⅱ. 已知H2A在水中存在以下平衡:H2A=H++HA-,HA- H++A2-。回答以下问题:
H++A2-。回答以下问题:
(2)NaHA溶液显___________ (填“酸性”、“碱性”、“中性”), NaHA溶液中的离子浓度由大到小的顺序为_____ .
(3)某温度下,向0.1 mol/L的NaHA溶液中滴入0.1 mol/LKOH溶液至中性,此时溶液中以下关系一定正确的是___________(填字母)。
III. 完成下列问题:
(4)用物质的量分别为 的HCN和NaCN配成1L混合溶液,已知其中
的HCN和NaCN配成1L混合溶液,已知其中 小于
小于 ,则溶液中c(H+)
,则溶液中c(H+) _____ . c(OH-),
_____ .
(5)室温下将amol/L的HCN与0.1mol/L的NaOH溶液等体积混合,反应后溶液中c(Na+)=c(CN-),则溶液显___________ 性(填“酸”“碱”“中”);用含a的代数式表示HCN的电离常数Ka= ___________ 。
(1)某温度时,测得0.01mol/LNaOH溶液的pH=11,该温度下水的离子积Kw=
Ⅱ. 已知H2A在水中存在以下平衡:H2A=H++HA-,HA-
 H++A2-。回答以下问题:
H++A2-。回答以下问题:(2)NaHA溶液显
(3)某温度下,向0.1 mol/L的NaHA溶液中滴入0.1 mol/LKOH溶液至中性,此时溶液中以下关系一定正确的是___________(填字母)。
| A.c(H+)·c(OH-)=1×10-14 mol2/L2 | B.c(Na+)+c(K+)=c(HA-)+2c(A2-) |
| C.c(Na+)>c(K+) | D.c(Na+)+c(K+)=0.05 mol/L |
III. 完成下列问题:
(4)用物质的量分别为
 的HCN和NaCN配成1L混合溶液,已知其中
的HCN和NaCN配成1L混合溶液,已知其中 小于
小于 ,则溶液中c(H+)
,则溶液中c(H+) 
(5)室温下将amol/L的HCN与0.1mol/L的NaOH溶液等体积混合,反应后溶液中c(Na+)=c(CN-),则溶液显
您最近一年使用:0次