名校
1 . FeCl3(易升华)是常见的化学试剂。某学习小组开展了与FeCl3相关的系列实验。回答下列问题:
Ⅰ.铁粉制备FeCl3(实验装置如图所示)

(1)仪器a的名称为_______ ;装置中F的作用:_______ 。
(2)硬质玻璃管直接接入收集器的优点是_______ 。
Ⅱ.探究FeCl3溶液与Cu的反应
(3)配制FeCl3溶液时加入少量盐酸的原因是_______ 。
(4)向FeCl3溶液中滴加几滴KSCN溶液,溶液颜色变红,再加入过量Cu粉,发现溶液的红色褪去。用离子方程式解释红色褪去的原因:_______ 。
(5)已知(4)中除了红色褪去,还产生了白色沉淀。小组成员查阅得知CuCl和CuSCN均为白色沉淀。为探究白色沉淀的主要成分,小组成员完成了以下实验:向4 mL 0.1mol/L FeCl3溶液中加入过量Cu粉,静置,取上层清液于试管中,滴加3滴KSCN溶液,有白色沉淀生成。由此现象可知此白色沉淀为_______ (填化学式)。
小组成员进一步查阅资料发现,Cu2+与SCN-可发生如下两种反应。
反应i:Cu2++ 4SCN- =[ Cu(SCN)4]2 -(淡黄色)
反应ii:2Cu2+ + 4SCN-= 2CuSCN↓+ (SCN)2
设计实验如下:
由此现象可知,反应速率较快的为_______ (填“反应i”或“反应ii”)。 小组成员得出结论,反应ii不是CuSCN产生的主要原因。
(6)根据上述分析可知,Cu2+、Fe2+和SCN-可直接发生反应,生成CuSCN和Fe3+,写出反应的离子方程式:_______ 。
Ⅰ.铁粉制备FeCl3(实验装置如图所示)

(1)仪器a的名称为
(2)硬质玻璃管直接接入收集器的优点是
Ⅱ.探究FeCl3溶液与Cu的反应
(3)配制FeCl3溶液时加入少量盐酸的原因是
(4)向FeCl3溶液中滴加几滴KSCN溶液,溶液颜色变红,再加入过量Cu粉,发现溶液的红色褪去。用离子方程式解释红色褪去的原因:
(5)已知(4)中除了红色褪去,还产生了白色沉淀。小组成员查阅得知CuCl和CuSCN均为白色沉淀。为探究白色沉淀的主要成分,小组成员完成了以下实验:向4 mL 0.1mol/L FeCl3溶液中加入过量Cu粉,静置,取上层清液于试管中,滴加3滴KSCN溶液,有白色沉淀生成。由此现象可知此白色沉淀为
小组成员进一步查阅资料发现,Cu2+与SCN-可发生如下两种反应。
反应i:Cu2++ 4SCN- =[ Cu(SCN)4]2 -(淡黄色)
反应ii:2Cu2+ + 4SCN-= 2CuSCN↓+ (SCN)2
设计实验如下:
| 操作 | 现象 |
| 在盛有2 mL 0.1mol·L-1 CuSO4溶液的试管中滴加KSCN溶液 | 溶液很快由蓝色变为绿色,未观察到白色沉淀; 2h后溶液为绿色,未观察到白色沉淀;24h后,溶液绿色变浅,试管底部有白色沉淀 |
(6)根据上述分析可知,Cu2+、Fe2+和SCN-可直接发生反应,生成CuSCN和Fe3+,写出反应的离子方程式:
您最近一年使用:0次
名校
2 . 下列实验方案能达到实验目的的是
| 选项 | A | B | C | D |
| 目的 | 制备并收集乙酸乙酯 | 证明温度对平衡的影响 | 证明AgI的溶解度小于AgCl | 蒸干氯化锰溶液制 |
| 实验方案 |  |  |  |  |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-03-10更新
|
293次组卷
|
4卷引用:河北省五校联盟(保定市第一中学等)2021-2022学年高三下学期3月模拟考试化学试题
河北省五校联盟(保定市第一中学等)2021-2022学年高三下学期3月模拟考试化学试题(已下线)卷13 化学基础实验(检验、鉴别、分离、提纯)-【小题小卷】冲刺2022年高考化学小题限时集训(新高考专用)湖南省永州市第四中学2022届高三下学期期中考试化学试题河北省唐山市开滦一中2022-2023学年高二下学期期末考试化学试题
名校
3 . 下列实验设计能达到实验目的的是
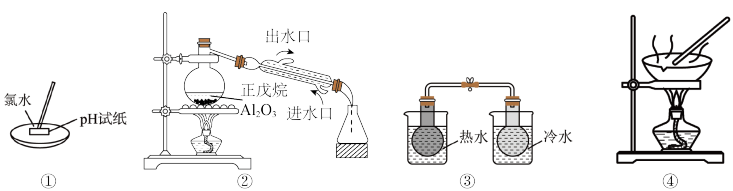

| A.①用于测量氯水的pH |
| B.②可以探究正戊烷(C5H12)催化裂化 |
| C.③可用于探究温度对2NO2(g)⇌N2O4(g)平衡移动的影响 |
| D.④用AlCl3溶液制备AlCl3晶体 |
您最近一年使用:0次
2021-06-05更新
|
100次组卷
|
2卷引用:辽宁省大连庄河市高级中学2022-2023学年高二上学期12月月考化学(B卷)试题
名校
4 .  的化学性质与
的化学性质与 相似。用
相似。用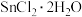 配制氯化亚锡溶液的操作为:加盐酸溶解→加水稀释→加4~5粒锡→移液保存。下列关于
配制氯化亚锡溶液的操作为:加盐酸溶解→加水稀释→加4~5粒锡→移液保存。下列关于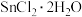 的相关实验叙述正确的是
的相关实验叙述正确的是

 的化学性质与
的化学性质与 相似。用
相似。用 配制氯化亚锡溶液的操作为:加盐酸溶解→加水稀释→加4~5粒锡→移液保存。下列关于
配制氯化亚锡溶液的操作为:加盐酸溶解→加水稀释→加4~5粒锡→移液保存。下列关于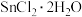 的相关实验叙述正确的是
的相关实验叙述正确的是
| A.用A装置稀释浓盐酸 | B.用B装置加快 溶解 溶解 |
C.用C装置保存 溶液 溶液 | D.用D装置制备无水 |
您最近一年使用:0次
名校
解题方法
5 . 氨基羧酸盐在工农业、生活中有着广泛应用,其中氨基甲酸铵(NH2COONH4)可用作肥料、洗涤剂等。实验室用下图所示装置制备氨基甲酸铵,该反应在干燥条件下仅生成氨基甲酸铵,若有水存在则主要生成碳酸氢铵。
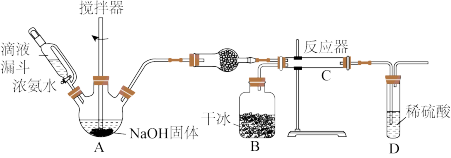
(1)盛放NaOH固体的仪器名称是_______ ,干燥管中的试剂为_______ 。
(2)无水条件下合成氨基甲酸铵的化学反应方程式为_______ ;若该反应能自发进行,则该反应的
_______ 0,(填“>”或“<”);对比碳酸钙和盐酸反应制取CO2,该实验利用干冰升华制取CO2,其优点有_______ 。
A.提供较低的反应温度,有利于过程的自发进行
B.所得氨基甲酸铵含杂质较少
C.更加绿色环保
D.对CO2的流速能更好的调控与掌握
(3)上述实验装置存在缺陷,改进的方法是_______ 。(写出其中任意1条)
(4)某小组拟在相同温度下,探究氨基甲酸铵浓度对氨基甲酸铵水解反应速率的影响。限选试剂与仪器:2.0mol/L NH2COONH4溶液、蒸馏水、烧杯、量筒、秒表、电导率仪、恒温水浴槽。设计实验方案:在不同氨基甲酸铵溶液浓度下,测定电导率数值的变化量相同所需的时间。参照下表格式,在表中的空白栏目填上需记录的待测物理量和所拟定的数据。(数据用字母表示,其中体积用V1、V2等表示)______
(5)该小组在上述实验方案基础上又进行了探究,分别用两份不同初始浓度的氨基甲酸铵溶液在不同温度下测定水解反应速率,得到c(NH2COO-)随时间的变化趋势如图所示。根据图中信息,能说明该水解反应速率随温度升高而加快的证据是_______ 。


(1)盛放NaOH固体的仪器名称是
(2)无水条件下合成氨基甲酸铵的化学反应方程式为

A.提供较低的反应温度,有利于过程的自发进行
B.所得氨基甲酸铵含杂质较少
C.更加绿色环保
D.对CO2的流速能更好的调控与掌握
(3)上述实验装置存在缺陷,改进的方法是
(4)某小组拟在相同温度下,探究氨基甲酸铵浓度对氨基甲酸铵水解反应速率的影响。限选试剂与仪器:2.0mol/L NH2COONH4溶液、蒸馏水、烧杯、量筒、秒表、电导率仪、恒温水浴槽。设计实验方案:在不同氨基甲酸铵溶液浓度下,测定电导率数值的变化量相同所需的时间。参照下表格式,在表中的空白栏目填上需记录的待测物理量和所拟定的数据。(数据用字母表示,其中体积用V1、V2等表示)
| 物理量 实验序号 | 温度T(℃) | 导电率变化量∆S | … | |||
| 1 | a | b | ||||
| 2 | a | b |

您最近一年使用:0次
2022-10-09更新
|
275次组卷
|
3卷引用:广东省六校2022-2023学年高三上学期第二次联考化学试题
名校
6 . 用如图所示装置(夹持装置均已省略)进行实验能达到目的的是


| A.甲装置可检验溶液中是否有K+ | B.乙装置可验证浓硫酸的脱水性 |
C.丙装置可制备无水 | D.丁装置可制取并收集干燥、纯净的NO |
您最近一年使用:0次
2022-10-12更新
|
142次组卷
|
2卷引用:山东省潍坊五县市2022-2023学年高三上学期10月质量检测联考化学试题
名校
7 . 无水 是一种重要的化工原料,其熔点306℃、沸点316℃,易溶于水并且有强烈的吸水性,能吸收空气里的水分而潮解。一般采用低共熔混合物反应法(熔融法)制备高纯度的三氯化铁,其模拟反应装置如下:
是一种重要的化工原料,其熔点306℃、沸点316℃,易溶于水并且有强烈的吸水性,能吸收空气里的水分而潮解。一般采用低共熔混合物反应法(熔融法)制备高纯度的三氯化铁,其模拟反应装置如下:
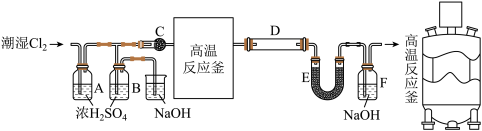
实验过程:在一个带有耐酸衬里的反应器中(即图中的高温反应釜),将70% 和30%KCl在600℃下共熔。再将铁屑溶解于共熔物中,再通入干燥氯气。反应生成的升华后导出,再经冷凝收集。
和30%KCl在600℃下共熔。再将铁屑溶解于共熔物中,再通入干燥氯气。反应生成的升华后导出,再经冷凝收集。
回答下列问题:
(1)C装置的名称为_______ ;
(2)当氯气通入时,A中有酸雾产生。为吸收酸雾,C中应盛放的物质为_______;(填字母)
(3)高温反应釜中发生反应的化学方程式为_______ ;
(4)E装置的作用为_______ ;
(5)为研究 的性质,某化学兴趣小组取一定质量的
的性质,某化学兴趣小组取一定质量的 (摩尔质量为
(摩尔质量为 )在惰性气体保护下受热分解时,所得固体产物的剩余质量分数(剩余质量与原样品质量的百分比)随温度变化的曲线如图所示。试利用图中信息并结合所学的知识,回答下列各问题:
)在惰性气体保护下受热分解时,所得固体产物的剩余质量分数(剩余质量与原样品质量的百分比)随温度变化的曲线如图所示。试利用图中信息并结合所学的知识,回答下列各问题:

已知:A为红褐色固体,B中含有三种元素,C为红棕色固体,D为黑色固体。
①固体产物的化学式B是_______ ,D是_______ ;
②由C得到D的化学方程式为_______ 。
 是一种重要的化工原料,其熔点306℃、沸点316℃,易溶于水并且有强烈的吸水性,能吸收空气里的水分而潮解。一般采用低共熔混合物反应法(熔融法)制备高纯度的三氯化铁,其模拟反应装置如下:
是一种重要的化工原料,其熔点306℃、沸点316℃,易溶于水并且有强烈的吸水性,能吸收空气里的水分而潮解。一般采用低共熔混合物反应法(熔融法)制备高纯度的三氯化铁,其模拟反应装置如下:
实验过程:在一个带有耐酸衬里的反应器中(即图中的高温反应釜),将70%
 和30%KCl在600℃下共熔。再将铁屑溶解于共熔物中,再通入干燥氯气。反应生成的升华后导出,再经冷凝收集。
和30%KCl在600℃下共熔。再将铁屑溶解于共熔物中,再通入干燥氯气。反应生成的升华后导出,再经冷凝收集。回答下列问题:
(1)C装置的名称为
(2)当氯气通入时,A中有酸雾产生。为吸收酸雾,C中应盛放的物质为_______;(填字母)
A. | B.CaO | C. | D.NaOH |
(4)E装置的作用为
(5)为研究
 的性质,某化学兴趣小组取一定质量的
的性质,某化学兴趣小组取一定质量的 (摩尔质量为
(摩尔质量为 )在惰性气体保护下受热分解时,所得固体产物的剩余质量分数(剩余质量与原样品质量的百分比)随温度变化的曲线如图所示。试利用图中信息并结合所学的知识,回答下列各问题:
)在惰性气体保护下受热分解时,所得固体产物的剩余质量分数(剩余质量与原样品质量的百分比)随温度变化的曲线如图所示。试利用图中信息并结合所学的知识,回答下列各问题:
已知:A为红褐色固体,B中含有三种元素,C为红棕色固体,D为黑色固体。
①固体产物的化学式B是
②由C得到D的化学方程式为
您最近一年使用:0次
2022-11-03更新
|
422次组卷
|
3卷引用:湖北省鄂东南联盟2022-2023学年高三上学期期中联考化学试题
8 . 以废旧铅酸电池中的含铅废料(Pb、PbO、PbO2、PbSO4及炭黑等)和H2SO4为原料,制备高纯PbO,实现铅的再生利用。其工作流程如下:

(1)铅是碳的同族元素,且比碳多4个电子层,则铅在元素周期表中位置___________
(2)过程Ⅰ中,在 催化下,Pb和
催化下,Pb和 反应生成
反应生成 的离子方程式是
的离子方程式是___________ 。
(3)过程Ⅰ中, 催化过程可表示为:
催化过程可表示为:
ⅰ: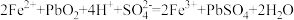
ⅱ:……
①写出ⅱ的化学方程式:___________ 。
②请设计实验方案可证实上述催化过程。将实验方案补充完整。
a.向酸化的 溶液中加入
溶液中加入___________ 溶液,溶液无颜色变化,再加入少量 ,溶液变为
,溶液变为___________ 色。
b.向a得到的溶液中加入Pb,溶液恢复原来的颜色。
(4)配制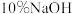 溶液时,所需玻璃仪器除量筒外还有
溶液时,所需玻璃仪器除量筒外还有___________ (填标号)。
A.容量瓶 B.烧杯 C.烧瓶 D.玻璃棒 E.胶头滴管
(5)锡与铅同族,锡及其化合物在生产、生活中有着重要的用途。已知:Sn的熔点为231℃;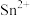 易水解、易被氧化;
易水解、易被氧化; 极易水解、熔点为-33℃、沸点为114℃。用于镀锡工业的硫酸亚锡(SnSO4)的制备路线如下:
极易水解、熔点为-33℃、沸点为114℃。用于镀锡工业的硫酸亚锡(SnSO4)的制备路线如下:

①骤Ⅰ加入Sn粉的作用:___________ 。
②步骤Ⅳ中检验 是否洗涤干净的操作是
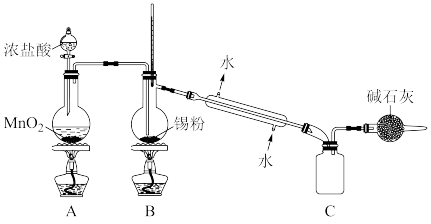
是否洗涤干净的操作是___________ ,证明已洗净。
③实验室欲用下图装置制备少量 (夹持装置略),该装置存在明显缺陷,改进方法是
(夹持装置略),该装置存在明显缺陷,改进方法是___________ ,装有碱石灰的球形干燥管的作用是___________ 。

(1)铅是碳的同族元素,且比碳多4个电子层,则铅在元素周期表中位置
(2)过程Ⅰ中,在
 催化下,Pb和
催化下,Pb和 反应生成
反应生成 的离子方程式是
的离子方程式是(3)过程Ⅰ中,
 催化过程可表示为:
催化过程可表示为:ⅰ:
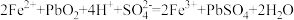
ⅱ:……
①写出ⅱ的化学方程式:
②请设计实验方案可证实上述催化过程。将实验方案补充完整。
a.向酸化的
 溶液中加入
溶液中加入 ,溶液变为
,溶液变为b.向a得到的溶液中加入Pb,溶液恢复原来的颜色。
(4)配制
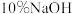 溶液时,所需玻璃仪器除量筒外还有
溶液时,所需玻璃仪器除量筒外还有A.容量瓶 B.烧杯 C.烧瓶 D.玻璃棒 E.胶头滴管
(5)锡与铅同族,锡及其化合物在生产、生活中有着重要的用途。已知:Sn的熔点为231℃;
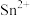 易水解、易被氧化;
易水解、易被氧化; 极易水解、熔点为-33℃、沸点为114℃。用于镀锡工业的硫酸亚锡(SnSO4)的制备路线如下:
极易水解、熔点为-33℃、沸点为114℃。用于镀锡工业的硫酸亚锡(SnSO4)的制备路线如下:
①骤Ⅰ加入Sn粉的作用:
②步骤Ⅳ中检验
 是否洗涤干净的操作是
是否洗涤干净的操作是③实验室欲用下图装置制备少量
 (夹持装置略),该装置存在明显缺陷,改进方法是
(夹持装置略),该装置存在明显缺陷,改进方法是
您最近一年使用:0次



