名校
解题方法
1 . NO、SO2是大气污染物但又有着重要用途。
I.已知:N2 (g) + O2(g) = 2NO (g) ΔH1=180.5kJ·mol−1
C(s) + O2(g) = CO2(g) ΔH2 = −393.5kJ·mol−1
2C(s) + O2(g) =2CO(g) ΔH3 =−221.0kJ·mol−1
(1)某反应的平衡常数表达式为K= , 此反应的热化学方程式为:
, 此反应的热化学方程式为:_________
(2)向绝热恒容密闭容器中充入等量的NO和CO进行反应,能判断反应已达到化学平衡状态的是_______ (填序号)。
a.容器中的压强不变 b.2v正(CO)=v逆(N2)
c.气体的平均相对分子质量保持34.2不变 d.该反应平衡常数保持不变
e.NO和CO的体积比保持不变
II.(3)SO2可用于制Na2S2O3。为探究某浓度的Na2S2O3的化学性质,某同学设计如下实验流程:
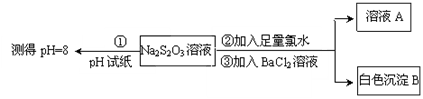
用离子方程式表示Na2S2O3溶液具有碱性的原因___________ 。Na2S2O3与氯水反应的离子方程式是__________ 。
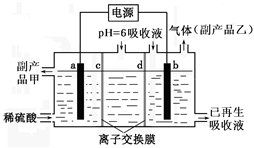
(4)含SO2的烟气可用Na2SO3溶液吸收。可将吸收液送至电解槽再生后循环使用。再生电解槽如图所示。a电极上含硫微粒放电的反应式为_________________________ (任写一个)。离子交换膜______ (填标号)为阴离子交换膜。
(5)2SO3(g) 2SO2(g)+O2(g),将一定量的SO3放入恒容的密闭容器中,测得其平衡转化率随温度变化如图所示。图中a点对应温度下,已知SO3的起始压强为P0,该温度下反应的平衡常数Kp=
2SO2(g)+O2(g),将一定量的SO3放入恒容的密闭容器中,测得其平衡转化率随温度变化如图所示。图中a点对应温度下,已知SO3的起始压强为P0,该温度下反应的平衡常数Kp= _______ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。在该温度下达到平衡,再向容器中加入等物质的量SO2和SO3,平衡将___________ (填“向正反应方向”或“向逆反应方向” “不”) 移动。

I.已知:N2 (g) + O2(g) = 2NO (g) ΔH1=180.5kJ·mol−1
C(s) + O2(g) = CO2(g) ΔH2 = −393.5kJ·mol−1
2C(s) + O2(g) =2CO(g) ΔH3 =−221.0kJ·mol−1
(1)某反应的平衡常数表达式为K=
 , 此反应的热化学方程式为:
, 此反应的热化学方程式为:(2)向绝热恒容密闭容器中充入等量的NO和CO进行反应,能判断反应已达到化学平衡状态的是
a.容器中的压强不变 b.2v正(CO)=v逆(N2)
c.气体的平均相对分子质量保持34.2不变 d.该反应平衡常数保持不变
e.NO和CO的体积比保持不变
II.(3)SO2可用于制Na2S2O3。为探究某浓度的Na2S2O3的化学性质,某同学设计如下实验流程:

用离子方程式表示Na2S2O3溶液具有碱性的原因
(4)含SO2的烟气可用Na2SO3溶液吸收。可将吸收液送至电解槽再生后循环使用。再生电解槽如图所示。a电极上含硫微粒放电的反应式为

(5)2SO3(g)
 2SO2(g)+O2(g),将一定量的SO3放入恒容的密闭容器中,测得其平衡转化率随温度变化如图所示。图中a点对应温度下,已知SO3的起始压强为P0,该温度下反应的平衡常数Kp=
2SO2(g)+O2(g),将一定量的SO3放入恒容的密闭容器中,测得其平衡转化率随温度变化如图所示。图中a点对应温度下,已知SO3的起始压强为P0,该温度下反应的平衡常数Kp= 
您最近一年使用:0次
2018-06-13更新
|
1114次组卷
|
3卷引用:【全国百强校】福建省厦门外国语学校2018届高三下学期5月适应性考试(最后压轴模拟)理综-化学试题
解题方法
2 . H2O2在工业、农业、医药上都有广泛的用途.
(1)H2O2是二元弱酸,写出第一步的电离方程式__ ,第二步的电离平衡常数表达式Ka2=_________ .
(2)许多物质都可以做H2O2分解的催化剂.一种观点认为:在反应过程中催化剂先被H2O2氧化(或还原),后又被H2O2还原(或氧化).下列物质都可做H2O2分解的催化剂,在反应过程中先被氧化,后被还原的是________ .
①I - ②Fe3+ ③Cu2+ ④Fe2+
(3)H2O2是一种环境友好的强氧化剂.电镀废水(主要含Cu2+、Ni2+,还含少量Fe3+、Fe2+、Cr3+等)制备硫酸镍的一种流程如下:

①第(ⅰ)步,加入H2O2反应的离子方程式_________________ .
②为测定NiSO4•nH2O的组成,进行如下实验:称取2.627g样品,配制成250.00mL溶液.准确量取配制的溶液25.00mL,用0.04000mol•L﹣1的EDTA(Na2H2Y)标准溶液滴定Ni2+(离子方程式为Ni2++H2Y2﹣=NiY2﹣+2H+),消耗EDTA标准溶液25.00mL.则硫酸镍晶体的化学式为__________________ .
(1)H2O2是二元弱酸,写出第一步的电离方程式
(2)许多物质都可以做H2O2分解的催化剂.一种观点认为:在反应过程中催化剂先被H2O2氧化(或还原),后又被H2O2还原(或氧化).下列物质都可做H2O2分解的催化剂,在反应过程中先被氧化,后被还原的是
①I - ②Fe3+ ③Cu2+ ④Fe2+
(3)H2O2是一种环境友好的强氧化剂.电镀废水(主要含Cu2+、Ni2+,还含少量Fe3+、Fe2+、Cr3+等)制备硫酸镍的一种流程如下:

①第(ⅰ)步,加入H2O2反应的离子方程式
②为测定NiSO4•nH2O的组成,进行如下实验:称取2.627g样品,配制成250.00mL溶液.准确量取配制的溶液25.00mL,用0.04000mol•L﹣1的EDTA(Na2H2Y)标准溶液滴定Ni2+(离子方程式为Ni2++H2Y2﹣=NiY2﹣+2H+),消耗EDTA标准溶液25.00mL.则硫酸镍晶体的化学式为
您最近一年使用:0次
名校
3 . NH4Al(SO4)2在食品、医药电子工业中用途广泛。回答下列问题:
(1)NH4Al(SO4)2可做净水剂,其理由是_______________ (用离子方程式表示)。
(2)相同条件下,c(NH4+)相等的NH4Al(SO4)2 和NH4HSO4溶液,其物质的量浓度较大的是_________________ 。
(3)下图是0.1 mol∙L-1 电解质溶液的pH 随温度变化的图象。
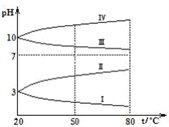
① 其中符合 0.1 mol∙L-1 NH4Al(SO4)2 溶液的是(填字母)___________ 。导致溶液 pH 随温度变化的原因是___________ 。
② 20℃时,0.1 mol∙L-1 NH4Al(SO4)2溶液中,2c(SO42-)-c(NH4+)-3c(Al3+)=______ mol∙L-1。
(4)室温时,向 0.1 mol∙L-1 NH4Al(SO4)2 溶液中滴加0.1 mol∙L-1 NaOH 溶液,得到溶液pH与NaOH溶液体积关系曲线如下图所示:
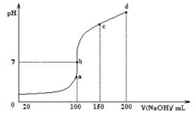
①已知:Ksp[Al(OH)3]=1×10-32 ,Al3+沉淀完全时,溶液的 pH=________
②试分析图中a、b、c、d四点,水的电离程度最大的是________ 。
③b-c段随着NaOH的加入,溶液中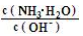 的值
的值_______ (填“增大”、“减小”或“不变”)。
(1)NH4Al(SO4)2可做净水剂,其理由是
(2)相同条件下,c(NH4+)相等的NH4Al(SO4)2 和NH4HSO4溶液,其物质的量浓度较大的是
(3)下图是0.1 mol∙L-1 电解质溶液的pH 随温度变化的图象。

① 其中符合 0.1 mol∙L-1 NH4Al(SO4)2 溶液的是(填字母)
② 20℃时,0.1 mol∙L-1 NH4Al(SO4)2溶液中,2c(SO42-)-c(NH4+)-3c(Al3+)=
(4)室温时,向 0.1 mol∙L-1 NH4Al(SO4)2 溶液中滴加0.1 mol∙L-1 NaOH 溶液,得到溶液pH与NaOH溶液体积关系曲线如下图所示:

①已知:Ksp[Al(OH)3]=1×10-32 ,Al3+沉淀完全时,溶液的 pH=
②试分析图中a、b、c、d四点,水的电离程度最大的是
③b-c段随着NaOH的加入,溶液中
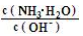 的值
的值
您最近一年使用:0次
名校
解题方法
4 . NH4Al(SO4)2是一种食品添加剂,用于焙烤食品;NH4HSO4在分析化学、制药工业中用途广泛。请回答下列问题:
(1)NH4Al(SO4)2可作净水剂,其理由是___________________________________________________ (用必要的化学用语和相关文字说明)。
(2)相同温度下,浓度均为0.1 mol/L 的下列溶液中的c( )由大到小
)由大到小_____ (填序号)。
①NH4Al(SO4)2 ②CH3COONH4 ③ NH4HSO4 ④NH3·H2O ⑤NH4Cl
(3)如图1是0.1 mol/L电解质溶液的pH随温度变化的图象。其中符合0.1 mol/L NH4Al(SO4)2溶液的pH随温度变化的曲线是_____ (填写字母)。
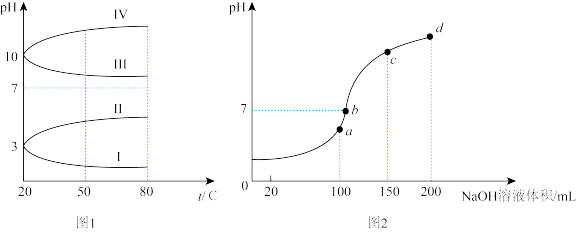
(4)室温时,向100 mL 0.1 mol/L的NH4HSO4溶液中滴加0.1 mol/L NaOH溶液,所得溶液的pH与所加NaOH溶液体积的关系曲线如图2所示。试分析图中a、b、c、d四个点,水的电离程度最大的是_____ ;在b点,溶液中各离子浓度由大到小的排列顺序是______ ;在cd段发生反应的离子方程式________________ 。
(1)NH4Al(SO4)2可作净水剂,其理由是
(2)相同温度下,浓度均为0.1 mol/L 的下列溶液中的c(
 )由大到小
)由大到小①NH4Al(SO4)2 ②CH3COONH4 ③ NH4HSO4 ④NH3·H2O ⑤NH4Cl
(3)如图1是0.1 mol/L电解质溶液的pH随温度变化的图象。其中符合0.1 mol/L NH4Al(SO4)2溶液的pH随温度变化的曲线是

(4)室温时,向100 mL 0.1 mol/L的NH4HSO4溶液中滴加0.1 mol/L NaOH溶液,所得溶液的pH与所加NaOH溶液体积的关系曲线如图2所示。试分析图中a、b、c、d四个点,水的电离程度最大的是
您最近一年使用:0次
2018-02-06更新
|
326次组卷
|
3卷引用:福建师大附中2017-2018学年高二上学期期末考试化学(理)试题
名校
5 . (一)某学生为测定未知浓度的硫酸溶液(已知滴定时供选择的指示剂有石蕊、酚酞),实验如下:用1.00mL待测硫酸配制100mL稀H2SO4溶液;以0.14mol•L﹣1的NaOH溶液滴定上述稀H2SO4 25.00mL,滴定终止时消耗NaOH溶液15.00mL。
(1)该学生用标准0.14mol•L﹣1NaOH溶液滴定硫酸的实验操作如下:
A.用酸式滴定管取稀H2SO4 25.00mL,注入锥形瓶中,加入指示剂。
B.用待测定的溶液润洗酸式滴定管
C.用蒸馏水洗干净滴定管
D.取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管刻度“0”以上2~3cm处,再把碱式滴定管固定好,调节液面至刻度“0”或“0”刻度以下
E.检查滴定管是否漏水 F.另取锥形瓶,再重复操作一次
G.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度
①该滴定操作中应选用的指示剂是__________ 。
②酸式滴定管用蒸馏水润洗后,未用待测液润洗导致滴定结果(填“偏小”、“偏大”或“恰好合适”)__________ 。
(2)配制准确浓度的稀H2SO4溶液,必须使用的主要容器是___________________ 。
(3)用标准NaOH溶液滴定时,应将标准NaOH溶液注入________ (填“甲”或“乙”)中。
(4)观察碱式滴定管读数时,若滴定前仰视,滴定后俯视,则结果会导致测得的稀H2SO4溶液浓度测定值___________ (选填“偏大”“偏小”或“无影响”)。
(5)计算待测硫酸(稀释前的硫酸)溶液的物质的量浓度_____ (计算 结果到小数点后二位)。
(二)NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品中;NH4HSO4在分析试剂、医药、电子工业中用途广泛。请回答下列问题:
(1)相同条件下,0.1 mol·L-1NH4Al(SO4)2中c(NH4+)________ (填“等于”、“大于”或“小于”)0.1 mol·L-1NH4HSO4中c(NH4+)。
(2)如图是0.1 mol·L-1该溶液pH随温度变化的图象。
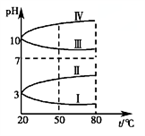
①其中符合0.1 mol·L-1NH4Al(SO4)2的pH随温度变化的曲线是________ (填写字母)
②20 ℃时,0.1 mol·L-1 NH4Al(SO4)2中2c(SO42-)-c(NH4+)-3c(Al3+)≈________ 。(用具体数值表示)
(3)室温时,向100 mL 0.1 mol·L-1NH4HSO4溶液中滴加0.1 mol·L-1 NaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示:

试分析图中b点溶液中各离子浓度由大到小的排列顺序是______________________ 。
(1)该学生用标准0.14mol•L﹣1NaOH溶液滴定硫酸的实验操作如下:
A.用酸式滴定管取稀H2SO4 25.00mL,注入锥形瓶中,加入指示剂。
B.用待测定的溶液润洗酸式滴定管
C.用蒸馏水洗干净滴定管
D.取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管刻度“0”以上2~3cm处,再把碱式滴定管固定好,调节液面至刻度“0”或“0”刻度以下
E.检查滴定管是否漏水 F.另取锥形瓶,再重复操作一次
G.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度
①该滴定操作中应选用的指示剂是
②酸式滴定管用蒸馏水润洗后,未用待测液润洗导致滴定结果(填“偏小”、“偏大”或“恰好合适”)
(2)配制准确浓度的稀H2SO4溶液,必须使用的主要容器是
(3)用标准NaOH溶液滴定时,应将标准NaOH溶液注入

(4)观察碱式滴定管读数时,若滴定前仰视,滴定后俯视,则结果会导致测得的稀H2SO4溶液浓度测定值
(5)计算待测硫酸(稀释前的硫酸)溶液的物质的量浓度
(二)NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品中;NH4HSO4在分析试剂、医药、电子工业中用途广泛。请回答下列问题:
(1)相同条件下,0.1 mol·L-1NH4Al(SO4)2中c(NH4+)
(2)如图是0.1 mol·L-1该溶液pH随温度变化的图象。

①其中符合0.1 mol·L-1NH4Al(SO4)2的pH随温度变化的曲线是
②20 ℃时,0.1 mol·L-1 NH4Al(SO4)2中2c(SO42-)-c(NH4+)-3c(Al3+)≈
(3)室温时,向100 mL 0.1 mol·L-1NH4HSO4溶液中滴加0.1 mol·L-1 NaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示:

试分析图中b点溶液中各离子浓度由大到小的排列顺序是
您最近一年使用:0次
名校
解题方法
6 . 锡及其化合物在生产、生活中有着重要的用途。已知:Sn的熔点为231℃;Sn2+易水解、易被氧化;SnCl4极易水解、熔点为-33℃、沸点为114℃。
2H++SnO22- Sn(OH)2
Sn(OH)2 Sn2++2OH-
Sn2++2OH-
请按要求回答下列相关问题:
(1)元素锡比同主族碳的周期数大3,锡的原子序数为_______ 。
(2)用于微电子器件生产的锡粉纯度测定:
① 取1.19g试样溶于稀硫酸中(杂质不参与反应),使Sn完全转化为Sn2+;
② 加入过量的Fe2(SO4)3;③ 用0.1000 mol/LK2Cr2O7溶液滴定(产物中Cr呈+3价),消耗20.00 mL。
步骤② 中加入Fe2(SO4)3的作用是_______ ;此锡粉样品中锡的质量分数________ 。
(3)用于镀锡工业的硫酸亚锡(SnSO4)的制备路线如图所示:
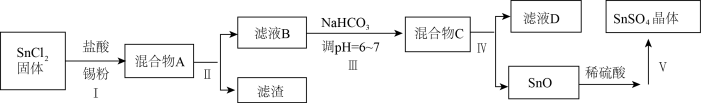
① 步骤I加入Sn粉的作用:___________ 及调节溶液pH。
② 步骤Ⅲ生成SnO的离子方程式:____________________ 。
③ 以锡单质为阳极,铁片为阴极,SnSO4溶液为电解质溶液,在铁片上镀锡,阴极反应式是____________ ,镀锡铁破损后在潮湿的环境中容易发生腐蚀的原因是_________ ,若是在较弱的酸性环境中发生腐蚀,正极反应式是____________ 。
(4)SnCl4蒸气遇水汽呈浓烟状,因而叮制作烟幕弹, 其反应的化学方程式为___________ 。
(5)锡的+2价化合物应具有较强的还原性,已知Sn2+的还原性比 Fe2+的还原性强,PbO2的氧化性比Cl2的氧化性强。试写出下列反应的化学方程式:
① 将SnCl4溶液蒸干灼烧得到的固体物质是________ ;
② 若用SnCl2溶液与过量的碱溶液反应制Sn(OH)2,该碱溶液可选用________ 。
2H++SnO22-
 Sn(OH)2
Sn(OH)2 Sn2++2OH-
Sn2++2OH-请按要求回答下列相关问题:
(1)元素锡比同主族碳的周期数大3,锡的原子序数为
(2)用于微电子器件生产的锡粉纯度测定:
① 取1.19g试样溶于稀硫酸中(杂质不参与反应),使Sn完全转化为Sn2+;
② 加入过量的Fe2(SO4)3;③ 用0.1000 mol/LK2Cr2O7溶液滴定(产物中Cr呈+3价),消耗20.00 mL。
步骤② 中加入Fe2(SO4)3的作用是
(3)用于镀锡工业的硫酸亚锡(SnSO4)的制备路线如图所示:

① 步骤I加入Sn粉的作用:
② 步骤Ⅲ生成SnO的离子方程式:
③ 以锡单质为阳极,铁片为阴极,SnSO4溶液为电解质溶液,在铁片上镀锡,阴极反应式是
(4)SnCl4蒸气遇水汽呈浓烟状,因而叮制作烟幕弹, 其反应的化学方程式为
(5)锡的+2价化合物应具有较强的还原性,已知Sn2+的还原性比 Fe2+的还原性强,PbO2的氧化性比Cl2的氧化性强。试写出下列反应的化学方程式:
① 将SnCl4溶液蒸干灼烧得到的固体物质是
② 若用SnCl2溶液与过量的碱溶液反应制Sn(OH)2,该碱溶液可选用
您最近一年使用:0次
2017-05-15更新
|
706次组卷
|
2卷引用:2017年高考信息卷(二)(全国卷I)理科综合化学试题
名校
7 . NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品中;NH4HSO4在分析试剂、医药、电子工业中用途广泛。请回答下列问题:

(1)NH4Al(SO4)2可作净水剂,其理由是_________________________ (用必要的化学用语和相关文字说明)。
(2)如图1是0.1 mol·L-1电解质溶液的pH随温度变化的图象。
①其中符合0.1 mol·L-1NH4Al(SO4)2的pH随温度变化的曲线是_______________ (填写字母),导致pH随温度变化的原因是________________ ;
②NH4Al(SO4)2饱和溶液与NH4HCO3饱和溶液混合,反应的离子方程式为________________ 。(3)室温时,向100 mL 0.1mol·L-1NH4HSO4溶液中滴加0.1mol·L-1NaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示:试分析图中a、b、c、d四个点,水的电离程度由大到小顺序为是______________ ;在b点,溶液中各离子浓度由大到小的排列顺序是__________ 。
(4)已知25℃,NH3·H2O的Kb=1.8×10-5,H2SO3的Ka1=1.3×10-2,K2=6.2×10-8。将SO2通入该氨水中,当c(OH-)降至1.0×10-7mol·L-1时,溶液中的c(SO32-)/c(HSO3-)=____________ 。
(5)①25℃时,Ka(HCN)=4.9×10-10,Ka(CH3COOH)=1.8×10-5,H2CO3:K1=4.3×10-7、K2=5.6×10-11,25℃有pH 相等的NaCN 溶液、Na2CO3溶液、CH3COONa 溶液,三溶液的物质的量浓变由大到小的顺序为_________________ 。
②向NaCN 溶液中通入少量CO2 ,所发生反应的化学方程式为:__________________ 。

(1)NH4Al(SO4)2可作净水剂,其理由是
(2)如图1是0.1 mol·L-1电解质溶液的pH随温度变化的图象。
①其中符合0.1 mol·L-1NH4Al(SO4)2的pH随温度变化的曲线是
②NH4Al(SO4)2饱和溶液与NH4HCO3饱和溶液混合,反应的离子方程式为
(4)已知25℃,NH3·H2O的Kb=1.8×10-5,H2SO3的Ka1=1.3×10-2,K2=6.2×10-8。将SO2通入该氨水中,当c(OH-)降至1.0×10-7mol·L-1时,溶液中的c(SO32-)/c(HSO3-)=
(5)①25℃时,Ka(HCN)=4.9×10-10,Ka(CH3COOH)=1.8×10-5,H2CO3:K1=4.3×10-7、K2=5.6×10-11,25℃有pH 相等的NaCN 溶液、Na2CO3溶液、CH3COONa 溶液,三溶液的物质的量浓变由大到小的顺序为
②向NaCN 溶液中通入少量CO2 ,所发生反应的化学方程式为:
您最近一年使用:0次



