解题方法
1 . 铜及其化合物在工业生产上有许多用途。某工厂以辉铜矿(主要成分为 ,含少量
,含少量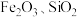 等杂质)为原料制备不溶于水的碱式碳酸铜的流程如下。下列说法错误的是
等杂质)为原料制备不溶于水的碱式碳酸铜的流程如下。下列说法错误的是
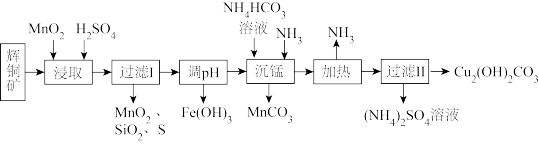
 ,含少量
,含少量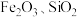 等杂质)为原料制备不溶于水的碱式碳酸铜的流程如下。下列说法错误的是
等杂质)为原料制备不溶于水的碱式碳酸铜的流程如下。下列说法错误的是| 常温下几种物质沉淀pH表 | |||
| 金属离子 |  |  |  |
| 开始沉淀 | 2.7 | 5.6 | 8.3 |
| 完全沉淀 | 3.7 | 6.7 | 9.8 |

| A.“浸取”过程生成的S为氧化产物 |
| B.“调pH”过程需要将溶液调至碱性 |
C.“沉锰”过程中反应的离子方程式为: |
D.“加热”过程排出的 可以通入“沉锰”过程循环利用 可以通入“沉锰”过程循环利用 |
您最近一年使用:0次
2 . 焦亚硫酸 用途广泛,是常见的漂白剂、疏松剂、食品抗氧化剂,某研究性学习小组探究焦亚硫酸钠的制取以及其性质。请回答下列问题:
用途广泛,是常见的漂白剂、疏松剂、食品抗氧化剂,某研究性学习小组探究焦亚硫酸钠的制取以及其性质。请回答下列问题:
Ⅰ.制备、收集干燥的
(1)实验室制取 的试剂是
的试剂是________  填字母
填字母 。
。
①
 溶液 ②
溶液 ②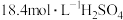 溶液 ③
溶液 ③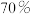 的
的 溶液 ④
溶液 ④ 固体 ⑤
固体 ⑤ 固体
固体
A.①④ B.②④ C.②③ D.③⑤
(2)实验室制取 的化学方程式为
的化学方程式为_______________________ 。
按气流方向连接各仪器
________ 
________ 
________ 
________ 
________ 
Ⅱ.焦亚硫酸钠的制取
①在搅拌的条件下,向饱和碳酸钠溶液中通入SO2至反应液的 ;
;
②将溶液蒸发浓缩、结晶、离心分离,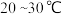 干燥得到成品。
干燥得到成品。
(3)SO2与 溶液反应生成
溶液反应生成 和
和 的化学方程式为
的化学方程式为_______________________ 。
 溶液的pH小于7,说明
溶液的pH小于7,说明 的电离程度大于其水解程度,溶液中
的电离程度大于其水解程度,溶液中
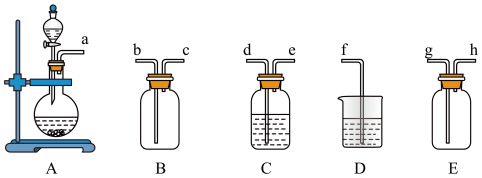
________ 。(25℃时,亚硫酸的电离平衡常数为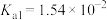 ,
,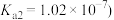
Ⅲ 焦亚硫酸钠的性质
焦亚硫酸钠的性质
(4)N2S2O5作脱氧剂时的反应原理为: ,该反应中,氧化产物是
,该反应中,氧化产物是________ ,检验 晶体作脱氧剂时已被氧化的实验方案是
晶体作脱氧剂时已被氧化的实验方案是______________________________________________________ 。
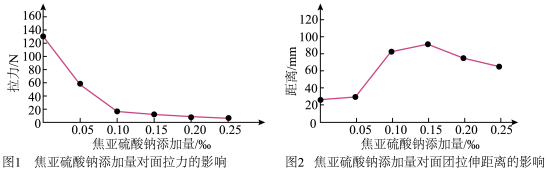
(5)适当加入 使面团变得柔软,面团延伸性增加,拉断面团所需的拉力也逐渐减少,过度加入
使面团变得柔软,面团延伸性增加,拉断面团所需的拉力也逐渐减少,过度加入 会严重破坏蛋白质网络结构,面团变得稀软、发黏、延伸性下降,如图所示。综合来说,当添加量为
会严重破坏蛋白质网络结构,面团变得稀软、发黏、延伸性下降,如图所示。综合来说,当添加量为________  填字母序号
填字母序号 时,面团延伸性较好。
时,面团延伸性较好。
A.0~0.05‰ B.0.05‰~0.1‰ C.0.10‰~0.15‰ D.0.20‰~0.25‰
 用途广泛,是常见的漂白剂、疏松剂、食品抗氧化剂,某研究性学习小组探究焦亚硫酸钠的制取以及其性质。请回答下列问题:
用途广泛,是常见的漂白剂、疏松剂、食品抗氧化剂,某研究性学习小组探究焦亚硫酸钠的制取以及其性质。请回答下列问题:Ⅰ.制备、收集干燥的

(1)实验室制取
 的试剂是
的试剂是 填字母
填字母 。
。①

 溶液 ②
溶液 ②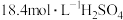 溶液 ③
溶液 ③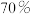 的
的 溶液 ④
溶液 ④ 固体 ⑤
固体 ⑤ 固体
固体A.①④ B.②④ C.②③ D.③⑤
(2)实验室制取
 的化学方程式为
的化学方程式为按气流方向连接各仪器







Ⅱ.焦亚硫酸钠的制取
①在搅拌的条件下,向饱和碳酸钠溶液中通入SO2至反应液的
 ;
;②将溶液蒸发浓缩、结晶、离心分离,
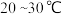 干燥得到成品。
干燥得到成品。(3)SO2与
 溶液反应生成
溶液反应生成 和
和 的化学方程式为
的化学方程式为 溶液的pH小于7,说明
溶液的pH小于7,说明 的电离程度大于其水解程度,溶液中
的电离程度大于其水解程度,溶液中
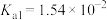 ,
,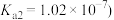
Ⅲ
 焦亚硫酸钠的性质
焦亚硫酸钠的性质(4)N2S2O5作脱氧剂时的反应原理为:
 ,该反应中,氧化产物是
,该反应中,氧化产物是 晶体作脱氧剂时已被氧化的实验方案是
晶体作脱氧剂时已被氧化的实验方案是(5)适当加入
 使面团变得柔软,面团延伸性增加,拉断面团所需的拉力也逐渐减少,过度加入
使面团变得柔软,面团延伸性增加,拉断面团所需的拉力也逐渐减少,过度加入 会严重破坏蛋白质网络结构,面团变得稀软、发黏、延伸性下降,如图所示。综合来说,当添加量为
会严重破坏蛋白质网络结构,面团变得稀软、发黏、延伸性下降,如图所示。综合来说,当添加量为 填字母序号
填字母序号 时,面团延伸性较好。
时,面团延伸性较好。A.0~0.05‰ B.0.05‰~0.1‰ C.0.10‰~0.15‰ D.0.20‰~0.25‰

您最近一年使用:0次
名校
3 . NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烧食品中;NH4HSO4在分析试剂、医药、电子工业中用途认识广泛。请回答下列问题:
(1)NH4Al(SO4)2可作净水剂,其理由是__ (用必要的化学用语和相关文字说明)。
(2)相同条件下,0.1mol·L-1NH4Al(SO4)2中c(NH4+)__ (填“等于”“大于”或“小于”)0.1mol·L-1NH4HSO4中c(NH4+)。
(3)20℃时,0.1mol·L-1NH4Al(SO4)2中2c(SO42-)-c(NH4+)-3c(Al3+)=__ (表达式)。
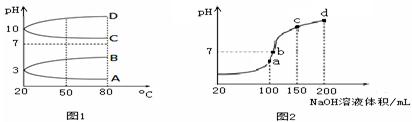
(4)室温时,向100mL0.1mol·L-1NH4HSO4溶液中滴加0.1mol·L-1NaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示。

试分析图中a、b、c、d四个点,水的电离程度最大的是___ 点;在b点,溶液中各离子浓度由大到小的排列顺序是___ 。
(1)NH4Al(SO4)2可作净水剂,其理由是
(2)相同条件下,0.1mol·L-1NH4Al(SO4)2中c(NH4+)
(3)20℃时,0.1mol·L-1NH4Al(SO4)2中2c(SO42-)-c(NH4+)-3c(Al3+)=
(4)室温时,向100mL0.1mol·L-1NH4HSO4溶液中滴加0.1mol·L-1NaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示。

试分析图中a、b、c、d四个点,水的电离程度最大的是
您最近一年使用:0次
名校
解题方法
4 . NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品;NH4HSO4在分析试剂、医药、电子工业中用途广泛。请回答下列问题:

(1)相同条件下,0.1 mol·L-1NH4Al(SO4)2溶液中c((NH4+)_________ (填“等于”、“大于”或“小于”) 0.1 mol·L-1NH4HSO4溶液中c(NH4+)
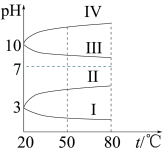
(2)如图1是0.1 mol·L-1电解质溶液的pH随温度变化的图象。
①其中符合0.1 mol·L-1NH4Al(SO4)2溶液的pH随温度变化的曲线是______ (填字母)。
②室温时,0.1 mol·L-1NH4Al(SO4)2溶液中2c(SO42-)- c(NH4+)-3c(Al3+)=________ mol·L-1
(3)室温时,向100 mL 0.1 mol·L-1NH4HSO4溶液中滴加0.1 mol·L-1NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图2所示。 试分析图中a、b、c、d四个点,水的电离程度最大的是____________ ; 在b点,溶液中各离子浓度由大到小的排列顺序是___________________ 。
(4)用0.1mol/LNaOH溶液滴定盐酸溶液,下列操作中使结果偏高的是___________________
A.盛标准溶液的滴定管用蒸馏水洗涤后未用标准液润洗就装液滴定
B.锥形瓶用蒸馏水洗涤后未用待测液润洗
C.读取标准液读数时,滴定前平视,滴定到终点后俯视
D.滴定前盛标准液的滴定管尖嘴处有气泡未排除,滴定后气泡消失

(1)相同条件下,0.1 mol·L-1NH4Al(SO4)2溶液中c((NH4+)
(2)如图1是0.1 mol·L-1电解质溶液的pH随温度变化的图象。
①其中符合0.1 mol·L-1NH4Al(SO4)2溶液的pH随温度变化的曲线是
②室温时,0.1 mol·L-1NH4Al(SO4)2溶液中2c(SO42-)- c(NH4+)-3c(Al3+)=
(3)室温时,向100 mL 0.1 mol·L-1NH4HSO4溶液中滴加0.1 mol·L-1NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图2所示。 试分析图中a、b、c、d四个点,水的电离程度最大的是
(4)用0.1mol/LNaOH溶液滴定盐酸溶液,下列操作中使结果偏高的是
A.盛标准溶液的滴定管用蒸馏水洗涤后未用标准液润洗就装液滴定
B.锥形瓶用蒸馏水洗涤后未用待测液润洗
C.读取标准液读数时,滴定前平视,滴定到终点后俯视
D.滴定前盛标准液的滴定管尖嘴处有气泡未排除,滴定后气泡消失
您最近一年使用:0次
2020-01-16更新
|
86次组卷
|
2卷引用:黑龙江省大庆市铁人中学2019-2020学年高二上学期期末考试化学试题
解题方法
5 . 氨是重要的工业原料,在农业、医药、国防和化工等领域有重要应用;NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品;NH4HSO4在分析试剂、医药、电子工业中用途广泛。回答下列问题:
(1)NH4Al(SO4)2可用作做净水剂的原因是________ (用离子方程式表示)。
(2)相同条件下,0.1 mol·L-1NH4Al(SO4)2中c(NH )
)________ 0.1 mol·L-1NH4HSO4中c(NH )。(填“>”“<”或“=”)
)。(填“>”“<”或“=”)
(3)图所示是0.1 mol·L-1电解质溶液的pH随温度变化的图象。图中符合0.1 mol·L-1 NH4Al(SO4)2溶液的pH随温度变化的曲线是________ (填序号);20 ℃时,0.1 mol·L-1 NH4Al(SO4)2溶液中2 c(SO )-c(NH
)-c(NH )-3 c(Al3+)=
)-3 c(Al3+)=_____ mol·L-1。

(4)若液氨中也存在类似水的电离(H2O+H2O⇌H3O++OH-),碳酸钠溶于液氨后也能发生完全电离和类似水解的氨解。
①液氨的电离方程式为________ 。
②碳酸钠的液氨溶液中各离子浓度的大小关系为_____ 。
(1)NH4Al(SO4)2可用作做净水剂的原因是
(2)相同条件下,0.1 mol·L-1NH4Al(SO4)2中c(NH
 )
) )。(填“>”“<”或“=”)
)。(填“>”“<”或“=”)(3)图所示是0.1 mol·L-1电解质溶液的pH随温度变化的图象。图中符合0.1 mol·L-1 NH4Al(SO4)2溶液的pH随温度变化的曲线是
 )-c(NH
)-c(NH )-3 c(Al3+)=
)-3 c(Al3+)=
(4)若液氨中也存在类似水的电离(H2O+H2O⇌H3O++OH-),碳酸钠溶于液氨后也能发生完全电离和类似水解的氨解。
①液氨的电离方程式为
②碳酸钠的液氨溶液中各离子浓度的大小关系为
您最近一年使用:0次
名校
解题方法
6 . 氯化亚铜(CuCl)是用途广泛的化工产品,其露置于空气中易被氧化。某兴趣小组高温加热分解氯化铜晶体(CuCl2·xH2O)制备CuCl,其装置如图(加热仪器、夹持仪器省略):
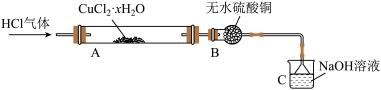
回答下列问题:
(1)通入HCl气体的作用是_______ 。
(2)硬质玻璃管A中主要发生反应的化学方程式为_______ 。

回答下列问题:
(1)通入HCl气体的作用是
(2)硬质玻璃管A中主要发生反应的化学方程式为
您最近一年使用:0次
19-20高二上·江西南昌·阶段练习
解题方法
7 . NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品中;NH4HSO4在分析试剂、医药、电子工业中用途广泛。请回答下列问题:
(1)NH4Al(SO4)2可作净水剂,其理由是____ (用必要的化学用语和相关文字说明)。
(2)如图是0.1mol·L-1电解质溶液的pH随温度变化的图象:

①中符合0.1 mol·L-1NH4Al(SO4)2的pH随温度变化的曲线是___ (填写字母)。
②20℃时,0.1mol/L NH4Al(SO4)2中2c(SO4 2−)−c(NH4+)−3c(Al3+)=___ 。
(3)室温时,向100mL 0.1mol/L NH4HSO4溶液中滴加0.1mol/L NaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示:

试分析图中a、b、c、d四个点,水的电离程度最大的是___ ;在b点,溶液中各离子浓度由大到小的排列顺序是___ 。
(1)NH4Al(SO4)2可作净水剂,其理由是
(2)如图是0.1mol·L-1电解质溶液的pH随温度变化的图象:

①中符合0.1 mol·L-1NH4Al(SO4)2的pH随温度变化的曲线是
②20℃时,0.1mol/L NH4Al(SO4)2中2c(SO4 2−)−c(NH4+)−3c(Al3+)=
(3)室温时,向100mL 0.1mol/L NH4HSO4溶液中滴加0.1mol/L NaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示:

试分析图中a、b、c、d四个点,水的电离程度最大的是
您最近一年使用:0次
18-19高二上·广东·期末
名校
8 . NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品中;NH4HSO4在分析试剂、医药、电子工业中用途广泛。请回答下列问题:
(1)NH4Al(SO4)2可作净水剂,其理由是_________________________________________  用离子方程式说明
用离子方程式说明 。
。
(2)相同条件下,0.1mol/L NH4Al(SO4)2中c(NH4+)_________ 0.1mol/L NH4HSO4(填“等于”、“大于”或“小于”中c(NH4+)。
(3)如图1是0.1mol/L电解质溶液的pH随温度变化的图象。
①其中符合0.1mol/L NH4Al(SO4)2的pH随温度变化的曲线是________  填写字母
填写字母 ;
;
②NH4Al(SO4)2溶液中,电荷守恒的表达式为:_________
(4)室温时,向100mL 0.1mol/L NH4HSO4溶液中滴加0.1mol/L NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图2所示。试分析图中a、b、c、d四个点,水的电离程度最大的是______ ;在b点,溶液中各离子浓度由大到小的排列顺序是_________
(5)已知Al(OH)3为难溶物 常温下,Ksp[Al(OH)3]=2.0×10-33。当溶液pH=5时,某溶液中的Al3+
常温下,Ksp[Al(OH)3]=2.0×10-33。当溶液pH=5时,某溶液中的Al3+____  填“能”或“不能”
填“能”或“不能” 完全沉淀
完全沉淀 溶液中的离子浓度小于1.0×10-5mol/L时,沉淀完全
溶液中的离子浓度小于1.0×10-5mol/L时,沉淀完全 。
。

(1)NH4Al(SO4)2可作净水剂,其理由是
 用离子方程式说明
用离子方程式说明 。
。(2)相同条件下,0.1mol/L NH4Al(SO4)2中c(NH4+)
(3)如图1是0.1mol/L电解质溶液的pH随温度变化的图象。
①其中符合0.1mol/L NH4Al(SO4)2的pH随温度变化的曲线是
 填写字母
填写字母 ;
;②NH4Al(SO4)2溶液中,电荷守恒的表达式为:
(4)室温时,向100mL 0.1mol/L NH4HSO4溶液中滴加0.1mol/L NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图2所示。试分析图中a、b、c、d四个点,水的电离程度最大的是
(5)已知Al(OH)3为难溶物
 常温下,Ksp[Al(OH)3]=2.0×10-33。当溶液pH=5时,某溶液中的Al3+
常温下,Ksp[Al(OH)3]=2.0×10-33。当溶液pH=5时,某溶液中的Al3+ 填“能”或“不能”
填“能”或“不能” 完全沉淀
完全沉淀 溶液中的离子浓度小于1.0×10-5mol/L时,沉淀完全
溶液中的离子浓度小于1.0×10-5mol/L时,沉淀完全 。
。
您最近一年使用:0次
9 . 钠、铁、镁等元素在生产生活中有广泛的用途,完成下列填空:
Ⅰ钠的重要化合物
(1)在水产养殖上,硫代硫酸钠常用于除去自来水中的氯气,理论上,去除1g的氯气需要0.56g硫代硫酸钠,反应的离子方程式为______ 。
(2)除去Al2O3中混有的Fe2O3,可将混合物溶于过量的盐酸,再加入Na2CO3调节pH使Fe3+沉淀完全而Al3+不沉淀,用化学用语及相应的离子方程式解释加入Na2CO3的目的______ 。
Ⅱ铁的重要化合物
(3)磷酸铁(FePO4•2H2O是难溶于水的米白色固体)可用于生产药物、食品添加剂和锂离子电池的正极材料。实验室可通过下列实验制备磷酸铁。
①称取一定量已除去油污的废铁屑,加入稍过量的稀硫酸,加热、搅拌,反应一段时间后过滤,反应加热的目的是______ 。
②向滤液中加入一定量H2O2氧化Fe2+,为确定加入H2O2的量,需先用K2Cr2O7标准溶液滴定滤液中的Fe2+,在向滴定管中注入K2Cr2O7标准溶液前,滴定管需要检漏、______ 和______ 。
③将一定量的Na2HPO4溶液(溶液显碱性)加入到含有Fe3+的溶液中,搅拌、过滤、洗涤、干燥得到FePO4•2H2O.若反应得到的FePO4•H2O固体呈棕黄色,则磷酸铁中混有的杂质可能为______ 。
Ⅲ镁的重要化合物
(4)氧化镁和碳粉与氯气在一定条件下反应可制备氯化镁,若尾气可用足量的氢氧化钠溶液完全吸收,则生成的盐为______ 。
Ⅰ钠的重要化合物
(1)在水产养殖上,硫代硫酸钠常用于除去自来水中的氯气,理论上,去除1g的氯气需要0.56g硫代硫酸钠,反应的离子方程式为
(2)除去Al2O3中混有的Fe2O3,可将混合物溶于过量的盐酸,再加入Na2CO3调节pH使Fe3+沉淀完全而Al3+不沉淀,用化学用语及相应的离子方程式解释加入Na2CO3的目的
Ⅱ铁的重要化合物
(3)磷酸铁(FePO4•2H2O是难溶于水的米白色固体)可用于生产药物、食品添加剂和锂离子电池的正极材料。实验室可通过下列实验制备磷酸铁。
①称取一定量已除去油污的废铁屑,加入稍过量的稀硫酸,加热、搅拌,反应一段时间后过滤,反应加热的目的是
②向滤液中加入一定量H2O2氧化Fe2+,为确定加入H2O2的量,需先用K2Cr2O7标准溶液滴定滤液中的Fe2+,在向滴定管中注入K2Cr2O7标准溶液前,滴定管需要检漏、
③将一定量的Na2HPO4溶液(溶液显碱性)加入到含有Fe3+的溶液中,搅拌、过滤、洗涤、干燥得到FePO4•2H2O.若反应得到的FePO4•H2O固体呈棕黄色,则磷酸铁中混有的杂质可能为
Ⅲ镁的重要化合物
(4)氧化镁和碳粉与氯气在一定条件下反应可制备氯化镁,若尾气可用足量的氢氧化钠溶液完全吸收,则生成的盐为
您最近一年使用:0次
10 . 请按要求回答下列问题:
(1)某温度下,相同pH值的盐酸和醋酸溶液分别加水稀释,溶液pH值随溶液体积变化的曲线如右图所示。
①稀释醋酸时pH值变化曲线是:___________ (填:“I”或“Ⅱ”),
②b点溶液的导电性比c点溶液的导电性:___________ (填:“强”、“弱”或“无法比较”),
③a、c两点Kw的数值相比,a___________ c(填:“大于”、“小于”或“等于”),
(2)NH4Al(SO4)2在食品、医药、电子工业中用途广泛。
①NH4Al(SO4)2可做净水剂,其理由是:___________ (用离子方程式表示)。
②相同条件下,0.1mol/L NH4Al(SO4)2溶液中,c(NH4+)___________ 0.1mol/L NH4HSO4溶液中c(NH4+)(填“大于”、等于”或“小于”)。
③下图是0.1mo/LNH4Al(SO)2溶液的pH随温度变化的图象,其中符合0.1mo/LNH4Al(SO4)2溶液的曲线是____ (填字母)。导致溶液pH随温度变化的原因是:_________________________________ 。
(1)某温度下,相同pH值的盐酸和醋酸溶液分别加水稀释,溶液pH值随溶液体积变化的曲线如右图所示。
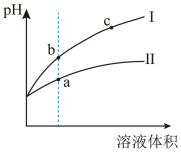
①稀释醋酸时pH值变化曲线是:
②b点溶液的导电性比c点溶液的导电性:
③a、c两点Kw的数值相比,a
(2)NH4Al(SO4)2在食品、医药、电子工业中用途广泛。
①NH4Al(SO4)2可做净水剂,其理由是:
②相同条件下,0.1mol/L NH4Al(SO4)2溶液中,c(NH4+)
③下图是0.1mo/LNH4Al(SO)2溶液的pH随温度变化的图象,其中符合0.1mo/LNH4Al(SO4)2溶液的曲线是
您最近一年使用:0次



