解题方法
1 . 二水合磷酸二氢锰具有广泛用途,被用作防锈剂。某化工拟用软锰矿(含MnO2及少量FeO、Al2O3和SiO2)为原料生产Mn(H2PO4)2·2H2O,其工艺流程如下所示,请回答下列问题:
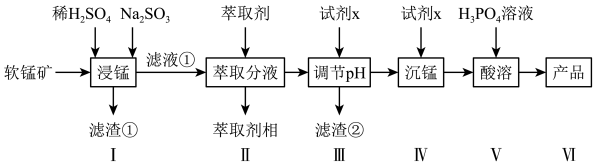
(1)Mn元素位于元素周期表第___________ 周期第___________ 族。
(2)滤渣①的主要成分是___________ 。
(3)适量Na2SO3固体作为还原剂,将MnO2还原为Mn2+,该反应的离子方程式为_____ 。
(4)检验滤液①中是否含有Fe2+,可以用___________溶液。
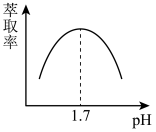
(5)步骤II是用萃取剂萃取溶液中的Fe3+, Fe3+的萃取率与pH的关系如下图,当溶液pH>1.7,随pH增大Fe3+萃取率下降的原因是___________ 。
(6)已知该条件下在步骤III中Ksp[Al(OH) 3] = 10 ×10-33, Ksp[Mn(OH)2]= 1.0 ×10-14.试剂x为Na2CO3,若c(Mn2+)=1.0 mol·L-1,调节pH范围应为4.7≤pH___________ 。
(7)步骤V酸溶时可能产生磷酸锰和磷酸氢锰杂质,因此加入H3PO4至溶液呈酸性才能保证生成物质较多为Mn(H2PO4)2,用离子方程式说明原因___________ 。已知磷酸锰难溶于水,磷酸氢锰和磷酸二氢锰易溶与水。

(1)Mn元素位于元素周期表第
(2)滤渣①的主要成分是
(3)适量Na2SO3固体作为还原剂,将MnO2还原为Mn2+,该反应的离子方程式为
(4)检验滤液①中是否含有Fe2+,可以用___________溶液。
| A.KSCN | B.KFe[Fe(CN)6] |
| C.K3[Fe(CN)6] | D.Fe3[Fe(CN)6]2 |

(6)已知该条件下在步骤III中Ksp[Al(OH) 3] = 10 ×10-33, Ksp[Mn(OH)2]= 1.0 ×10-14.试剂x为Na2CO3,若c(Mn2+)=1.0 mol·L-1,调节pH范围应为4.7≤pH
(7)步骤V酸溶时可能产生磷酸锰和磷酸氢锰杂质,因此加入H3PO4至溶液呈酸性才能保证生成物质较多为Mn(H2PO4)2,用离子方程式说明原因
您最近一年使用:0次
名校
2 . NH4A1(SO4)2和Na2CO3常作食品加工中的食品添加剂;NH4HSO4在分析试剂、医药、电子工业中用途广泛。请回答下列问题:
(1)纯碱(Na2CO3)溶液呈_____ (填“酸性”、“碱性”或“中性”),原因是__________ (用离子方程式说明)。
(2)均为0.1mol/L的几种电解质溶液的pH随温度变化的曲线如图甲所示。
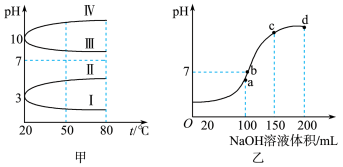
①其中符合0.1 mol/L Na2CO3溶液的pH随温度变化的曲线是_____ (填罗马数字),导致Na2CO3溶液的pH随温度变化的原因是__ 。
②20℃时(KW=1.0×10﹣14),0.1mol/L Na2CO3溶液中c(Na+)-2c(CO )-c(HCO
)-c(HCO )=
)=__ mol/L
(1)纯碱(Na2CO3)溶液呈
(2)均为0.1mol/L的几种电解质溶液的pH随温度变化的曲线如图甲所示。

①其中符合0.1 mol/L Na2CO3溶液的pH随温度变化的曲线是
②20℃时(KW=1.0×10﹣14),0.1mol/L Na2CO3溶液中c(Na+)-2c(CO
 )-c(HCO
)-c(HCO )=
)=
您最近一年使用:0次
解题方法
3 . 碱式碳酸铜是一种用途广泛的化工原料。工业上可用酸性刻蚀废液(主要含有Cu2+、Fe2+、Fe3+、H+、Cl-)制备,其制备过程如下:
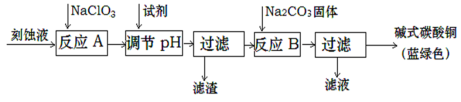
Cu2+、Fe2+、Fe3+生成沉淀的pH如下:
回答下列问题:
(1)NaClO3中氯元素的化合价为_______ 。
(2)完成反应A的离子方程式: +Fe2++____=Cl-+Fe3++_____,
+Fe2++____=Cl-+Fe3++_____,_______ 。
(3)滤渣的成分是_____ ,调节pH的范围是_____ ,选用的试剂较好的是____ (填以下字母编号)。
A.硫酸 B.氨水 C.氧化铜 D.氢氧化钠
(4)反应B有气泡产生,则反应B的离子方程式为_______ 。
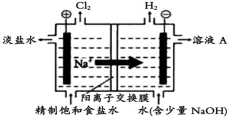
(5)滤液中回收的副产物主要是NaCl,常用于氯碱工业,电解饱和食盐水的原理示意图如下所示,溶液A的溶质是_______ ,电解时用盐酸控制阳极区pH在2~3,用平衡移动原理解释盐酸的作用___ 。

Cu2+、Fe2+、Fe3+生成沉淀的pH如下:
| 物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 4.2 | 5.8 | 1.2 |
| 完全沉淀pH | 6.7 | 8.3 | 3.2 |
回答下列问题:
(1)NaClO3中氯元素的化合价为
(2)完成反应A的离子方程式:
 +Fe2++____=Cl-+Fe3++_____,
+Fe2++____=Cl-+Fe3++_____,(3)滤渣的成分是
A.硫酸 B.氨水 C.氧化铜 D.氢氧化钠
(4)反应B有气泡产生,则反应B的离子方程式为
(5)滤液中回收的副产物主要是NaCl,常用于氯碱工业,电解饱和食盐水的原理示意图如下所示,溶液A的溶质是

您最近一年使用:0次
2021高三·全国·专题练习
解题方法
4 . 钒具有广泛用途。黏土钒矿中,钒以+3、+4、+5价的化合物存在,还包括钾、镁的铝硅酸盐,以及SiO2、Fe3O4。采用以下工艺流程可由黏土钒矿制备NH4VO3。

该工艺条件下,溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
回答下列问题:
“酸浸氧化”需要加热,其原因是_______ 。

该工艺条件下,溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
| 金属离子 | Fe3+ | Fe2+ | Al3+ | Mn2+ |
| 开始沉淀pH | 1.9 | 7.0 | 3.0 | 8.1 |
| 完全沉淀pH | 3.2 | 9.0 | 4.7 | 10.1 |
回答下列问题:
“酸浸氧化”需要加热,其原因是
您最近一年使用:0次
解题方法
5 .  俗称摩尔盐,在净水和定量分析中具有重要用途。某小组探究摩尔盐性质进行如下实验:
俗称摩尔盐,在净水和定量分析中具有重要用途。某小组探究摩尔盐性质进行如下实验:
(1)取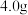 摩尔盐样品溶于适量水配成
摩尔盐样品溶于适量水配成
 溶液,该溶液中离子浓度由大到小的顺序为
溶液,该溶液中离子浓度由大到小的顺序为_______ 。检验该样品是否氧化变质的试剂是_______ 。
(2)经检验样品未变质。取
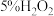 溶液(
溶液( )于试管中,滴入上述所配
)于试管中,滴入上述所配 溶液5滴,溶液立即变为棕黄色并产生大量气泡并放热,静置一会儿,颜色变为红褐色,用激光笔照射,出现丁达尔效应。溶液变为棕黄色的相应离子方程式为
溶液5滴,溶液立即变为棕黄色并产生大量气泡并放热,静置一会儿,颜色变为红褐色,用激光笔照射,出现丁达尔效应。溶液变为棕黄色的相应离子方程式为_______ ,产生的红褐色分散系为_______ ,请结合上述过程解释产生该分散系的原因_______ 。
 俗称摩尔盐,在净水和定量分析中具有重要用途。某小组探究摩尔盐性质进行如下实验:
俗称摩尔盐,在净水和定量分析中具有重要用途。某小组探究摩尔盐性质进行如下实验:(1)取
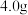 摩尔盐样品溶于适量水配成
摩尔盐样品溶于适量水配成
 溶液,该溶液中离子浓度由大到小的顺序为
溶液,该溶液中离子浓度由大到小的顺序为(2)经检验样品未变质。取

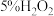 溶液(
溶液( )于试管中,滴入上述所配
)于试管中,滴入上述所配 溶液5滴,溶液立即变为棕黄色并产生大量气泡并放热,静置一会儿,颜色变为红褐色,用激光笔照射,出现丁达尔效应。溶液变为棕黄色的相应离子方程式为
溶液5滴,溶液立即变为棕黄色并产生大量气泡并放热,静置一会儿,颜色变为红褐色,用激光笔照射,出现丁达尔效应。溶液变为棕黄色的相应离子方程式为
您最近一年使用:0次
解题方法
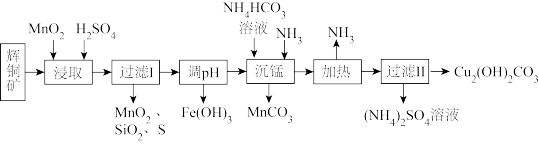
6 . 铜及其化合物在工业生产上有许多用途。某工厂以辉铜矿(主要成分为 ,含少量
,含少量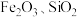 等杂质)为原料制备不溶于水的碱式碳酸铜的流程如下。下列说法错误的是
等杂质)为原料制备不溶于水的碱式碳酸铜的流程如下。下列说法错误的是
 ,含少量
,含少量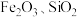 等杂质)为原料制备不溶于水的碱式碳酸铜的流程如下。下列说法错误的是
等杂质)为原料制备不溶于水的碱式碳酸铜的流程如下。下列说法错误的是| 常温下几种物质沉淀pH表 | |||
| 金属离子 |  |  |  |
| 开始沉淀 | 2.7 | 5.6 | 8.3 |
| 完全沉淀 | 3.7 | 6.7 | 9.8 |

| A.“浸取”过程生成的S为氧化产物 |
| B.“调pH”过程需要将溶液调至碱性 |
C.“沉锰”过程中反应的离子方程式为: |
D.“加热”过程排出的 可以通入“沉锰”过程循环利用 可以通入“沉锰”过程循环利用 |
您最近一年使用:0次
名校
解题方法
7 . NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品;NH4HSO4在分析试剂、医药、电子工业中用途广泛。请回答下列问题:
(1)相同条件下,0.1mol·L-1NH4Al(SO4)2中c(NH )
)___ (填“等于”、“大于”或“小于”)0.1mol·L-1NH4HSO4中c(NH )。
)。
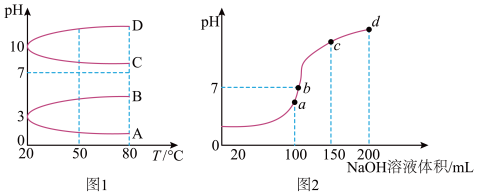
(2)如图1是0.1mol·L-1电解质溶液的pH随温度变化的图象。
①其中符合0.1mol·L-1NH4Al(SO4)2的pH随温度变化的曲线是____ (填字母)。
②室温(20℃)时,0.1mol·L-1NH4Al(SO4)2中2c(SO )-c(NH
)-c(NH )-3c(Al3+)=
)-3c(Al3+)=___ mol·L-1(填数值表达式)。
(3)室温时,向100mL0.1mol·L-1NH4HSO4溶液中滴加0.1mol·L-1NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图2所示。
试分析图中a、b、c、d四个点,水的电离程度最大的是____ ;在b点,溶液中各离子浓度由大到小的排列顺序是____ 。

(1)相同条件下,0.1mol·L-1NH4Al(SO4)2中c(NH
 )
) )。
)。(2)如图1是0.1mol·L-1电解质溶液的pH随温度变化的图象。
①其中符合0.1mol·L-1NH4Al(SO4)2的pH随温度变化的曲线是
②室温(20℃)时,0.1mol·L-1NH4Al(SO4)2中2c(SO
 )-c(NH
)-c(NH )-3c(Al3+)=
)-3c(Al3+)=(3)室温时,向100mL0.1mol·L-1NH4HSO4溶液中滴加0.1mol·L-1NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图2所示。
试分析图中a、b、c、d四个点,水的电离程度最大的是
您最近一年使用:0次
2020-12-23更新
|
119次组卷
|
5卷引用:2015届浙江省杭州地区7校高三上学期期末模拟联考化学试卷
名校
解题方法
8 . 镁及其合金是一种用途很广的金属材料,目前世界上60%的镁是从海水中提取的。某学校课外兴趣小组从海水晒盐后的盐卤(主要含Na+、Mg2+、Cl-、Br-等)中模拟工业生产来提取镁,主要过程如下:

回答下列问题:
(1)工业上从盐卤中获取Mg(OH)2用石灰乳而不用NaOH溶液的原因是_______ ,写出过程①的化学方程式:_______
(2)下图是该兴趣小组设计进行过程③的实验装置图:

其中装置A的作用是_______ 。过程③需要装置A的原因:_______ 。
(3)写出过程④中发生反应的离子方程式_______ 。过程④反应生成的金属单质在空气中燃烧的产物有_______ 和_______ 。

回答下列问题:
(1)工业上从盐卤中获取Mg(OH)2用石灰乳而不用NaOH溶液的原因是
(2)下图是该兴趣小组设计进行过程③的实验装置图:

其中装置A的作用是
(3)写出过程④中发生反应的离子方程式
您最近一年使用:0次
名校
9 .  是食品加工中最为快捷的食品添加剂,用于熔烤食品中;
是食品加工中最为快捷的食品添加剂,用于熔烤食品中; 在分析试剂、医药、电子工业中用途广泛。请回答下列问题:
在分析试剂、医药、电子工业中用途广泛。请回答下列问题:
(1) 可作净水剂,其理由是
可作净水剂,其理由是______ 。(用必要的方程式说明);相同条件下, 中
中
______ (填“=”、“﹥”或“﹤”) 中
中 。
。
(2)如图是 电解质溶液的
电解质溶液的 随温度变化的图像。
随温度变化的图像。
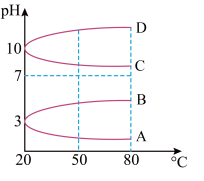
①其中符合 的
的 随温度变化的曲线是
随温度变化的曲线是______ (填字母)。
②20℃时, 中
中
______ 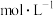 。(填精确值)
。(填精确值)
(3)室温时,向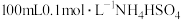 溶液中滴加
溶液中滴加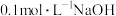 溶液,得到的溶液
溶液,得到的溶液 与
与 溶液体积的关系曲线如图所示。试分析图中a、b、c、d四个点,水的电离程度最大的是
溶液体积的关系曲线如图所示。试分析图中a、b、c、d四个点,水的电离程度最大的是______ ,在b点,溶液中各离子浓度由大到小的排列顺序______ 。

 是食品加工中最为快捷的食品添加剂,用于熔烤食品中;
是食品加工中最为快捷的食品添加剂,用于熔烤食品中; 在分析试剂、医药、电子工业中用途广泛。请回答下列问题:
在分析试剂、医药、电子工业中用途广泛。请回答下列问题:(1)
 可作净水剂,其理由是
可作净水剂,其理由是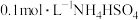 中
中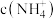
 中
中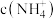 。
。(2)如图是
 电解质溶液的
电解质溶液的 随温度变化的图像。
随温度变化的图像。
①其中符合
 的
的 随温度变化的曲线是
随温度变化的曲线是②20℃时,
 中
中
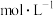 。(填精确值)
。(填精确值)(3)室温时,向
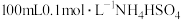 溶液中滴加
溶液中滴加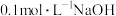 溶液,得到的溶液
溶液,得到的溶液 与
与 溶液体积的关系曲线如图所示。试分析图中a、b、c、d四个点,水的电离程度最大的是
溶液体积的关系曲线如图所示。试分析图中a、b、c、d四个点,水的电离程度最大的是
您最近一年使用:0次
名校
10 . 下列物质用途或操作正确且与盐类水解有关的一组是
①用热饱和硫酸铵溶液清洗铁器表面的铁锈 ②明矾吸附水中杂质 ③用铁粉 、氯化钠和炭粉的混合物作食品保鲜剂 ④在含氯化铁杂质的氯化铜溶液中加入过量的氧化铜,过滤除杂 ⑤在氯化氢气氛中灼烧氯化镁晶体制备无水氯化镁 ⑥用硫酸铜和石灰乳配制波尔多液杀虫剂 ⑦用泡沫灭火器灭火 ⑧配制 Fe(NO3)2溶液时将Fe(NO3)2晶体溶于浓硝酸中并加蒸馏水稀释至指定浓度
①用热饱和硫酸铵溶液清洗铁器表面的铁锈 ②明矾吸附水中杂质 ③用铁粉 、氯化钠和炭粉的混合物作食品保鲜剂 ④在含氯化铁杂质的氯化铜溶液中加入过量的氧化铜,过滤除杂 ⑤在氯化氢气氛中灼烧氯化镁晶体制备无水氯化镁 ⑥用硫酸铜和石灰乳配制波尔多液杀虫剂 ⑦用泡沫灭火器灭火 ⑧配制 Fe(NO3)2溶液时将Fe(NO3)2晶体溶于浓硝酸中并加蒸馏水稀释至指定浓度
| A.①②④⑤⑦ | B.③④⑥⑦⑧ | C.①③④⑥⑦⑧ | D.②③④⑤⑥⑦ |
您最近一年使用:0次



