1 . FeCl3具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3高效,且腐蚀性小。请回答下列问题:
(1)在实验室中,FeCl3可用铁粉和___ 反应制备,实验室检验Fe3+的方法为___ 。FeCl3溶液对钢铁设备的腐蚀,除H+的腐蚀作用外,另一离子的腐蚀的主要原因是___ (用离子方程式表示)。
(2)实验室可用NaClO氧化酸性FeCl2废液得到FeCl3,发生反应的离子方程式为___ 。若要制取1000mL2mol/LFeCl3,则需要NaClO的质量为___ 。
(3)通过控制条件,以上水解产物聚合,生成聚合氧化铁,离子方程式为:xFe3++yH2O Fex(OH)y(3x-y)++yH+。欲使平衡正向移动可采用的方法是
Fex(OH)y(3x-y)++yH+。欲使平衡正向移动可采用的方法是___ (填序号)。
(4)工业上可用废铁屑来制备FeCl3,废铁屑反应前要用热碱液进行洗涤,其目的是___ ,然后用废铁屑与盐酸反应得到FeCl2、再与Cl2反应得到FeCl3溶液,然后将FeCl3溶液结晶得到FeCl3·6H2O晶体,然后在HCl气流中加热得到无水FeCl3,该操作中需要在HCl气流中加热的原因为___ ,若某废铁屑中铁的质量分数为84%,用1000g废铁屑反应,最后制取的FeCl3的质量为1625g,则该制取过程中的产率为___ 。
(1)在实验室中,FeCl3可用铁粉和
(2)实验室可用NaClO氧化酸性FeCl2废液得到FeCl3,发生反应的离子方程式为
(3)通过控制条件,以上水解产物聚合,生成聚合氧化铁,离子方程式为:xFe3++yH2O
 Fex(OH)y(3x-y)++yH+。欲使平衡正向移动可采用的方法是
Fex(OH)y(3x-y)++yH+。欲使平衡正向移动可采用的方法是| A.降温 | B.加水稀释 | C.加入NH4Cl | D.加入NaHCO3 |
您最近一年使用:0次
2021-09-26更新
|
161次组卷
|
2卷引用:甘肃省兰州市第二十七中学2022届高三上学期8月月考化学试题
名校
2 . Na、Al、Fe是生产生活中常见的金属元素。
(1)工业上以铝土矿(主要成分 )为原料生产铝,主要包括以下过程:①将粉碎、筛选后的铝土矿溶解在氢氧化钠溶液中 ②通入过量二氧化碳使①所得溶液中析出氢氧化铝固体 ③使氢氧化铝脱水生成氧化铝 ④电解熔融氧化铝生成铝。写出②所涉及的离子反应方程式
)为原料生产铝,主要包括以下过程:①将粉碎、筛选后的铝土矿溶解在氢氧化钠溶液中 ②通入过量二氧化碳使①所得溶液中析出氢氧化铝固体 ③使氢氧化铝脱水生成氧化铝 ④电解熔融氧化铝生成铝。写出②所涉及的离子反应方程式_______ ;蒸干 溶液
溶液_______ 得到无水 (填“能”或“不能”)。
(填“能”或“不能”)。
(2)铁在地壳中的含量约占5%。红热的铁跟水蒸气反应的化学方程式为_______ ;工业炼铁常用赤铁矿与Al在高温下反应制备,写出化学反应方程式_______ 。
(3)钠的化合物中,纯碱显碱性的原因_______ (用离子方程式解释),向饱和纯碱溶液中通入过量的二氧化碳有晶体析出,写出离子方程式_______ 。
(1)工业上以铝土矿(主要成分
 )为原料生产铝,主要包括以下过程:①将粉碎、筛选后的铝土矿溶解在氢氧化钠溶液中 ②通入过量二氧化碳使①所得溶液中析出氢氧化铝固体 ③使氢氧化铝脱水生成氧化铝 ④电解熔融氧化铝生成铝。写出②所涉及的离子反应方程式
)为原料生产铝,主要包括以下过程:①将粉碎、筛选后的铝土矿溶解在氢氧化钠溶液中 ②通入过量二氧化碳使①所得溶液中析出氢氧化铝固体 ③使氢氧化铝脱水生成氧化铝 ④电解熔融氧化铝生成铝。写出②所涉及的离子反应方程式 溶液
溶液 (填“能”或“不能”)。
(填“能”或“不能”)。(2)铁在地壳中的含量约占5%。红热的铁跟水蒸气反应的化学方程式为
(3)钠的化合物中,纯碱显碱性的原因
您最近一年使用:0次
解题方法
3 . 中国“神舟”飞船举世瞩目,请完成下列填空:
(1)已知1g火箭推进剂肼(N2H4)(g)燃烧生成N2(g)和H2O(g)时,放出16.7kJ的热量,请写出该反应的热化学方程式_______ 。
(2)飞船材料采用的某铝锂合金成分(质量百分比)如下(Bal指剩余的百分含量):
采用碱腐蚀工艺,用稀NaOH 溶液在40-55℃下进行表面处理0.5-2 min,以便形成致密氧化膜提高耐腐蚀性能。请写出碱腐蚀过程中一个主要反应的化学方程式_______ 。工业上制铝,可采用电解_______ (请选填序号):
A.AlCl3 B.Al2O3 C.NaAlO2
同时需添加_______ 以降低熔点减少能量损耗。
(3)太空舱中宇航员可利用呼出的二氧化碳与过氧化钠作用来获得氧气,反应方程式为2Na2O2+2CO2→2Na2CO3+O2,其中还原产物为_______ ,当转移1mol电子时,生成标准状况下O2_______ L。
(4)飞船返回时,反推发动机的燃料中含铝粉,若回收地点附近水中Al3+浓度超标,可喷洒碳酸氢钠减少污染,请结合平衡移动规律解释该措施_______ 。
(1)已知1g火箭推进剂肼(N2H4)(g)燃烧生成N2(g)和H2O(g)时,放出16.7kJ的热量,请写出该反应的热化学方程式
(2)飞船材料采用的某铝锂合金成分(质量百分比)如下(Bal指剩余的百分含量):
| 成分 | Si | Fe | Cu | Mn | Mg | Zn | Ti | Li | Al |
| 含量 | 0.08 | 0.1 | 2.9-3.5 | 0.5 | 0.25-0.8 | 0.25 | 0.1 | 0.8-1.1 | Bal |
采用碱腐蚀工艺,用稀NaOH 溶液在40-55℃下进行表面处理0.5-2 min,以便形成致密氧化膜提高耐腐蚀性能。请写出碱腐蚀过程中一个主要反应的化学方程式
A.AlCl3 B.Al2O3 C.NaAlO2
同时需添加
(3)太空舱中宇航员可利用呼出的二氧化碳与过氧化钠作用来获得氧气,反应方程式为2Na2O2+2CO2→2Na2CO3+O2,其中还原产物为
(4)飞船返回时,反推发动机的燃料中含铝粉,若回收地点附近水中Al3+浓度超标,可喷洒碳酸氢钠减少污染,请结合平衡移动规律解释该措施
您最近一年使用:0次
名校
解题方法
4 . 镁的化合物具有广泛用途,请回答有关镁的下列问题:
(1)单质镁在空气中燃烧的主要产物是________ ,还生成少量的________ (填化学式)。
(2)物质的量为0.10mol的镁条在只含有CO2和O2混合气体的容器中燃烧(产物不含碳酸镁),反应后容器内固体物质的质量不可能为_____________
A.3.2g B.4.0g C.4.2g D.4.6g
(3)镁作为一种强还原剂,还用于钛和铀的生产,写出镁与TiCl4在高温条件下制取钛的化学方程式_______________ 。
(4)氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。Mg2Cu是一种储氢合金。350℃时,Mg2Cu与H2反应,生成MgCu2和仅含一种金属元素的氢化物(其中氢的质量分数为0.077),Mg2Cu与H2反应的化学方程式为___________ 。
(5)CH3MgCl是一种重要的有机合成剂,其中镁的化合价是__________ ,该化合物水解时生成甲烷、氯化镁和氢氧化镁,请写出该反应的化学方程式______________________ 。
(1)单质镁在空气中燃烧的主要产物是
(2)物质的量为0.10mol的镁条在只含有CO2和O2混合气体的容器中燃烧(产物不含碳酸镁),反应后容器内固体物质的质量不可能为
A.3.2g B.4.0g C.4.2g D.4.6g
(3)镁作为一种强还原剂,还用于钛和铀的生产,写出镁与TiCl4在高温条件下制取钛的化学方程式
(4)氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。Mg2Cu是一种储氢合金。350℃时,Mg2Cu与H2反应,生成MgCu2和仅含一种金属元素的氢化物(其中氢的质量分数为0.077),Mg2Cu与H2反应的化学方程式为
(5)CH3MgCl是一种重要的有机合成剂,其中镁的化合价是
您最近一年使用:0次
名校
5 . 按要求回答下列问题
(1)已知25℃,NH3·H2O的Kb=1.8×10−5,H2SO3的Ka1=1.3×10−2,Ka2=6.2×10−8。将SO2通入2.0 mol·L-1氨水中(溶液的体积保持不变),当c(OH−)降至1.0×10−7 mol·L−1时,溶液中的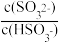 =
=______ ;(NH4)2SO3溶液中的质子守恒_______ 。
(2)土壤的pH一般在4~9之间。土壤中Na2CO3含量较高时,pH可高达10.5,试用离子方程式解释土壤呈碱性的原因为________________ (用离子反应方程式)。加入石膏(CaSO4·2H2O)可以使土壤碱性降低,有关反应的化学方程式为________ 。
(3)SOCl2是一种液态化合物,沸点为77℃化合物,在盛有10mL水的锥形瓶中小心滴加8~10滴SOCl2,可观察到剧烈水解反应,液面有白雾形成,并有刺激性气味的气体逸出,该气体可使滴有品红试液的滤纸褪色,轻轻振荡锥形瓶,等白雾消失后,往溶液中滴加AgNO3溶液,有不溶于HNO3的白色沉淀析出。
①根据上述实验,写出 SOCl2和水反应的化学方程式________________ 。
②SOCl2与AlCl3·6H2O 混合共热,可得到无水AlCl3,其原因是__________ 。
(4)当意外失火时,将泡沫灭火器倒过来即可使药液混合,喷出泡沫状物品,阻止火势蔓延,其相关的离子反应方程式为___________________________ 。
(1)已知25℃,NH3·H2O的Kb=1.8×10−5,H2SO3的Ka1=1.3×10−2,Ka2=6.2×10−8。将SO2通入2.0 mol·L-1氨水中(溶液的体积保持不变),当c(OH−)降至1.0×10−7 mol·L−1时,溶液中的
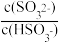 =
=(2)土壤的pH一般在4~9之间。土壤中Na2CO3含量较高时,pH可高达10.5,试用离子方程式解释土壤呈碱性的原因为
(3)SOCl2是一种液态化合物,沸点为77℃化合物,在盛有10mL水的锥形瓶中小心滴加8~10滴SOCl2,可观察到剧烈水解反应,液面有白雾形成,并有刺激性气味的气体逸出,该气体可使滴有品红试液的滤纸褪色,轻轻振荡锥形瓶,等白雾消失后,往溶液中滴加AgNO3溶液,有不溶于HNO3的白色沉淀析出。
①根据上述实验,写出 SOCl2和水反应的化学方程式
②SOCl2与AlCl3·6H2O 混合共热,可得到无水AlCl3,其原因是
(4)当意外失火时,将泡沫灭火器倒过来即可使药液混合,喷出泡沫状物品,阻止火势蔓延,其相关的离子反应方程式为
您最近一年使用:0次
解题方法
6 . 铁、铝、铜及其化合物在生产、生活中有着广泛的应用。请回答下列问题:
(1)铝元素在周期表中位置___________ ,铝离子的结构示意图为____________ 。
(2)Fe3+、Al3+、Cu2+三种金属阳离子氧化性由强到弱的排列顺序是________ 。制造电路板的工艺中,FeCl3溶液可以蚀刻铜箔,该反应的离子方程式为____________ 。
(3)与明矾相似,硫酸铁也可用作净水剂,但在使用时发现硫酸铁并不能使酸性废水中的悬浮物沉降除去,其原因是___________ 。
(4)下表中,对陈述Ⅰ、Ⅱ的正确性的判断都正确的是__________ (填字母序号)。
(5)某校兴趣小组为测定一种铁铝硅合金(FexAlySiz)粉末的组成,提出如下方案:准确称取1.46 g该合金粉末,加入过量盐酸,充分反应后过滤,测得剩余固体的质量为0.07 g。向滤液中滴加足量NaOH浓溶液,充分搅拌、过滤、洗涤得到固体。再将所得固体充分加热、灼烧,得到红棕色粉末1.60 g。通过计算确定此合金的组成为________ (填化学式)。
(1)铝元素在周期表中位置
(2)Fe3+、Al3+、Cu2+三种金属阳离子氧化性由强到弱的排列顺序是
(3)与明矾相似,硫酸铁也可用作净水剂,但在使用时发现硫酸铁并不能使酸性废水中的悬浮物沉降除去,其原因是
(4)下表中,对陈述Ⅰ、Ⅱ的正确性的判断都正确的是
| 选项 | 陈述Ⅰ | 陈述Ⅱ | 判断 |
| A | 铁是地壳中含量最高的金属元素 | 铁是人类最早使用的金属材料 | Ⅰ对;Ⅱ对。 |
| B | 铝箔在酒精灯火焰上加热熔化但不滴落 | 铝箔对熔化的铝有较强的吸附作用 | Ⅰ对;Ⅱ错。 |
| C | 铝粉可以和氧化铁粉末发生铝热反应 | 铝热反应是工业炼铁最常用方法 | Ⅰ对;Ⅱ错。 |
| D | 铜在潮湿空气中表面会生成铜绿 | 可用铜容器盛放浓硫酸 | Ⅰ对;Ⅱ对。 |
(5)某校兴趣小组为测定一种铁铝硅合金(FexAlySiz)粉末的组成,提出如下方案:准确称取1.46 g该合金粉末,加入过量盐酸,充分反应后过滤,测得剩余固体的质量为0.07 g。向滤液中滴加足量NaOH浓溶液,充分搅拌、过滤、洗涤得到固体。再将所得固体充分加热、灼烧,得到红棕色粉末1.60 g。通过计算确定此合金的组成为
您最近一年使用:0次



