名校
解题方法
1 . 下列实验设计不能 达到实验目的的是
| 实验目的 | 实验设计 | |
| A | 向NaAlO2溶液中加入NaHCO3溶液,观察到有白色沉淀生成 | 证明AlO 得质子的能力强于CO 得质子的能力强于CO |
| B | 工业酒精制备无水乙醇 | 工业酒精中加生石灰,蒸馏 |
| C | 检验NH3 | 用湿润的红色石蕊试纸检验 |
| D | 向NaCl、NaI的混合溶液中滴加少量AgNO3溶液,生成淡黄色沉淀 | 证明Ksp(AgCl) > Ksp(AgI) |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2019·北京东城·一模
名校
2 . 某小组同学探究物质的溶解度大小与沉淀转化方向之间的关系。已知:
(1)探究BaCO3和BaSO4之间的转化
实验操作: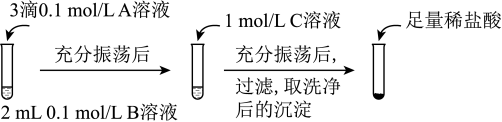
① 实验Ⅰ说明BaCO3全部转化为BaSO4,依据的现象是加入盐酸后,______ 。
② 实验Ⅱ中加入稀盐酸后发生反应的离子方程式是______ 。
③ 实验Ⅱ说明沉淀发生了部分转化,结合BaSO4的沉淀溶解平衡解释原因:______ 。
(2)探究AgCl和AgI之间的转化
实验Ⅲ: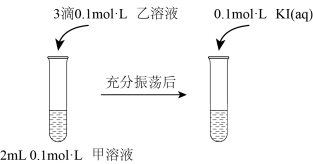
实验Ⅳ:在试管中进行溶液间反应时,同学们无法观察到AgI转化为AgCl,于是又设计了如下实验(电压表读数:a>c>b>0)。
注:其他条件不变时,参与原电池反应的氧化剂(或还原剂)的氧化性(或还原性)越强,原电池的电压越大;离子的氧化性(或还原性)强弱与其浓度有关。
① 实验Ⅲ证明了AgCl转化为AgI,甲溶液可以是______ (填序号)。
a. AgNO3溶液 b. NaCl溶液 c. KI溶液
② 实验Ⅳ的步骤ⅰ中,B中石墨上的电极反应式是______ 。
③ 结合信息,解释实验Ⅳ中b<a的原因:______ 。
④ 实验Ⅳ的现象能说明AgI转化为AgCl,理由是______ 。
(3)综合实验Ⅰ~Ⅳ,可得出结论:______ 。
| 物质 | BaSO4 | BaCO3 | AgI | AgCl | |
| 溶解度/g(20℃) | 2.4×10-4 | 1.4×10-3 | 3.0×10-7 | 1.5×10-4 |
实验操作:

| 试剂A | 试剂B | 试剂C | 加入盐酸后的现象 | |
| 实验Ⅰ | BaCl2 | Na2CO3 | Na2SO4 | …… |
| 实验Ⅱ | Na2SO4 | Na2CO3 | 有少量气泡产生,沉淀部分溶解 |
② 实验Ⅱ中加入稀盐酸后发生反应的离子方程式是
③ 实验Ⅱ说明沉淀发生了部分转化,结合BaSO4的沉淀溶解平衡解释原因:
(2)探究AgCl和AgI之间的转化
实验Ⅲ:
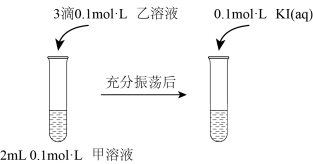
实验Ⅳ:在试管中进行溶液间反应时,同学们无法观察到AgI转化为AgCl,于是又设计了如下实验(电压表读数:a>c>b>0)。
| 装置 | 步骤 | 电压表读数 | |
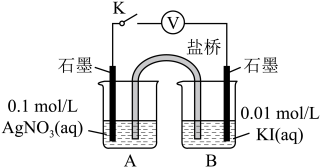 | ⅰ.如图连接装置并加入试剂,闭合K | a | |
| ⅱ.向B中滴入AgNO3(aq),至沉淀完全 | b | ||
| ⅲ.再向B中投入一定量NaCl (s) | c | ||
| ⅳ.重复ⅰ,再向B中加入与ⅲ等量NaCl(s) | a |
① 实验Ⅲ证明了AgCl转化为AgI,甲溶液可以是
a. AgNO3溶液 b. NaCl溶液 c. KI溶液
② 实验Ⅳ的步骤ⅰ中,B中石墨上的电极反应式是
③ 结合信息,解释实验Ⅳ中b<a的原因:
④ 实验Ⅳ的现象能说明AgI转化为AgCl,理由是
(3)综合实验Ⅰ~Ⅳ,可得出结论:
您最近一年使用:0次
2019-04-13更新
|
734次组卷
|
8卷引用:北京市第四中学2021-2022学年高二上学期期中考试化学试题
(已下线)北京市第四中学2021-2022学年高二上学期期中考试化学试题【区级联考】北京市东城区2019届高三一模考试化学试题北京市朝阳区第八十中学2020届高三模拟化学试题(已下线)第21讲 难溶电解质的溶解平衡-2021年高考化学一轮复习名师精讲练北京市第二中学2023-2024学年高二上学期第二学段 段考化学试题北京市育才学校2023-2024学年高一上学期化学期中试题北京师范大学第二附属中学2023-2024学年高二上学期期中考试化学试题北京市第一六一中学2023-2024学年高二下学期开学考化学试题
名校
3 . 草酸(H2C2O4)是一种二元弱酸,广泛分布于动植物体中。
(1)人体内草酸累积过多是导致结石(主要成分是草酸钙)形成的原因之一、有研究发现,EDTA(一种能结合钙离子的试剂)在一定条件下可以有效溶解结石,用化学平衡原理解释其原因:___________ 。
(2)已知:H2C2O4的Ka1=5.6×10−2,Ka2=1.5×10−4,0.1mol·L-1KHC2O4溶液呈_______ 性(选填“酸”,“中”或“碱”),通过计算说明其原因是:______ 。下列说法正确的是______ (填字母序号)。
a.0.1mol·L-1KHC2O4溶液中:c(K+)+c(H+)=c( )+2c(
)+2c( )+c(OH-)
)+c(OH-)
b.0.1mol·L-1KHC2O4溶液中:c(K+)>c( )>c(
)>c( )>c(H2C2O4)
)>c(H2C2O4)
c.浓度均为0.1mol·L-1KHC2O4和K2C2O4的混合溶液中:3c(K+)=2c( )+2c(
)+2c( )+2c(H2C2O4)
)+2c(H2C2O4)
d.0.1mol·L-1KHC2O4溶液中滴加等浓度NaOH溶液至中性:c(K+)>c(Na+)
(3)利用草酸制备草酸亚铁晶体(FeC2O4·xH2O)的流程及组分测定方法如下:
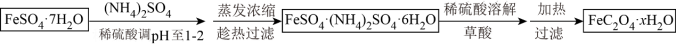
已知: i.pH>4时,Fe2+易被氧气氧化
ii.几种物质的溶解度(g/100gH2O)如下:
①用稀硫酸调溶液pH至1~2的目的是:___________ ,___________ 。
②趁热过滤的原因是:___________ 。
③为测定草酸亚铁晶体中结晶水含量,将石英玻璃管(带两端开关K1和K2,设为装置A)称重,记为m1g。将样品装入石英玻璃管中,再次将装置A称重,记为m2g。按下图连接好装置进行实验。

实验操作为:打开K1,K2,缓缓通入氮气;点燃酒精灯,小火加热;熄灭酒精灯,冷却至室温,停止通入氮气,关闭K1,K2;称重A.重复上述操作步骤,直至A恒重,记为m3g。假设此过程中FeC2O4不分解,根据实验记录,计算草酸亚铁晶体中结晶水数目x=___________ (列式表示)。
(1)人体内草酸累积过多是导致结石(主要成分是草酸钙)形成的原因之一、有研究发现,EDTA(一种能结合钙离子的试剂)在一定条件下可以有效溶解结石,用化学平衡原理解释其原因:
(2)已知:H2C2O4的Ka1=5.6×10−2,Ka2=1.5×10−4,0.1mol·L-1KHC2O4溶液呈
a.0.1mol·L-1KHC2O4溶液中:c(K+)+c(H+)=c(
 )+2c(
)+2c( )+c(OH-)
)+c(OH-)b.0.1mol·L-1KHC2O4溶液中:c(K+)>c(
 )>c(
)>c( )>c(H2C2O4)
)>c(H2C2O4)c.浓度均为0.1mol·L-1KHC2O4和K2C2O4的混合溶液中:3c(K+)=2c(
 )+2c(
)+2c( )+2c(H2C2O4)
)+2c(H2C2O4)d.0.1mol·L-1KHC2O4溶液中滴加等浓度NaOH溶液至中性:c(K+)>c(Na+)
(3)利用草酸制备草酸亚铁晶体(FeC2O4·xH2O)的流程及组分测定方法如下:
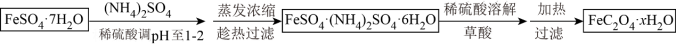
已知: i.pH>4时,Fe2+易被氧气氧化
ii.几种物质的溶解度(g/100gH2O)如下:
| FeSO4·7H2O | (NH4)2SO4 | FeSO4·(NH4)2SO4·6H2O | |
| 20℃ | 48 | 75 | 37 |
| 60℃ | 101 | 88 | 38 |
②趁热过滤的原因是:
③为测定草酸亚铁晶体中结晶水含量,将石英玻璃管(带两端开关K1和K2,设为装置A)称重,记为m1g。将样品装入石英玻璃管中,再次将装置A称重,记为m2g。按下图连接好装置进行实验。

实验操作为:打开K1,K2,缓缓通入氮气;点燃酒精灯,小火加热;熄灭酒精灯,冷却至室温,停止通入氮气,关闭K1,K2;称重A.重复上述操作步骤,直至A恒重,记为m3g。假设此过程中FeC2O4不分解,根据实验记录,计算草酸亚铁晶体中结晶水数目x=
您最近一年使用:0次
解题方法
4 . Na2S2O4 (保险粉)是一种强还原剂,锌粉法制备Na2S2O4的原理为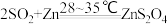 、
、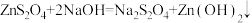 ,制备Na2S2O4的装置(夹持及加热装置已省略)如图所示,回答下列问题:
,制备Na2S2O4的装置(夹持及加热装置已省略)如图所示,回答下列问题:
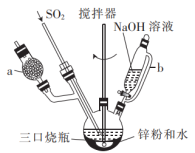
(1)仪器a中盛放的药品是___________ (填名称),导管b的作用是___________ 。
(2)实验开始前,需要向三口烧瓶中充满N2,目的是___________ 。
(3)通入三口烧瓶中的SO2是由铜屑与浓硫酸反应制得的,生成SO2的化学方程式为___________ 。
(4)制备Na2S2O4时,三口烧瓶的加热方式是___________ 。
(5)Zn粉消耗完全后,在搅拌下向三口烧瓶中加入NaOH溶液,充分反应后过滤,向滤液中加入NaCl固体,冷却结晶、过滤、蒸馏水洗涤、酒精洗涤及干燥得产品。加入NaCl固体的作用是___________ ,酒精洗涤的目的是___________ 。
(6)取a g产品溶于适量NaOH溶液,加入亚甲基蓝指示剂,用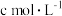 的
的 标准溶液滴定,至终点时消耗
标准溶液滴定,至终点时消耗 标准溶液V mL。
标准溶液V mL。
已知: 被还原为
被还原为 ,
,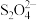 被氧化为
被氧化为 。
。
①滴定反应的离子方程式为___________ 。
②产品中Na2S2O4的质量分数为___________ 。(列出计算式)。
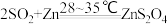 、
、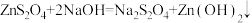 ,制备Na2S2O4的装置(夹持及加热装置已省略)如图所示,回答下列问题:
,制备Na2S2O4的装置(夹持及加热装置已省略)如图所示,回答下列问题:
(1)仪器a中盛放的药品是
(2)实验开始前,需要向三口烧瓶中充满N2,目的是
(3)通入三口烧瓶中的SO2是由铜屑与浓硫酸反应制得的,生成SO2的化学方程式为
(4)制备Na2S2O4时,三口烧瓶的加热方式是
(5)Zn粉消耗完全后,在搅拌下向三口烧瓶中加入NaOH溶液,充分反应后过滤,向滤液中加入NaCl固体,冷却结晶、过滤、蒸馏水洗涤、酒精洗涤及干燥得产品。加入NaCl固体的作用是
(6)取a g产品溶于适量NaOH溶液,加入亚甲基蓝指示剂,用
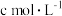 的
的 标准溶液滴定,至终点时消耗
标准溶液滴定,至终点时消耗 标准溶液V mL。
标准溶液V mL。已知:
 被还原为
被还原为 ,
,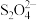 被氧化为
被氧化为 。
。①滴定反应的离子方程式为
②产品中Na2S2O4的质量分数为
您最近一年使用:0次
2021-01-21更新
|
569次组卷
|
4卷引用:陕西省安康市2021届高三第一次教学质量联考化学试题
陕西省安康市2021届高三第一次教学质量联考化学试题(已下线)大题03 无机制备类实验题-【考前抓大题】备战2021年高考化学(全国通用)(已下线)重点4 物质制备分析-2021年高考化学【热点·重点·难点】专练(新高考)陕西省宝鸡市陈仓区2021届高三第二次教学质量检测理科综合化学试题



