名校
1 . CuCl为白色粉末,微溶于水,溶于浓盐酸或NaCl浓溶液,不溶于乙醇。一种由海绵铜(Cu和少量CuO等)为原料制备CuCl的工艺流程如图:
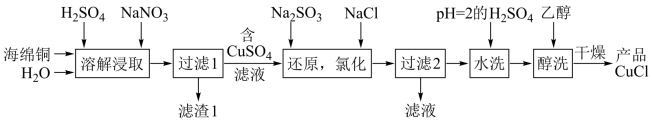
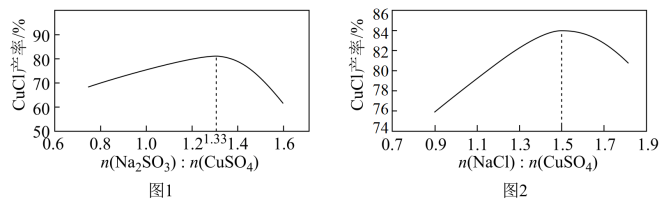
(1)“还原,氯化”时,Na2SO3和NaCl的用量对CuCl产率的影响如图1、图2所示。
①CuSO4与Na2SO3、NaCl在溶液中反应生成CuCl的离子方程式为___ 。
②当n(Na2SO3):n(CuSO4)>1.33时,比值越大CuCl产率越小,其原因是___ 。
③当1.0<n(NaCl):n(CuSO4)<1.5时,比值越大CuCl产率越大,结合沉淀平衡移动原理分析其原因是___ 。
(2)用“醇洗”可快速去除滤渣表面的水,防止滤渣被空气氧化为Cu2(OH)3Cl。CuCl被氧化为Cu2(OH)3Cl的化学方程式为___ 。
(3)为测定某氯化亚铜样品中CuCl的含量,某同学设计如下实验:准确称取氯化亚铜样品mg,将其置于过量的FeCl3溶液中,待固体完全溶解后,加入适量稀硫酸,用amol/L的K2Cr2O7溶液氧化反应生成的Fe2+,消耗K2Cr2O7溶液bmL,反应中Cr2O 被还原为Cr3+,求样品中CuCl的质量分数
被还原为Cr3+,求样品中CuCl的质量分数___ (写计算过程)。

(1)“还原,氯化”时,Na2SO3和NaCl的用量对CuCl产率的影响如图1、图2所示。

①CuSO4与Na2SO3、NaCl在溶液中反应生成CuCl的离子方程式为
②当n(Na2SO3):n(CuSO4)>1.33时,比值越大CuCl产率越小,其原因是
③当1.0<n(NaCl):n(CuSO4)<1.5时,比值越大CuCl产率越大,结合沉淀平衡移动原理分析其原因是
(2)用“醇洗”可快速去除滤渣表面的水,防止滤渣被空气氧化为Cu2(OH)3Cl。CuCl被氧化为Cu2(OH)3Cl的化学方程式为
(3)为测定某氯化亚铜样品中CuCl的含量,某同学设计如下实验:准确称取氯化亚铜样品mg,将其置于过量的FeCl3溶液中,待固体完全溶解后,加入适量稀硫酸,用amol/L的K2Cr2O7溶液氧化反应生成的Fe2+,消耗K2Cr2O7溶液bmL,反应中Cr2O
 被还原为Cr3+,求样品中CuCl的质量分数
被还原为Cr3+,求样品中CuCl的质量分数
您最近一年使用:0次
2021-12-22更新
|
738次组卷
|
7卷引用:江苏省前黄高级中学、如东中学、姜堰中学2021-2022学年高三上学期12月份阶段性测试化学试题
江苏省前黄高级中学、如东中学、姜堰中学2021-2022学年高三上学期12月份阶段性测试化学试题江苏省姜堰中学、如东中学、前黄中学三校2021- 2022学年高三联考化学试题(已下线)黄金卷1-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(江苏卷)江苏省徐州市第七中学2021-2022学年高三下学期2月检测化学试题湖南省益阳市第一中学2021-2022学年高二下学期期末考试化学试题(已下线)2022年江苏卷高考真题变式题14-17(已下线)江苏省2022年普通高中学业水平选择性考试变式题(实验探究题)
名校
2 . 天然石灰石是工业生产中重要的原材料之一,它的主要成分是CaCO3,一般以CaO的质量分数表示钙含量,常采用高锰酸钾法测定。步骤如下:
I.称取ag研细的石灰石样品于250mL烧杯中,加过量稀盐酸溶解,水浴加热10分钟;
II.稍冷后逐滴加入氨水至溶液pH≈4,再缓慢加入适量(NH4)2C2O4溶液,继续水浴加热30分钟;
III.冷却至室温后过滤出沉淀,用另外配制的稀(NH4)2C2O4溶液洗涤沉淀三次,再用蒸馏水洗涤至洗涤液中无法检出Cl−;
IV.加入适量热的稀硫酸至沉淀中,获得的溶液用cmol·L−1KMnO4标准溶液滴定至终点。
V.平行测定三次,消耗KMnO4溶液的体积平均为VmL。
已知:H2C2O4是弱酸;CaC2O4是难溶于水的白色沉淀。
(1)I中为了加快反应速率而采取的操作有___________ 。
(2)II中加入氨水调节溶液pH的作用是___________ 。
(3)III中洗涤得到干净的沉淀。
①结合平衡移动原理,解释用稀(NH4)2C2O4溶液洗涤沉淀的目的___________ 。
②验证沉淀是否洗涤干净的操作是___________ 。
③若沉淀中的Cl−未洗涤干净,则最终测量结果___________ (填“偏大”、“偏小”或“不变”)。
(4)IV中用KMnO4标准溶液滴定。
①滴定时发生反应的离子方程式为___________ 。
②滴定至终点的现象为___________ 。
③样品中以CaO质量分数表示的钙含量为___________ (列出表达式)。
I.称取ag研细的石灰石样品于250mL烧杯中,加过量稀盐酸溶解,水浴加热10分钟;
II.稍冷后逐滴加入氨水至溶液pH≈4,再缓慢加入适量(NH4)2C2O4溶液,继续水浴加热30分钟;
III.冷却至室温后过滤出沉淀,用另外配制的稀(NH4)2C2O4溶液洗涤沉淀三次,再用蒸馏水洗涤至洗涤液中无法检出Cl−;
IV.加入适量热的稀硫酸至沉淀中,获得的溶液用cmol·L−1KMnO4标准溶液滴定至终点。
V.平行测定三次,消耗KMnO4溶液的体积平均为VmL。
已知:H2C2O4是弱酸;CaC2O4是难溶于水的白色沉淀。
(1)I中为了加快反应速率而采取的操作有
(2)II中加入氨水调节溶液pH的作用是
(3)III中洗涤得到干净的沉淀。
①结合平衡移动原理,解释用稀(NH4)2C2O4溶液洗涤沉淀的目的
②验证沉淀是否洗涤干净的操作是
③若沉淀中的Cl−未洗涤干净,则最终测量结果
(4)IV中用KMnO4标准溶液滴定。
①滴定时发生反应的离子方程式为
②滴定至终点的现象为
③样品中以CaO质量分数表示的钙含量为
您最近一年使用:0次
解题方法
3 . Na2S2O4 (保险粉)是一种强还原剂,锌粉法制备Na2S2O4的原理为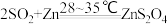 、
、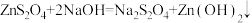 ,制备Na2S2O4的装置(夹持及加热装置已省略)如图所示,回答下列问题:
,制备Na2S2O4的装置(夹持及加热装置已省略)如图所示,回答下列问题:
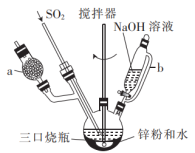
(1)仪器a中盛放的药品是___________ (填名称),导管b的作用是___________ 。
(2)实验开始前,需要向三口烧瓶中充满N2,目的是___________ 。
(3)通入三口烧瓶中的SO2是由铜屑与浓硫酸反应制得的,生成SO2的化学方程式为___________ 。
(4)制备Na2S2O4时,三口烧瓶的加热方式是___________ 。
(5)Zn粉消耗完全后,在搅拌下向三口烧瓶中加入NaOH溶液,充分反应后过滤,向滤液中加入NaCl固体,冷却结晶、过滤、蒸馏水洗涤、酒精洗涤及干燥得产品。加入NaCl固体的作用是___________ ,酒精洗涤的目的是___________ 。
(6)取a g产品溶于适量NaOH溶液,加入亚甲基蓝指示剂,用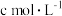 的
的 标准溶液滴定,至终点时消耗
标准溶液滴定,至终点时消耗 标准溶液V mL。
标准溶液V mL。
已知: 被还原为
被还原为 ,
,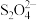 被氧化为
被氧化为 。
。
①滴定反应的离子方程式为___________ 。
②产品中Na2S2O4的质量分数为___________ 。(列出计算式)。
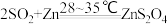 、
、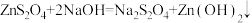 ,制备Na2S2O4的装置(夹持及加热装置已省略)如图所示,回答下列问题:
,制备Na2S2O4的装置(夹持及加热装置已省略)如图所示,回答下列问题:
(1)仪器a中盛放的药品是
(2)实验开始前,需要向三口烧瓶中充满N2,目的是
(3)通入三口烧瓶中的SO2是由铜屑与浓硫酸反应制得的,生成SO2的化学方程式为
(4)制备Na2S2O4时,三口烧瓶的加热方式是
(5)Zn粉消耗完全后,在搅拌下向三口烧瓶中加入NaOH溶液,充分反应后过滤,向滤液中加入NaCl固体,冷却结晶、过滤、蒸馏水洗涤、酒精洗涤及干燥得产品。加入NaCl固体的作用是
(6)取a g产品溶于适量NaOH溶液,加入亚甲基蓝指示剂,用
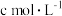 的
的 标准溶液滴定,至终点时消耗
标准溶液滴定,至终点时消耗 标准溶液V mL。
标准溶液V mL。已知:
 被还原为
被还原为 ,
,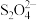 被氧化为
被氧化为 。
。①滴定反应的离子方程式为
②产品中Na2S2O4的质量分数为
您最近一年使用:0次
2021-01-21更新
|
569次组卷
|
4卷引用:陕西省安康市2021届高三第一次教学质量联考化学试题
陕西省安康市2021届高三第一次教学质量联考化学试题(已下线)大题03 无机制备类实验题-【考前抓大题】备战2021年高考化学(全国通用)(已下线)重点4 物质制备分析-2021年高考化学【热点·重点·难点】专练(新高考)陕西省宝鸡市陈仓区2021届高三第二次教学质量检测理科综合化学试题
名校
4 . 某结晶水合物化学式X·nH2O,其相对分子质量为M,在25℃时,Ag该结晶水合物溶于Bg水中即可达到饱和,形成密度为D g/cm3的饱和溶液VmL,下列表达式中不正确的是( )
A.该饱和溶液的质量分数为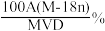 | B.溶质X在25℃时的溶解度为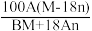 克 克 |
C.该饱和溶液的密度为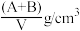 | D.该饱和溶液的物质的量浓度为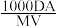 mol/L mol/L |
您最近一年使用:0次
2020-12-23更新
|
494次组卷
|
6卷引用:广东省中山纪念中学2021届高三上学期第一次月考化学试题
广东省中山纪念中学2021届高三上学期第一次月考化学试题(已下线)解密02 物质的量(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)解密02 物质的量(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)考向02 物质的量浓度及其相关计算-备战2022年高考化学一轮复习考点微专题甘肃省天水市一中2022届高三上学期8月第一次考试化学试题(已下线)考点02 化学用语和常用化学计量-备战2022年高考化学学霸纠错(全国通用)
5 . 环境保护工程师的主要工作包括对环境问题的调查研究、分析检测、管理监督和对环境污染的控制与治理等。下列说法错误的是
| A.空气质量监测项目包括颗粒物、NO2、SO2、CO2等的含量 |
| B.可用光谱分析的方法对环境中的污染物进行分析和鉴定 |
| C.以K2CrO4为指示剂,用AgNO3标准液配位滴定(以配位反应为基础)水体中CN-的含量 |
| D.用氨催化吸收法处理工业尾气中的氮氧化物(NOx) |
您最近一年使用:0次
名校
解题方法
6 . 可乐中的食品添加剂有白砂糖、二氧化碳、焦糖色、磷酸、咖啡因等。可乐的辛辣味与磷酸(化学式为 ,沸点高难挥发)有一定关系。
,沸点高难挥发)有一定关系。
(1)室温下,测得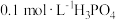 溶液的
溶液的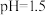 ,用电离方程式解释原因:
,用电离方程式解释原因:___________ 。
(2)羟基磷灰石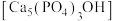 是牙釉质的主要成分,在唾液中存在平衡:
是牙釉质的主要成分,在唾液中存在平衡: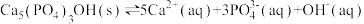 。 长期过量饮用可乐会破坏牙釉质,造成龋齿。结合平衡移动原理解释原因:
。 长期过量饮用可乐会破坏牙釉质,造成龋齿。结合平衡移动原理解释原因:___________ 。
(3)常温下,向磷酸溶液中滴加NaOH溶液,含磷微粒的分布比例与pH的关系如图所示。
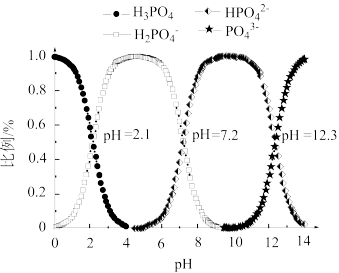
①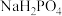 溶液显酸性。下列有关分析正确的是
溶液显酸性。下列有关分析正确的是___________ 。
a.溶液中
b. 的电离程度大于其水解程度
的电离程度大于其水解程度
c.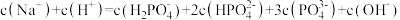
d.溶液中水的电离程度比纯水大
②当溶液的pH由4到10时,所发生反应的离子方程式是:___________ 。
(4)小组同学在实验室测定某可乐中磷酸的含量(不考虑白砂糖、咖啡因的影响)。
i.将可乐样品注入圆底烧瓶,加入活性炭,吸附色素。
ii.将可乐回流加热10 min,冷却至室温,过滤。
iii.取50.00 mL滤液,用百里香酚酞作指示剂,用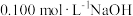 溶液滴定至终点时生成
溶液滴定至终点时生成 ,消耗NaOH溶液5.00 mL。
,消耗NaOH溶液5.00 mL。
①加热的目的是___________ 。
②该可乐样品中磷酸的含量为___________ g/L。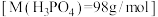
 ,沸点高难挥发)有一定关系。
,沸点高难挥发)有一定关系。(1)室温下,测得
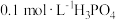 溶液的
溶液的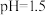 ,用电离方程式解释原因:
,用电离方程式解释原因:(2)羟基磷灰石
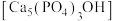 是牙釉质的主要成分,在唾液中存在平衡:
是牙釉质的主要成分,在唾液中存在平衡: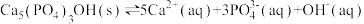 。 长期过量饮用可乐会破坏牙釉质,造成龋齿。结合平衡移动原理解释原因:
。 长期过量饮用可乐会破坏牙釉质,造成龋齿。结合平衡移动原理解释原因:(3)常温下,向磷酸溶液中滴加NaOH溶液,含磷微粒的分布比例与pH的关系如图所示。

①
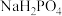 溶液显酸性。下列有关分析正确的是
溶液显酸性。下列有关分析正确的是a.溶液中

b.
 的电离程度大于其水解程度
的电离程度大于其水解程度c.
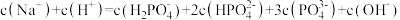
d.溶液中水的电离程度比纯水大
②当溶液的pH由4到10时,所发生反应的离子方程式是:
(4)小组同学在实验室测定某可乐中磷酸的含量(不考虑白砂糖、咖啡因的影响)。
i.将可乐样品注入圆底烧瓶,加入活性炭,吸附色素。
ii.将可乐回流加热10 min,冷却至室温,过滤。
iii.取50.00 mL滤液,用百里香酚酞作指示剂,用
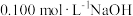 溶液滴定至终点时生成
溶液滴定至终点时生成 ,消耗NaOH溶液5.00 mL。
,消耗NaOH溶液5.00 mL。①加热的目的是
②该可乐样品中磷酸的含量为
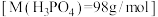
您最近一年使用:0次
2021高三·全国·专题练习
7 . 工业上向氨化的CaSO4悬浊液中通入适量CO2,可制取(NH4)2SO4,其流程如图所示。已知CaSO4的KSP=9.1×10-4,CaCO3的KSP=2.8×10-4。请回答:
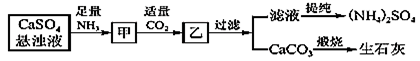
(1)向甲中通入过量CO2____ (填“有”或“不”)利于CaCO3和(NH4)2SO4的生成,原因是________ 。
(2)直接蒸干滤液得到的(NH4)2SO4主要含有的杂质是____________ (填含量最多的一种)。
(3)锅炉水垢中含有的CaSO4,可先用Na2CO3溶液浸泡,使之转化为疏松、易溶于酸的CaCO3,而后用酸除去。
①CaSO4转化为CaCO3的离子方程式为______________ ;
②请分析CaSO4转化为CaCO3的原理:____________ 。

(1)向甲中通入过量CO2
(2)直接蒸干滤液得到的(NH4)2SO4主要含有的杂质是
(3)锅炉水垢中含有的CaSO4,可先用Na2CO3溶液浸泡,使之转化为疏松、易溶于酸的CaCO3,而后用酸除去。
①CaSO4转化为CaCO3的离子方程式为
②请分析CaSO4转化为CaCO3的原理:
您最近一年使用:0次
名校
8 . 草酸(H2C2O4)是一种二元弱酸,广泛分布于动植物体中。
(1)人体内草酸累积过多是导致结石(主要成分是草酸钙)形成的原因之一、有研究发现,EDTA(一种能结合钙离子的试剂)在一定条件下可以有效溶解结石,用化学平衡原理解释其原因:___________ 。
(2)已知:H2C2O4的Ka1=5.6×10−2,Ka2=1.5×10−4,0.1mol·L-1KHC2O4溶液呈_______ 性(选填“酸”,“中”或“碱”),通过计算说明其原因是:______ 。下列说法正确的是______ (填字母序号)。
a.0.1mol·L-1KHC2O4溶液中:c(K+)+c(H+)=c( )+2c(
)+2c( )+c(OH-)
)+c(OH-)
b.0.1mol·L-1KHC2O4溶液中:c(K+)>c( )>c(
)>c( )>c(H2C2O4)
)>c(H2C2O4)
c.浓度均为0.1mol·L-1KHC2O4和K2C2O4的混合溶液中:3c(K+)=2c( )+2c(
)+2c( )+2c(H2C2O4)
)+2c(H2C2O4)
d.0.1mol·L-1KHC2O4溶液中滴加等浓度NaOH溶液至中性:c(K+)>c(Na+)
(3)利用草酸制备草酸亚铁晶体(FeC2O4·xH2O)的流程及组分测定方法如下:
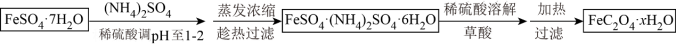
已知: i.pH>4时,Fe2+易被氧气氧化
ii.几种物质的溶解度(g/100gH2O)如下:
①用稀硫酸调溶液pH至1~2的目的是:___________ ,___________ 。
②趁热过滤的原因是:___________ 。
③为测定草酸亚铁晶体中结晶水含量,将石英玻璃管(带两端开关K1和K2,设为装置A)称重,记为m1g。将样品装入石英玻璃管中,再次将装置A称重,记为m2g。按下图连接好装置进行实验。

实验操作为:打开K1,K2,缓缓通入氮气;点燃酒精灯,小火加热;熄灭酒精灯,冷却至室温,停止通入氮气,关闭K1,K2;称重A.重复上述操作步骤,直至A恒重,记为m3g。假设此过程中FeC2O4不分解,根据实验记录,计算草酸亚铁晶体中结晶水数目x=___________ (列式表示)。
(1)人体内草酸累积过多是导致结石(主要成分是草酸钙)形成的原因之一、有研究发现,EDTA(一种能结合钙离子的试剂)在一定条件下可以有效溶解结石,用化学平衡原理解释其原因:
(2)已知:H2C2O4的Ka1=5.6×10−2,Ka2=1.5×10−4,0.1mol·L-1KHC2O4溶液呈
a.0.1mol·L-1KHC2O4溶液中:c(K+)+c(H+)=c(
 )+2c(
)+2c( )+c(OH-)
)+c(OH-)b.0.1mol·L-1KHC2O4溶液中:c(K+)>c(
 )>c(
)>c( )>c(H2C2O4)
)>c(H2C2O4)c.浓度均为0.1mol·L-1KHC2O4和K2C2O4的混合溶液中:3c(K+)=2c(
 )+2c(
)+2c( )+2c(H2C2O4)
)+2c(H2C2O4)d.0.1mol·L-1KHC2O4溶液中滴加等浓度NaOH溶液至中性:c(K+)>c(Na+)
(3)利用草酸制备草酸亚铁晶体(FeC2O4·xH2O)的流程及组分测定方法如下:
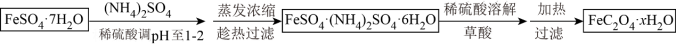
已知: i.pH>4时,Fe2+易被氧气氧化
ii.几种物质的溶解度(g/100gH2O)如下:
| FeSO4·7H2O | (NH4)2SO4 | FeSO4·(NH4)2SO4·6H2O | |
| 20℃ | 48 | 75 | 37 |
| 60℃ | 101 | 88 | 38 |
②趁热过滤的原因是:
③为测定草酸亚铁晶体中结晶水含量,将石英玻璃管(带两端开关K1和K2,设为装置A)称重,记为m1g。将样品装入石英玻璃管中,再次将装置A称重,记为m2g。按下图连接好装置进行实验。

实验操作为:打开K1,K2,缓缓通入氮气;点燃酒精灯,小火加热;熄灭酒精灯,冷却至室温,停止通入氮气,关闭K1,K2;称重A.重复上述操作步骤,直至A恒重,记为m3g。假设此过程中FeC2O4不分解,根据实验记录,计算草酸亚铁晶体中结晶水数目x=
您最近一年使用:0次
名校
9 . 下列实验能达到预期目的的是
| 实验内容 | 实验目的 | |
| A | 把甲烷和乙烯分别在空气中点燃,乙烯火焰明亮且伴有黑烟 | 证明乙烯中碳的百分含量比甲烷高 |
| B | 向含有酚酞的Na2CO3溶液中加入少量BaC12固体,溶液红色变浅 | 证明Na2CO3溶液中存在水解平衡 |
| C | 向10mL0.2mol/LNaOH溶液中滴加2滴0.1mol/LMgCl2溶液,产生白色沉淀后,再滴加2滴0.1mol/LFeCl3溶液,又生成红褐色沉淀 | 证明在相同温度下的Ksp: Mg(OH)2>Fe(OH)3 |
| D | 分别测定室温下等物质的量浓度的Na2SO3与Na2CO3溶液的pH,后者较大 | 证明非金属性:S>C |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2021-09-15更新
|
280次组卷
|
4卷引用:河北正定中学2020-2021学年高二上学期第二次月考化学试题
解题方法
10 . 含钙物质在生产生活中发挥着重要作用,如 、
、 等。
等。
(1)菠菜成分测定中常用 为沉淀剂。菠菜中含有的草酸以
为沉淀剂。菠菜中含有的草酸以 、
、 、
、 存在,三种微粒之和称为总草酸。某研究小组测定菠菜中总草酸含量,进行如下实验。
存在,三种微粒之和称为总草酸。某研究小组测定菠菜中总草酸含量,进行如下实验。
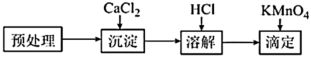
①在“预处理”步骤,将菠菜碾碎后预处理,得含总草酸的溶液( ),该步骤
),该步骤依次 需要的装置有_______ 。
②在“沉淀”步骤,调节 至溶液弱碱性,再滴加足量
至溶液弱碱性,再滴加足量 溶液,产生白色沉淀,过滤得到
溶液,产生白色沉淀,过滤得到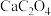 固体。“调节溶液至弱碱性”的目的是
固体。“调节溶液至弱碱性”的目的是_______ 。
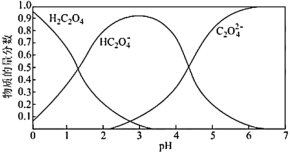
草酸溶液中微粒的物质的量分数随溶液 变化如图所示:
变化如图所示:
③在“溶解”步骤,稀 溶解
溶解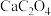 ,所得溶液
,所得溶液 ,该步骤主要反应的离子方程式是:
,该步骤主要反应的离子方程式是:_______ 。
④在“滴定”步骤,用 标准溶液滴定
标准溶液滴定 次,判断达到滴定终点的现象是
次,判断达到滴定终点的现象是_______ 。
(2) 的饱和石灰水,加热至
的饱和石灰水,加热至 ,发现溶液变浑浊,且加热过程中并未见水分蒸发,现探究溶液变浑浊的原因。
,发现溶液变浑浊,且加热过程中并未见水分蒸发,现探究溶液变浑浊的原因。
提出猜想。
猜想a: 的溶解度随温度升高而减小,升温的过程中析出
的溶解度随温度升高而减小,升温的过程中析出 。
。
猜想b:温度变化的过程中, 变质,使溶液变浑浊。
变质,使溶液变浑浊。
设计实验,验证猜想。
提供 下的
下的 饱和溶液Ⅰ、
饱和溶液Ⅰ、 下的
下的 饱和溶液Ⅱ。
饱和溶液Ⅱ。
①查阅资料: 时,
时,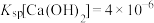 ,
,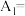
_______  。
。
②上述实验结果是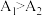 ,是否可以证明猜想a成立,
,是否可以证明猜想a成立,_______ (填“是”或“否”)。
③进一步验证猜想b,补充实验3,填写在答题卡上_______ 。
(3)实验总结。
根据实验 的结果,可以判断猜想b成立。猜想b成立的判断依据是
的结果,可以判断猜想b成立。猜想b成立的判断依据是_______ 。
 、
、 等。
等。(1)菠菜成分测定中常用
 为沉淀剂。菠菜中含有的草酸以
为沉淀剂。菠菜中含有的草酸以 、
、 、
、 存在,三种微粒之和称为总草酸。某研究小组测定菠菜中总草酸含量,进行如下实验。
存在,三种微粒之和称为总草酸。某研究小组测定菠菜中总草酸含量,进行如下实验。
①在“预处理”步骤,将菠菜碾碎后预处理,得含总草酸的溶液(
 ),该步骤
),该步骤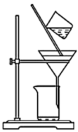 | 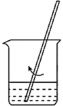 | 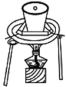 | 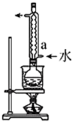 |
| A | B | C | D |
 至溶液弱碱性,再滴加足量
至溶液弱碱性,再滴加足量 溶液,产生白色沉淀,过滤得到
溶液,产生白色沉淀,过滤得到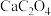 固体。“调节溶液至弱碱性”的目的是
固体。“调节溶液至弱碱性”的目的是草酸溶液中微粒的物质的量分数随溶液
 变化如图所示:
变化如图所示:
③在“溶解”步骤,稀
 溶解
溶解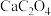 ,所得溶液
,所得溶液 ,该步骤主要反应的离子方程式是:
,该步骤主要反应的离子方程式是:④在“滴定”步骤,用
 标准溶液滴定
标准溶液滴定 次,判断达到滴定终点的现象是
次,判断达到滴定终点的现象是(2)
 的饱和石灰水,加热至
的饱和石灰水,加热至 ,发现溶液变浑浊,且加热过程中并未见水分蒸发,现探究溶液变浑浊的原因。
,发现溶液变浑浊,且加热过程中并未见水分蒸发,现探究溶液变浑浊的原因。提出猜想。
猜想a:
 的溶解度随温度升高而减小,升温的过程中析出
的溶解度随温度升高而减小,升温的过程中析出 。
。猜想b:温度变化的过程中,
 变质,使溶液变浑浊。
变质,使溶液变浑浊。设计实验,验证猜想。
提供
 下的
下的 饱和溶液Ⅰ、
饱和溶液Ⅰ、 下的
下的 饱和溶液Ⅱ。
饱和溶液Ⅱ。| 实验序号 | 试样 | 测试温度/℃ | 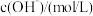 |
 | Ⅰ: 的 的 饱和溶液 饱和溶液 | 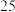 |  |
 | Ⅱ: 的 的 饱和溶液 饱和溶液 | 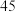 |  |
 | _______ | _______ | 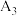 |
 时,
时,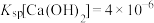 ,
,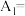
 。
。②上述实验结果是
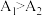 ,是否可以证明猜想a成立,
,是否可以证明猜想a成立,③进一步验证猜想b,补充实验3,填写在答题卡上
(3)实验总结。
根据实验
 的结果,可以判断猜想b成立。猜想b成立的判断依据是
的结果,可以判断猜想b成立。猜想b成立的判断依据是
您最近一年使用:0次



