名校
1 . 按要求填空。
(1)工业制胆矾时,将粗制CuO粉末(含杂质FeO、Fe2O3)慢慢加入适量的稀H2SO4中完全溶解,除去杂质离子后,再蒸发结晶可得纯净的胆矾晶体。已知:pH≥9.6时,Fe2+以Fe(OH)2的形式完全沉淀;pH≥6.4时,Cu2+以Cu(OH)2的形式完全沉淀;pH在3~4时,Fe3+以Fe(OH)3的形式完全沉淀。回答下列问题:
为除去溶液中的Fe2+,可先加入_______ ,(从下面四个选项选择)将Fe2+氧化为Fe3+,反应的离子方程式为_______ ,然后加入适量的_______ (写化学式)调整溶液的pH使Fe3+转化为Fe(OH)3沉淀。
A.KMnO4 B.Cl2 C.浓硫酸 D.H2O2
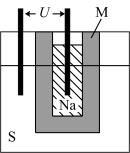
(2)如图为钠硫高能电池的结构示意图,该电池的工作温度为320 ℃左右,电池反应为2Na+xS=Na2Sx,正极的电极反应式为_______ 。与铅蓄电池相比,当消耗相同质量的负极活性物质时,钠硫电池的理论放电量是铅蓄电池的_______ 倍。
(3)室温时,向100 mL 0.1 mol·L-1NH4HSO4溶液中滴加0.1 mol·L-1NaOH溶液,当溶液pH=7时,溶液中各离子浓度由大到小的排列顺序是_______ 。
(1)工业制胆矾时,将粗制CuO粉末(含杂质FeO、Fe2O3)慢慢加入适量的稀H2SO4中完全溶解,除去杂质离子后,再蒸发结晶可得纯净的胆矾晶体。已知:pH≥9.6时,Fe2+以Fe(OH)2的形式完全沉淀;pH≥6.4时,Cu2+以Cu(OH)2的形式完全沉淀;pH在3~4时,Fe3+以Fe(OH)3的形式完全沉淀。回答下列问题:
为除去溶液中的Fe2+,可先加入
A.KMnO4 B.Cl2 C.浓硫酸 D.H2O2
(2)如图为钠硫高能电池的结构示意图,该电池的工作温度为320 ℃左右,电池反应为2Na+xS=Na2Sx,正极的电极反应式为

(3)室温时,向100 mL 0.1 mol·L-1NH4HSO4溶液中滴加0.1 mol·L-1NaOH溶液,当溶液pH=7时,溶液中各离子浓度由大到小的排列顺序是
您最近一年使用:0次
名校
2 . (1)醋酸钠水溶液pH>7,原因是(用离子方程式表示):_______ 。
(2)把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是_______ 。
(3)在配制氯化铁溶液时,为了防止发生水解,可以加入适量的_______ 。
(4)室温下pH=9的NaOH溶液和pH=9的CH3COONa溶液,设由水电离产生的OH﹣的物质的量浓度分别为A和B,则A/B等于_______
(5)已知Ksp(BaSO4)=1.1×10-10,若向50mL0.008mol·L-1的BaCl2溶液中加入50mL0.01mol·L-1的硫酸,混合后溶液中的Ba2+的浓度为_______ mol·L-1,pH为_______ 。
(2)把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是
(3)在配制氯化铁溶液时,为了防止发生水解,可以加入适量的
(4)室温下pH=9的NaOH溶液和pH=9的CH3COONa溶液,设由水电离产生的OH﹣的物质的量浓度分别为A和B,则A/B等于
(5)已知Ksp(BaSO4)=1.1×10-10,若向50mL0.008mol·L-1的BaCl2溶液中加入50mL0.01mol·L-1的硫酸,混合后溶液中的Ba2+的浓度为
您最近一年使用:0次
2021-03-02更新
|
213次组卷
|
3卷引用:江西省抚州市金溪县第一中学2020-2021学年高二上学期第二次月考化学试题
3 . I.通过计算回答下列有关沉淀溶解平衡的问题。
向50mL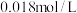 的
的 溶液中加入50mL
溶液中加入50mL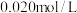 的
的 溶液,生成沉淀。已知该温度下
溶液,生成沉淀。已知该温度下 的
的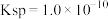 ,忽略溶液混合的体积变化,已知
,忽略溶液混合的体积变化,已知 ,请回答:
,请回答:
(1)两溶液充分混合后溶液的
_______ 。
(2)完全沉淀后,溶液中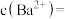
_______ 。
Ⅱ.亚氯酸钠( )常用于纺织、造纸等行业,在工业生产中十分重要,现有一份含有杂质的亚氯酸钠样品,欲测量亚氯酸钠的纯度。
)常用于纺织、造纸等行业,在工业生产中十分重要,现有一份含有杂质的亚氯酸钠样品,欲测量亚氯酸钠的纯度。
准确称取所得亚氯酸钠样品mg于小烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应,将所得混合液配成250mL待测溶液。移取25.00mL待测溶液于锥形瓶中,加几滴淀粉溶液,用cmol/L 标准溶液滴定至终点,重复2次,测得消耗
标准溶液滴定至终点,重复2次,测得消耗 标准溶液的平均值为VmL。(已知:杂质不参与反应,
标准溶液的平均值为VmL。(已知:杂质不参与反应,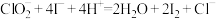 、
、 )
)
(1)达到滴定终点时的现象为_______ 。
(2)下列滴定过程中测量结果偏高的是( )
A.滴定前滴定管尖嘴有气泡,滴定终点时尖嘴气泡消失
B.滴定管用蒸馏水洗净后没有用标准液润洗
C.滴定前仰视滴定管刻度,滴定后俯视滴定管刻度
D.锥形瓶用蒸馏水洗净后未干燥
(3)该样品中 的质量分数为
的质量分数为_______ (用含m、c、V的代数式表示)。
向50mL
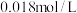 的
的 溶液中加入50mL
溶液中加入50mL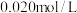 的
的 溶液,生成沉淀。已知该温度下
溶液,生成沉淀。已知该温度下 的
的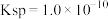 ,忽略溶液混合的体积变化,已知
,忽略溶液混合的体积变化,已知 ,请回答:
,请回答:(1)两溶液充分混合后溶液的

(2)完全沉淀后,溶液中
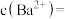
Ⅱ.亚氯酸钠(
 )常用于纺织、造纸等行业,在工业生产中十分重要,现有一份含有杂质的亚氯酸钠样品,欲测量亚氯酸钠的纯度。
)常用于纺织、造纸等行业,在工业生产中十分重要,现有一份含有杂质的亚氯酸钠样品,欲测量亚氯酸钠的纯度。准确称取所得亚氯酸钠样品mg于小烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应,将所得混合液配成250mL待测溶液。移取25.00mL待测溶液于锥形瓶中,加几滴淀粉溶液,用cmol/L
 标准溶液滴定至终点,重复2次,测得消耗
标准溶液滴定至终点,重复2次,测得消耗 标准溶液的平均值为VmL。(已知:杂质不参与反应,
标准溶液的平均值为VmL。(已知:杂质不参与反应,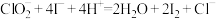 、
、 )
)(1)达到滴定终点时的现象为
(2)下列滴定过程中测量结果偏高的是
A.滴定前滴定管尖嘴有气泡,滴定终点时尖嘴气泡消失
B.滴定管用蒸馏水洗净后没有用标准液润洗
C.滴定前仰视滴定管刻度,滴定后俯视滴定管刻度
D.锥形瓶用蒸馏水洗净后未干燥
(3)该样品中
 的质量分数为
的质量分数为
您最近一年使用:0次
4 . 钡(Ba)和锶(Sr)及其化合物在工业上有着广泛的应用,它们在地壳中常以硫酸盐的形式存在,BaSO4和SrSO4都是难溶性盐。工业上提取钡和锶时首先将BaSO4和SrSO4转化成难溶弱酸盐。
已知:SrSO4(s) Sr2+(aq)+SO
Sr2+(aq)+SO (aq)Ksp=2.5×10-7
(aq)Ksp=2.5×10-7
SrCO3(s) Sr2+(aq)+CO
Sr2+(aq)+CO (aq)Ksp=2.5×10-9
(aq)Ksp=2.5×10-9
(1)将SrSO4转化成SrCO3的离子方程式为__ ;该反应的平衡常数表达式为__ 。
(2)对于上述反应,实验证明增大CO 的浓度或降低温度都有利于提高SrSO4的转化率。判断在下列两种情况下,平衡常数K的变化情况(填“增大”“减小”或“不变”)。
的浓度或降低温度都有利于提高SrSO4的转化率。判断在下列两种情况下,平衡常数K的变化情况(填“增大”“减小”或“不变”)。
①升高温度,平衡常数K将__ 。
②增大CO 的浓度,平衡常数K将
的浓度,平衡常数K将__ 。
已知:SrSO4(s)
 Sr2+(aq)+SO
Sr2+(aq)+SO (aq)Ksp=2.5×10-7
(aq)Ksp=2.5×10-7SrCO3(s)
 Sr2+(aq)+CO
Sr2+(aq)+CO (aq)Ksp=2.5×10-9
(aq)Ksp=2.5×10-9(1)将SrSO4转化成SrCO3的离子方程式为
(2)对于上述反应,实验证明增大CO
 的浓度或降低温度都有利于提高SrSO4的转化率。判断在下列两种情况下,平衡常数K的变化情况(填“增大”“减小”或“不变”)。
的浓度或降低温度都有利于提高SrSO4的转化率。判断在下列两种情况下,平衡常数K的变化情况(填“增大”“减小”或“不变”)。①升高温度,平衡常数K将
②增大CO
 的浓度,平衡常数K将
的浓度,平衡常数K将
您最近一年使用:0次
5 . 锅炉中最难清洗的锅垢是硫酸钡固体,298K时工业上常使用碳酸钠溶液进行处理:BaSO4(s)+CO (aq)
(aq) BaCO3(s)+SO
BaCO3(s)+SO (aq) K(298K)=0.1
(aq) K(298K)=0.1
(1)若平衡溶液中c(SO )为0.1mol·L-1,则c(CO
)为0.1mol·L-1,则c(CO )=
)=___ mol·L-1。
(2)锅炉经过碳酸钠处理后,倒出溶液,再向锅中加入一定量的醋酸溶液,目的是___ (用化学方程式表示)。
(3)需要处理0.1molBaSO4,加入1LNa2CO3溶液,碳酸钠的物质的量浓度是___ mol·L-1。平衡溶液中c(CO )=
)=___ mol·L-1。
 (aq)
(aq) BaCO3(s)+SO
BaCO3(s)+SO (aq) K(298K)=0.1
(aq) K(298K)=0.1(1)若平衡溶液中c(SO
 )为0.1mol·L-1,则c(CO
)为0.1mol·L-1,则c(CO )=
)=(2)锅炉经过碳酸钠处理后,倒出溶液,再向锅中加入一定量的醋酸溶液,目的是
(3)需要处理0.1molBaSO4,加入1LNa2CO3溶液,碳酸钠的物质的量浓度是
 )=
)=
您最近一年使用:0次
20-21高二上·江西南昌·期中
解题方法
6 . 已知氢氧化钙和钨酸钙(CaWO4都是微溶电解质,两者的溶解度均随温度升高而减小。在钨冶炼工艺中,将氢氧化钙加入钨酸钠碱性溶液中得到钨酸钙,发生反应I: (aq)+Ca(OH)2(s)⇌CaWO4(s)+2OH-(aq),如图为不同温度下Ca(OH)2、CaWO4 的沉淀溶解平衡曲线。试回答下列问题:
(aq)+Ca(OH)2(s)⇌CaWO4(s)+2OH-(aq),如图为不同温度下Ca(OH)2、CaWO4 的沉淀溶解平衡曲线。试回答下列问题:

(1)①计算T1时,Ksp(CaWO4)=
②T1
(2)①反应I平衡常数K的表达式为
②该反应的△H
③由于溶液中离子间的相互作用,实验测得的平衡常数与理论值直相距甚远。50℃时,向一定体积的钨酸钠碱性溶液[c(Na2WO4)=c(NaOH)=0.5mol/L]中,加入过量Ca(OH)2,反应达到平衡后 的沉淀率为60%,此时
的沉淀率为60%,此时 的平衡浓度为
的平衡浓度为
您最近一年使用:0次
2011·江苏南通·一模
名校
解题方法
7 . 以硫铁矿为原料生产硫酸所得的酸性废水中砷元素含量极高,为控制砷的排放,采用化学沉降法处理含砷废水,相关数据如表。
表1.几种砷酸盐的Ksp
表2.工厂污染物排放浓度及允许排放标准
回答下列问题:
(1)该硫酸工厂排放的废水中硫酸的物质的量浓度c(H2SO4)=________ mol·L-1。
(2)写出难溶物Ca3(AsO4)2的Ksp表达式:
Ksp[Ca3(AsO4)2]=________ ,若混合溶液中Al3+、Fe3+的浓度均为1.0×10-4 mol·L-1,c(AsO43-)最大是______ mol·L-1。
(3)工厂排放出的酸性废水中的三价砷(H3AsO3为弱酸)不易沉降,可投入MnO2先将其氧化成五价砷(H3AsO4为弱酸),写出该反应的离子方程式:_______________________ 。
(4)在处理含砷废水时采用分段式,先向废水中投入生石灰调节pH到2,再投入生石灰将pH调节到8左右使五价砷以Ca3(AsO4)2形式沉降。
①将pH调节到2时废水中有大量沉淀产生,沉淀主要成分的化学式为__________ ;
②Ca3(AsO4)2在pH调节到8左右才开始沉淀的原因为_______________________ 。
表1.几种砷酸盐的Ksp
| 难溶物 | Ksp | |
| Ca3(AsO4)2 | 6.8×10-19 | |
| AlAsO4 | 1.6×10-16 | |
| FeAsO4 | 5.7×10-21 | |
表2.工厂污染物排放浓度及允许排放标准
| 污染物 | H2SO4 | As |
| 浓度 | 28.42 g·L-1 | 1.6 g·L-1 |
| 排放标准 | pH 6~9 | 0.5 mg·L-1 |
回答下列问题:
(1)该硫酸工厂排放的废水中硫酸的物质的量浓度c(H2SO4)=
(2)写出难溶物Ca3(AsO4)2的Ksp表达式:
Ksp[Ca3(AsO4)2]=
(3)工厂排放出的酸性废水中的三价砷(H3AsO3为弱酸)不易沉降,可投入MnO2先将其氧化成五价砷(H3AsO4为弱酸),写出该反应的离子方程式:
(4)在处理含砷废水时采用分段式,先向废水中投入生石灰调节pH到2,再投入生石灰将pH调节到8左右使五价砷以Ca3(AsO4)2形式沉降。
①将pH调节到2时废水中有大量沉淀产生,沉淀主要成分的化学式为
②Ca3(AsO4)2在pH调节到8左右才开始沉淀的原因为
您最近一年使用:0次
2019-12-03更新
|
183次组卷
|
7卷引用:江西赣州市2022~2023学年高二上学期期末考试化学试题
江西赣州市2022~2023学年高二上学期期末考试化学试题(已下线)2011届江苏省南通市高三第一次调研测试化学试卷(已下线)2012届江苏省阜宁、大丰、栟茶高级中学高三第二次调研联考化学试卷(已下线)2013届江苏省泗阳致远中学高三实验班第一次模拟考试化学试卷(已下线)专题8.4 难溶电解质的溶解平衡(练)-《2020年高考一轮复习讲练测》安徽省太和第一中学2020-2021学年高二上学期期中考试化学(普通班)试题河南省中原名校2021-2022学年高二上学期期末联考化学试题
8 . 连二次硝酸(H2N2O2)是一种二元酸,可用于制N2O气体。
(1)常温下,用0.01mol·L-1的NaOH溶液滴定10mL0.01mol·L-1的H2N2O2溶液,测得溶液pH与NaOH溶液体积的关系如图所示。

①写出H2N2O2在水溶液中的电离方程式:______________ 。
②c点溶液中个离子溶度由大到小的顺序_______________________________
③b点时溶液中c(H2N2O2)_____ c(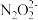 )(填“>”、“<”或 “=”,下同)。
)(填“>”、“<”或 “=”,下同)。
④a点时溶液中c(Na+)____ c(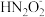 )+c(
)+c(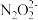 )。
)。
(2)硝酸银溶液和连二次硝酸钠溶液混合,可以得到黄色的连二次硝酸银沉淀,向该分散系中滴加硫酸钠溶液,当白色沉淀和黄色沉淀共存时,分散系中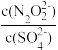 =
=__________ 。[已知Ksp(Ag2N2O2)=4.2×10-9,Ksp(Ag2SO4)=1.4×10-5]
(1)常温下,用0.01mol·L-1的NaOH溶液滴定10mL0.01mol·L-1的H2N2O2溶液,测得溶液pH与NaOH溶液体积的关系如图所示。

①写出H2N2O2在水溶液中的电离方程式:
②c点溶液中个离子溶度由大到小的顺序
③b点时溶液中c(H2N2O2)
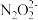 )(填“>”、“<”或 “=”,下同)。
)(填“>”、“<”或 “=”,下同)。④a点时溶液中c(Na+)
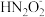 )+c(
)+c(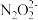 )。
)。(2)硝酸银溶液和连二次硝酸钠溶液混合,可以得到黄色的连二次硝酸银沉淀,向该分散系中滴加硫酸钠溶液,当白色沉淀和黄色沉淀共存时,分散系中
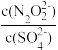 =
=
您最近一年使用:0次
9 . 已知在25 ℃的水溶液中,AgX、AgY、AgZ均难溶于水,且Ksp(AgX)=1.8×10-10,Ksp(AgY)=1.0×10-12,Ksp(AgZ)= 8.7×10-17。
(1)根据以上信息,判断AgX、AgY、AgZ的溶解度S(AgX)、S(AgY)、S(AgZ)的大小顺序为_________ 。
(2)若向AgY的饱和溶液中加入少量的AgX固体,则c(Y-)_____ (填“增大”、“减小”或“不变”)。
(3)在25 ℃时,若取0.188 g的AgY(相对分子质量为188)固体放入100 mL水中(忽略溶液体积的变化),则溶液中Y-的浓度为______ 。
(4)由上述Ksp判断,在上述(3)的体系中,____ (填“能”或“不能”)实现AgY向AgZ的转化,理由为______ 。
(1)根据以上信息,判断AgX、AgY、AgZ的溶解度S(AgX)、S(AgY)、S(AgZ)的大小顺序为
(2)若向AgY的饱和溶液中加入少量的AgX固体,则c(Y-)
(3)在25 ℃时,若取0.188 g的AgY(相对分子质量为188)固体放入100 mL水中(忽略溶液体积的变化),则溶液中Y-的浓度为
(4)由上述Ksp判断,在上述(3)的体系中,
您最近一年使用:0次
2018-11-23更新
|
553次组卷
|
6卷引用:2011-2012学年江西省白鹭洲中学高二上学期期中考试化学(理)试卷
(已下线)2011-2012学年江西省白鹭洲中学高二上学期期中考试化学(理)试卷(已下线)2018年11月14日 《每日一题》人教选修4-溶度积的有关计算鲁科版(2019)选择性必修1 第3章 物质在水溶液中的行为 第3节 沉淀溶解平衡人教版(2019)高二选择性必修第一册 第三章 水溶液中的离子反应与平衡 第四节 沉淀溶解平衡 作业帮陕西省榆林市第十二中学2020-2021学年高二下学期第一次月考化学试题(已下线)3.4 沉淀溶解平衡-同步学习必备知识
名校
10 . 已知在25℃的水溶液中,AgCl、AgBr、AgI均难溶于水,且Ksp(AgCl)= 1.8×10-10,Ksp(AgBr)= 1.0×10-12,Ksp(AgI)= 8.7×10-17;
(1) 若向AgBr的饱和溶液中加入少量的AgCl固体,则c(Br-)_______________ 。 (填“增大”、“减小”或“不变”)。
(2)在25℃时,若取0.188 g的AgBr(相对分子质量188)固体放入100 mL水中(忽略溶液体积的变化),则溶液中Br-的物质的量浓度为_____________ 。
(3)① 由上述Ksp判断,在上述(2)的体系中,能否实现AgBr向AgI的转化_______ (填“能”或“否”),简述理由:_____________________________________________________________ 。
② 若某KCl溶液的浓度为 1.0×10-2 mol·L-1 ,将等体积的该KCl溶液与AgNO3 溶液混合,则生成沉淀所需AgNO3 溶液的最小浓度为__________ mol·L-1。
(1) 若向AgBr的饱和溶液中加入少量的AgCl固体,则c(Br-)
(2)在25℃时,若取0.188 g的AgBr(相对分子质量188)固体放入100 mL水中(忽略溶液体积的变化),则溶液中Br-的物质的量浓度为
(3)① 由上述Ksp判断,在上述(2)的体系中,能否实现AgBr向AgI的转化
② 若某KCl溶液的浓度为 1.0×10-2 mol·L-1 ,将等体积的该KCl溶液与AgNO3 溶液混合,则生成沉淀所需AgNO3 溶液的最小浓度为
您最近一年使用:0次
2017-07-14更新
|
384次组卷
|
2卷引用:江西省赣州市第四中学2016-2017学年高二上学期第二次月考化学试题



