1 . 【选修2:化学与技术】
地球的海水问题约有1.4×1018t,是人类最大的资源库。
(1)如下图1利用海水得到淡水的方法是____________ ;
(2)电渗析法是近年发展起来的一种较好的海水淡化技术,其原理如图2所示.a是电源的_________ 极;Ⅰ口排出的是__________ (填“淡水”或“浓水”).
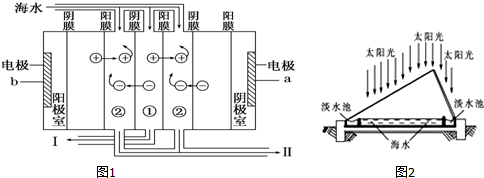
(3)海水淡化后的浓水中含大量盐分(主要含有Mg2+、Ca2+、Fe3+和 ),排入水中会改变水质,排到土壤中会导致土壤盐碱化,故不能直接排放,可以与氯碱工业联产.电解前需要把浓水精制,所需试剂主要包括:HCl、NaOH、BaCl2、Na2CO3等),其中HCl的作用主要是
),排入水中会改变水质,排到土壤中会导致土壤盐碱化,故不能直接排放,可以与氯碱工业联产.电解前需要把浓水精制,所需试剂主要包括:HCl、NaOH、BaCl2、Na2CO3等),其中HCl的作用主要是_____________ ;
(4)铀是核反应最重要的燃料,其提炼技术直接关系着一个国家核工业或核武器的发展水平,海水中铀以UCl4形式存在(以离子形式存在),每吨海水只含3.3毫克铀,海水总量极大,铀总量相当巨大.不少国家正在探索海水提铀的方法.现在,已经研制成功一种螯合型离子交换树脂,它专门吸附海水中的铀,而不吸附其他元素.其反应原理为______________ (树脂用HR代替),发生离子交换后的离子交换膜用酸处理还可再生并得到含铀的溶液,其反应原理为_________________ ;
(5)离子交换树脂法是制备纯水(去离子水)的主要方法.某阳离子交换树酯的局部结构可写成(如图).该阳离子交换树脂是由单体苯乙烯和交联剂对二乙烯基苯聚合后再经_____ 反应得到的.自来水与该离子交换树脂交换作用后显_________ (填“酸性”、“碱性”或“中性”).

(6)中国《生活用水卫生标准》中规定,水的总硬度不能过大.如果硬度过大,饮用后对人体健康与日常生活有一定影响.暂时硬水的硬度是由__________ (填阴离子符号)引起的,经___________ (填操作名称)后可被去掉.永久硬水的硬度可由离子交换法去掉。
地球的海水问题约有1.4×1018t,是人类最大的资源库。
(1)如下图1利用海水得到淡水的方法是
(2)电渗析法是近年发展起来的一种较好的海水淡化技术,其原理如图2所示.a是电源的

(3)海水淡化后的浓水中含大量盐分(主要含有Mg2+、Ca2+、Fe3+和
 ),排入水中会改变水质,排到土壤中会导致土壤盐碱化,故不能直接排放,可以与氯碱工业联产.电解前需要把浓水精制,所需试剂主要包括:HCl、NaOH、BaCl2、Na2CO3等),其中HCl的作用主要是
),排入水中会改变水质,排到土壤中会导致土壤盐碱化,故不能直接排放,可以与氯碱工业联产.电解前需要把浓水精制,所需试剂主要包括:HCl、NaOH、BaCl2、Na2CO3等),其中HCl的作用主要是(4)铀是核反应最重要的燃料,其提炼技术直接关系着一个国家核工业或核武器的发展水平,海水中铀以UCl4形式存在(以离子形式存在),每吨海水只含3.3毫克铀,海水总量极大,铀总量相当巨大.不少国家正在探索海水提铀的方法.现在,已经研制成功一种螯合型离子交换树脂,它专门吸附海水中的铀,而不吸附其他元素.其反应原理为
(5)离子交换树脂法是制备纯水(去离子水)的主要方法.某阳离子交换树酯的局部结构可写成(如图).该阳离子交换树脂是由单体苯乙烯和交联剂对二乙烯基苯聚合后再经

(6)中国《生活用水卫生标准》中规定,水的总硬度不能过大.如果硬度过大,饮用后对人体健康与日常生活有一定影响.暂时硬水的硬度是由
您最近一年使用:0次
2 . 完成以下题目
(1)在粗制CuSO4·5H2O晶体中常含有杂质Fe3+,提纯时为了除去Fe2+,常加入合适氧化剂,使Fe2+氧化为Fe3+,然后再加入适当物质调整至溶液pH=4,使Fe3+转化为Fe(OH)3,可以达到除去Fe3+而不损失CuSO4的目的,调整溶液pH可选用下列中的________
(2)甲同学怀疑调整至溶液pH=4是否能达到除去Fe3+而不损失Cu2+的目的,乙同学认为可以通过计算确定,他查阅有关资料得到如下数据,常温下Fe(OH)3的溶度积Ksp=8.0×10-38,Cu(OH)2的溶度积Ksp=3.0×10-20,通常认为残留在溶液中的离子浓度小于1×10-5 mol•L-1时就认为沉淀完全,设溶液中CuSO4的浓度为3.0mol•L-1,则Cu(OH)2开始沉淀时溶液的pH为________ ,Fe3+完全沉淀时溶液的pH为________ ,通过计算确定上述方案________ (填“可行”或“不可行”)(已知lg5=0.7)
(1)在粗制CuSO4·5H2O晶体中常含有杂质Fe3+,提纯时为了除去Fe2+,常加入合适氧化剂,使Fe2+氧化为Fe3+,然后再加入适当物质调整至溶液pH=4,使Fe3+转化为Fe(OH)3,可以达到除去Fe3+而不损失CuSO4的目的,调整溶液pH可选用下列中的
| A.NaOH | B.CuO | C.NH3•H2O | D.Cu(OH)2 |
您最近一年使用:0次
名校
3 . 弱电解质的电离平衡、盐类的水解平衡和难溶物的溶解平衡均属于化学平衡。根据要求回答问题。
(1)生活中明矾常作净水剂,其净水的原理是_____________ (用离子方程式表示)。
(2)常温下,取0.2 mol/L HCl溶液与0.2mol/L MOH溶液等体积混合,测得混合后溶液的pH=5。写出MOH的电离方程式:__________________ 。
(3)0.1mol/L的NaHA溶液,测得溶液显碱性。则
①该溶液中c(H2A)_______________ c(A2-)(填“>”、“<”或“=”)
②作出上述判断的依据是_____________ (用文字解释)。
(4)含Cr2O72-的废水毒性较大,某工厂废水中含5.0×10-3mol/L的Cr2O72-。为了使废水的排放达标,进行如下处理:
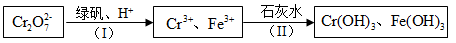
绿矾为FeSO4• 7H2O。反应(I)中Cr2O72-与FeSO4的物质的量之比为___________ 。
常温下若处理后的废水中c(Cr3+)=6.0×10-7mol/L,则处理后的废水的pH=___________ 。{Ksp[Cr(OH)3]=6.0×10-31}
(1)生活中明矾常作净水剂,其净水的原理是
(2)常温下,取0.2 mol/L HCl溶液与0.2mol/L MOH溶液等体积混合,测得混合后溶液的pH=5。写出MOH的电离方程式:
(3)0.1mol/L的NaHA溶液,测得溶液显碱性。则
①该溶液中c(H2A)
②作出上述判断的依据是
(4)含Cr2O72-的废水毒性较大,某工厂废水中含5.0×10-3mol/L的Cr2O72-。为了使废水的排放达标,进行如下处理:
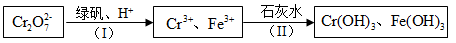
绿矾为FeSO4• 7H2O。反应(I)中Cr2O72-与FeSO4的物质的量之比为
常温下若处理后的废水中c(Cr3+)=6.0×10-7mol/L,则处理后的废水的pH=
您最近一年使用:0次
2016-12-09更新
|
561次组卷
|
4卷引用:2016-2017学年江西省南昌市八一中学等五校高二上联考二化学试卷
4 . 选考[化学与技术]根据废水中所含有害物质的不同,工业上有多种废水的处理方法。
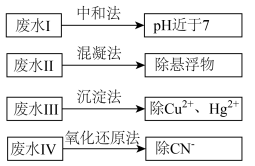
(1)废水I若采用CO2处理,离子方程式是___________ 。
(2)废水Ⅱ常用明矾处理。实践中发现废水中的c(HCO )越大,净水效果越好,这是因为
)越大,净水效果越好,这是因为___________ 。
(3)③废水Ⅲ中的汞元素存在如下转化(在空格上填相应的化学式):Hg2++___________ ═CH3Hg++___________ ;我国规定,Hg2+的排放标准不能超过0.05mg/L。对于含Hg2+的污水,可加入沉淀剂___________ (填写化学式),使Hg2+除去,降低污染。
(4)④废水Ⅳ常用Cl2氧化CN-成CO2和N2,若参加反应的Cl2与CN-的物质的量之比为5:2,则该反应的离子方程式为___________ 。
化学需氧量(COD)可量度水体受有机物污染的程度,它是指在一定条件下,用强氧化剂处理水样时所消耗的氧化剂的量,换算成氧的含量(以mg/L计)。某研究性学习小组测定某水样的化学需氧量(COD),过程如下:
Ⅰ.取V1 mL水样于锥形瓶,加入10.00mL 0.2500mol/L K2Cr2O7溶液。
Ⅱ.加碎瓷片少许,然后慢慢加入硫酸酸化,混合均匀,加热。
Ⅲ.反应完毕后,冷却,加指示剂,用c mol/L的硫酸亚铁铵[(NH4)2Fe(SO4)2]溶液滴定。终点时消耗硫酸亚铁铵溶液V2 mL。
(5)I中,量取K2Cr2O7,溶液的仪器是___________ 。
(6)Ⅲ中,发生的反应为:Cr2O +6Fe2++14H+═2Cr3++6Fe3+7H2O由此可知,该水样的化学需氧量COD=
+6Fe2++14H+═2Cr3++6Fe3+7H2O由此可知,该水样的化学需氧量COD=___________ (用含c、V1、V2的表达式表示)。

(1)废水I若采用CO2处理,离子方程式是
(2)废水Ⅱ常用明矾处理。实践中发现废水中的c(HCO
 )越大,净水效果越好,这是因为
)越大,净水效果越好,这是因为(3)③废水Ⅲ中的汞元素存在如下转化(在空格上填相应的化学式):Hg2++
(4)④废水Ⅳ常用Cl2氧化CN-成CO2和N2,若参加反应的Cl2与CN-的物质的量之比为5:2,则该反应的离子方程式为
化学需氧量(COD)可量度水体受有机物污染的程度,它是指在一定条件下,用强氧化剂处理水样时所消耗的氧化剂的量,换算成氧的含量(以mg/L计)。某研究性学习小组测定某水样的化学需氧量(COD),过程如下:
Ⅰ.取V1 mL水样于锥形瓶,加入10.00mL 0.2500mol/L K2Cr2O7溶液。
Ⅱ.加碎瓷片少许,然后慢慢加入硫酸酸化,混合均匀,加热。
Ⅲ.反应完毕后,冷却,加指示剂,用c mol/L的硫酸亚铁铵[(NH4)2Fe(SO4)2]溶液滴定。终点时消耗硫酸亚铁铵溶液V2 mL。
(5)I中,量取K2Cr2O7,溶液的仪器是
(6)Ⅲ中,发生的反应为:Cr2O
 +6Fe2++14H+═2Cr3++6Fe3+7H2O由此可知,该水样的化学需氧量COD=
+6Fe2++14H+═2Cr3++6Fe3+7H2O由此可知,该水样的化学需氧量COD=
您最近一年使用:0次
12-13高二上·黑龙江·期末
名校
5 . 以下是25℃时几种难溶电解质的溶解度:
在无机化合物的提纯中,常利用难溶电解质的溶解平衡原理除去某些离子,例如:
①为了除去氯化铵中的杂质Fe3+,先将混合物溶于水,再加入一定量的试剂反应,过滤结晶即可;
②为了除去氯化镁晶体中的杂质Fe3+,现将混合物溶于水,再加入足量的氢氧化镁,充分反应,过滤结晶即可;
③为了除去硫酸铜晶体中的杂质Fe2+,先将混合物溶于水,再加入一定量的H2O2,将Fe2+氧化成Fe3+,调节溶液的pH=4,过滤结晶即可;
请回答下列问题:
(1).上述三个除杂方案都能够达到很好的效果,Fe3+、Fe2+都被转化为__________ (填名称)而除去
(2).①中加入的试剂应该选择__________ 为宜。
(3).②中除去Fe3+时所发生的总反应的离子方程式为__________
(4).下列与方案③相关的叙述中,正确的是( )
A.H2O2是绿色氧化剂,在氧化过程中不引进杂质,不产生污染
B.将Fe2+氧化为Fe3+的主要原因是Fe(OH)2沉淀比Fe(OH)3沉淀难过滤
C.调节溶液pH=4可选择的试剂是氢氧化铜或碱式碳酸铜
D.Cu2+可以大量存在于pH=4的溶液中
E.在pH>4的溶液中Fe3+—定不能大量存在
| 难溶电解质 | Mg(OH)2 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 溶解度/g | 9×10-4 | 1.7×10-6 | 1.5×10-4 | 3.0×10-9 |
在无机化合物的提纯中,常利用难溶电解质的溶解平衡原理除去某些离子,例如:
①为了除去氯化铵中的杂质Fe3+,先将混合物溶于水,再加入一定量的试剂反应,过滤结晶即可;
②为了除去氯化镁晶体中的杂质Fe3+,现将混合物溶于水,再加入足量的氢氧化镁,充分反应,过滤结晶即可;
③为了除去硫酸铜晶体中的杂质Fe2+,先将混合物溶于水,再加入一定量的H2O2,将Fe2+氧化成Fe3+,调节溶液的pH=4,过滤结晶即可;
请回答下列问题:
(1).上述三个除杂方案都能够达到很好的效果,Fe3+、Fe2+都被转化为
(2).①中加入的试剂应该选择
(3).②中除去Fe3+时所发生的总反应的离子方程式为
(4).下列与方案③相关的叙述中,正确的是
A.H2O2是绿色氧化剂,在氧化过程中不引进杂质,不产生污染
B.将Fe2+氧化为Fe3+的主要原因是Fe(OH)2沉淀比Fe(OH)3沉淀难过滤
C.调节溶液pH=4可选择的试剂是氢氧化铜或碱式碳酸铜
D.Cu2+可以大量存在于pH=4的溶液中
E.在pH>4的溶液中Fe3+—定不能大量存在
您最近一年使用:0次
2016-12-09更新
|
286次组卷
|
11卷引用:2014届江西省宜春市上高二中高二第六次月考化学试卷
(已下线)2014届江西省宜春市上高二中高二第六次月考化学试卷(已下线)2011-2012学年黑龙江省哈六中高二上学期期末考试化学试卷(已下线)2013届辽宁省鞍山一中上学期期中考试高二年级化学试卷 (已下线)2015安徽望江中学同步课时练(人教选修4)第三章检测试卷2014-2015黑龙江省大庆市铁人中学高二上期末化学试卷2014-2015陕西省西安市一中高二上学期期末化学试卷2015-2016学年湖南省衡阳八中高二上第二次月考化学试卷陕西省西安市第一中学2015-2016学年高二上12月月考化学试卷2015-2016学年内蒙古赤峰市宁城县高二上学期期末考试化学试卷吉林省白城一中2018-2019学年高二上学期期中考试化学试题河北省石家庄市辛集市第一中学2020-2021学年高二月考第四次考试(一)化学试题
10-11高一上·江西宜春·期中
解题方法
6 . (1)Na2SO3溶液蒸干得到的固体物质是___________ ,原因是_____ .
(2)碳酸氢钡溶液蒸干得到的固体物质是___________ ,原因是_________ .
(3)盐酸与硫酸浓度各为1mol/L 的混合酸10mL,加热浓缩至1mL,最后得到的溶液浓度
为_________ ,原因是_____________________________________ 。
(4)与c(H+)·c(OH-)=Kw类似,FeS饱和溶液中存在:FeS(s)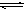 Fe
Fe
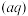 +S
+S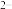
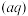 ,c(Fe
,c(Fe )·c(s
)·c(s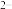 )=Ksp。常温下Ksp=8.1×10-17。(溶液密度为1.0g/cm3)。理论上FeS的溶解度为
)=Ksp。常温下Ksp=8.1×10-17。(溶液密度为1.0g/cm3)。理论上FeS的溶解度为___________________ 。
(2)碳酸氢钡溶液蒸干得到的固体物质是
(3)盐酸与硫酸浓度各为1mol/L 的混合酸10mL,加热浓缩至1mL,最后得到的溶液浓度
为
(4)与c(H+)·c(OH-)=Kw类似,FeS饱和溶液中存在:FeS(s)
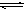 Fe
Fe
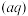 +S
+S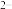
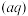 ,c(Fe
,c(Fe )·c(s
)·c(s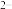 )=Ksp。常温下Ksp=8.1×10-17。(溶液密度为1.0g/cm3)。理论上FeS的溶解度为
)=Ksp。常温下Ksp=8.1×10-17。(溶液密度为1.0g/cm3)。理论上FeS的溶解度为
您最近一年使用:0次
真题
解题方法
7 . 羟基磷灰石[Ca5(PO4)3OH]是一种重要的生物无机材料。其常用的制备方法有两种:
方法A:用浓氨水分别调Ca(NO3)2和(NH4)2HPO4溶液的pH约为12;在剧烈搅拌下,将(NH4)2HPO4溶液缓慢滴入Ca(NO3)2溶液中。
方法B:剧烈搅拌下,将H3PO4溶液缓慢滴加到Ca(OH)2悬浊液中。
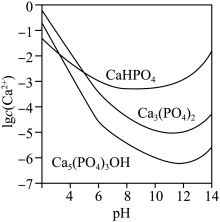
3种钙盐的溶解度随溶液pH的变化如上图所示(图中纵坐标是钙离子浓度的对数),回答下列问题:
(1)完成方法A和方法B中制备Ca5(PO4)3OH的化学反应方程式:
①5Ca(NO3)2+3(NH4)2HPO4+4NH3·H2O=Ca5(PO4)3OH↓+________ +________
②5Ca(OH)2+3H3PO4=________________________________________________
(2)与方法A相比,方法B的优点是______________________________________ 。
(3)方法B中,如果H3PO4溶液滴加过快,制得的产物不纯,其原因是
___________________________________________________________________________ 。
(4)图中所示3种钙盐在人体中最稳定的存在形式是______________ (填化学式)。
(5)糖沾附在牙齿上,在酶的作用下产生酸性物质,易造成龋齿。结合化学平衡移动原理,分析其原因________________________________________________________ 。
方法A:用浓氨水分别调Ca(NO3)2和(NH4)2HPO4溶液的pH约为12;在剧烈搅拌下,将(NH4)2HPO4溶液缓慢滴入Ca(NO3)2溶液中。
方法B:剧烈搅拌下,将H3PO4溶液缓慢滴加到Ca(OH)2悬浊液中。

3种钙盐的溶解度随溶液pH的变化如上图所示(图中纵坐标是钙离子浓度的对数),回答下列问题:
(1)完成方法A和方法B中制备Ca5(PO4)3OH的化学反应方程式:
①5Ca(NO3)2+3(NH4)2HPO4+4NH3·H2O=Ca5(PO4)3OH↓+
②5Ca(OH)2+3H3PO4=
(2)与方法A相比,方法B的优点是
(3)方法B中,如果H3PO4溶液滴加过快,制得的产物不纯,其原因是
(4)图中所示3种钙盐在人体中最稳定的存在形式是
(5)糖沾附在牙齿上,在酶的作用下产生酸性物质,易造成龋齿。结合化学平衡移动原理,分析其原因
您最近一年使用:0次
8 . 已知AgCl为难溶于水和酸的白色固体,Ag2S为难溶于水和酸的黑色固体。向
AgCI和水的悬浊液中加入足量的Na2S溶液并振荡,结果白色固体完全转化为黑色固体:
(1)写出白色固体转化成黑色固体的化学方程式:_______________________ 。
(2)白色固体转化成黑色固体的原因是:_______________________________ 。
AgCI和水的悬浊液中加入足量的Na2S溶液并振荡,结果白色固体完全转化为黑色固体:
(1)写出白色固体转化成黑色固体的化学方程式:
(2)白色固体转化成黑色固体的原因是:
您最近一年使用:0次
9 . 已知以下信息:在浓硫酸中存在平衡:H2SO4 H++HSO4-HSO4-
H++HSO4-HSO4- H++SO42-;PbSO4难溶于水和HNO3,但能溶于浓硫酸和醋酸铵溶液。请回答下列有关问题:
H++SO42-;PbSO4难溶于水和HNO3,但能溶于浓硫酸和醋酸铵溶液。请回答下列有关问题:
(1)在试管中加入少许PbSO4并加入数毫升水,振荡得悬浊液,往该悬浊液中加入适量醋酸铵固体,振荡后得到澄清溶液,该反应发生的原因可能是_________________ 。请写出该反应的离子方程式:________________________ ;
(2)往该澄清溶液中通入H2S气体,有黑色沉淀(PbS)生成,请写出该反应的化学方程式:_______________________ 。
(3)由上面的实验推测,PbSO4和PbS的溶解度_______ 大。
(4)将少量PbSO4粉末投入盛浓硫酸的试管,振荡后也得澄清溶液,请结合平衡移动原理解释PbSO4能溶于浓硫酸的原因________________________ 。
 H++HSO4-HSO4-
H++HSO4-HSO4- H++SO42-;PbSO4难溶于水和HNO3,但能溶于浓硫酸和醋酸铵溶液。请回答下列有关问题:
H++SO42-;PbSO4难溶于水和HNO3,但能溶于浓硫酸和醋酸铵溶液。请回答下列有关问题:(1)在试管中加入少许PbSO4并加入数毫升水,振荡得悬浊液,往该悬浊液中加入适量醋酸铵固体,振荡后得到澄清溶液,该反应发生的原因可能是
(2)往该澄清溶液中通入H2S气体,有黑色沉淀(PbS)生成,请写出该反应的化学方程式:
(3)由上面的实验推测,PbSO4和PbS的溶解度
(4)将少量PbSO4粉末投入盛浓硫酸的试管,振荡后也得澄清溶液,请结合平衡移动原理解释PbSO4能溶于浓硫酸的原因
您最近一年使用:0次



