名校
1 . 电解质水溶液中存在电离平衡,水解平衡、沉淀溶解平衡。请回答下列问题:
(1)常温下,部分弱酸的电离平衡常数如表:
①等浓度 、
、 、
、 和
和 溶液中,碱性最强的是
溶液中,碱性最强的是___________ (写化学式)。
②等浓度的 与
与 混合溶液中离子浓度由大到小的顺序为
混合溶液中离子浓度由大到小的顺序为___________ 。
(2)室温下,用 盐酸溶液滴定
盐酸溶液滴定 氨水溶液,滴定曲线如图所示。
氨水溶液,滴定曲线如图所示。
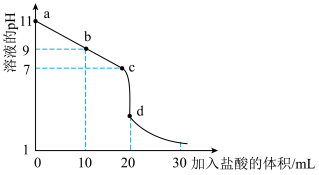
①该中和滴定选用___________ (填“甲基橙”或“酚酞”)作指示剂。
②室温下, 氨水溶液中
氨水溶液中 的电离平衡常数约为
的电离平衡常数约为___________ 
③b点所示的溶液中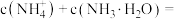
___________ (用溶液的其它离子浓度表示)。
(3)工业上向锅炉里注入所得到的 溶液浸泡,将水垢中的
溶液浸泡,将水垢中的 转化为
转化为 ,写出该反应的离子方程式:
,写出该反应的离子方程式:___________ 。当把水垢中 完全转化时,混合溶液中的
完全转化时,混合溶液中的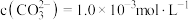 ,则
,则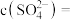
___________  (保留小数点后一位)。
(保留小数点后一位)。
已知: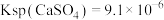 ,
,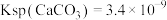
(1)常温下,部分弱酸的电离平衡常数如表:
| 弱酸 |  |  |  |
| 电离平衡常数 | 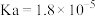 | 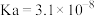 | 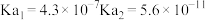 |
 、
、 、
、 和
和 溶液中,碱性最强的是
溶液中,碱性最强的是②等浓度的
 与
与 混合溶液中离子浓度由大到小的顺序为
混合溶液中离子浓度由大到小的顺序为(2)室温下,用
 盐酸溶液滴定
盐酸溶液滴定 氨水溶液,滴定曲线如图所示。
氨水溶液,滴定曲线如图所示。
①该中和滴定选用
②室温下,
 氨水溶液中
氨水溶液中 的电离平衡常数约为
的电离平衡常数约为
③b点所示的溶液中
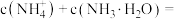
(3)工业上向锅炉里注入所得到的
 溶液浸泡,将水垢中的
溶液浸泡,将水垢中的 转化为
转化为 ,写出该反应的离子方程式:
,写出该反应的离子方程式: 完全转化时,混合溶液中的
完全转化时,混合溶液中的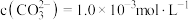 ,则
,则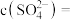
 (保留小数点后一位)。
(保留小数点后一位)。已知:
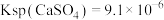 ,
,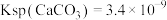
您最近一年使用:0次
解题方法
2 . Ⅰ.在0.1 mol·L-1的重铬酸钾(K2Cr2O7)溶液中存在如下平衡:
Cr2O +H2O
+H2O 2HCrO4
2HCrO4 2CrO
2CrO +2H+
+2H+
(1)在强碱溶液中,铬元素的主要存在形式为_______ (填离子符号),向重铬酸钾溶液中加入适量稀硫酸,溶液中c(Cr2O )/c(CrO
)/c(CrO )将
)将_______ (填“增大”、“减小”或“不变”)。
Ⅱ.已知某溶液中只存在OH-、H+、NH 、Cl-四种离子,某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:并按要求填写下列空白:
、Cl-四种离子,某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:并按要求填写下列空白:
①c(Cl-)>c(NH )>c(H+)>c(OH-) ②c(Cl-)>c(NH
)>c(H+)>c(OH-) ②c(Cl-)>c(NH )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
③c(NH )>c(Cl-)>c(OH-)>c(H+) ④c(Cl-)>c(H+)>c(NH
)>c(Cl-)>c(OH-)>c(H+) ④c(Cl-)>c(H+)>c(NH )>c(OH-)
)>c(OH-)
(2)若溶液中只溶解了一种溶质,则该溶质是_______ ,上述四种离子浓度的大小顺序为_______ (选填序号)。
(3)若上述关系中③是正确的,则溶液中的溶质为_______ ;
(4)若该溶液是由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)_______ c(NH3·H2O) (填“大于”“小于”或“等于”)。
III.重金属离子对河流造成严重污染。某化工厂废水(pH=2.0,d≈1 g·mL-1)中含Ag+,Pb 2+等重金属离子,其浓度各约为0.0lmol·L-1.排放前拟用沉淀法除去这两种离子,查找有关数据如下:
(5)你认为往废水中投入_______(填字母序号),沉淀效果最好。
(6)如果用生石灰处理上述废水,使溶液的pH=8.0,处理后的废水中c(Pb2+)=_______ 。
Cr2O
 +H2O
+H2O 2HCrO4
2HCrO4 2CrO
2CrO +2H+
+2H+(1)在强碱溶液中,铬元素的主要存在形式为
 )/c(CrO
)/c(CrO )将
)将Ⅱ.已知某溶液中只存在OH-、H+、NH
 、Cl-四种离子,某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:并按要求填写下列空白:
、Cl-四种离子,某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:并按要求填写下列空白:①c(Cl-)>c(NH
 )>c(H+)>c(OH-) ②c(Cl-)>c(NH
)>c(H+)>c(OH-) ②c(Cl-)>c(NH )>c(OH-)>c(H+)
)>c(OH-)>c(H+)③c(NH
 )>c(Cl-)>c(OH-)>c(H+) ④c(Cl-)>c(H+)>c(NH
)>c(Cl-)>c(OH-)>c(H+) ④c(Cl-)>c(H+)>c(NH )>c(OH-)
)>c(OH-)(2)若溶液中只溶解了一种溶质,则该溶质是
(3)若上述关系中③是正确的,则溶液中的溶质为
(4)若该溶液是由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)
III.重金属离子对河流造成严重污染。某化工厂废水(pH=2.0,d≈1 g·mL-1)中含Ag+,Pb 2+等重金属离子,其浓度各约为0.0lmol·L-1.排放前拟用沉淀法除去这两种离子,查找有关数据如下:
| 难溶电解质 | AgI | AgOH | Ag2S | PbI2 | Pb(OH)2 | PbS |
| Ksp | 8.3×10-17 | 5.6×10-8 | 6.3×10-50 | 7.1×10-9 | 1.2×10-15 | 3.4×10-28 |
| A.NaOH | B.Na2S | C.KI | D.Ca(OH)2 |
您最近一年使用:0次
名校
解题方法
3 . I.我国《生活饮用水卫生标准》中规定生活用水中镉的排放量不超过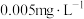 。处理含镉废水可采用化学沉淀法。
。处理含镉废水可采用化学沉淀法。
(1)写出磷酸镉[ ]沉淀溶解平衡常数的表达式:
]沉淀溶解平衡常数的表达式: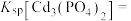
_______ 。
(2)一定温度下, 的
的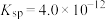 ,
, 的
的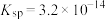 ,该温度下
,该温度下_______ [填“ ”或“
”或“ ”]的饱和溶液中
”]的饱和溶液中 浓度较大。
浓度较大。
(3)向某含镉废水中加入 ,当
,当 浓度达到
浓度达到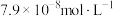 时,废水中
时,废水中 的浓度为
的浓度为____  [已知:
[已知: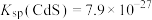 ],此时
],此时____ (填“符合”或“不符合”)《生活饮用水卫生标准》。
II.根据题目提供的溶度积数据进行计算并回答下列问题:
(4)已知25℃时,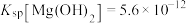 ;酸碱指示剂百里酚蓝变色的pH范围如下:
;酸碱指示剂百里酚蓝变色的pH范围如下:
25℃时,向 饱和溶液中滴加2滴百里酚蓝指示剂,溶液所呈现的颜色为
饱和溶液中滴加2滴百里酚蓝指示剂,溶液所呈现的颜色为_______ 。
(5)常温下,向50mL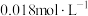 的
的 溶液中加入50mL
溶液中加入50mL 的盐酸,生成沉淀。已知该温度下,
的盐酸,生成沉淀。已知该温度下, ,忽略溶液体积的变化。
,忽略溶液体积的变化。
①反应后,溶液中
_______  。
。
②反应后,溶液的
_______ 。
③如果向反应后的溶液中继续加入50mL 的盐酸,
的盐酸,____ (填“有”或“无”)白色沉淀生成。
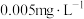 。处理含镉废水可采用化学沉淀法。
。处理含镉废水可采用化学沉淀法。(1)写出磷酸镉[
 ]沉淀溶解平衡常数的表达式:
]沉淀溶解平衡常数的表达式: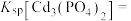
(2)一定温度下,
 的
的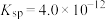 ,
, 的
的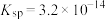 ,该温度下
,该温度下 ”或“
”或“ ”]的饱和溶液中
”]的饱和溶液中 浓度较大。
浓度较大。(3)向某含镉废水中加入
 ,当
,当 浓度达到
浓度达到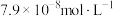 时,废水中
时,废水中 的浓度为
的浓度为 [已知:
[已知: ],此时
],此时II.根据题目提供的溶度积数据进行计算并回答下列问题:
(4)已知25℃时,
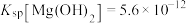 ;酸碱指示剂百里酚蓝变色的pH范围如下:
;酸碱指示剂百里酚蓝变色的pH范围如下:| pH |  | 8.0~9.6 | 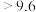 |
| 颜色 | 黄色 | 绿色 | 蓝色 |
 饱和溶液中滴加2滴百里酚蓝指示剂,溶液所呈现的颜色为
饱和溶液中滴加2滴百里酚蓝指示剂,溶液所呈现的颜色为(5)常温下,向50mL
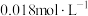 的
的 溶液中加入50mL
溶液中加入50mL 的盐酸,生成沉淀。已知该温度下,
的盐酸,生成沉淀。已知该温度下, ,忽略溶液体积的变化。
,忽略溶液体积的变化。①反应后,溶液中

 。
。②反应后,溶液的

③如果向反应后的溶液中继续加入50mL
 的盐酸,
的盐酸,
您最近一年使用:0次
2022-09-04更新
|
1633次组卷
|
5卷引用:江西省南昌市第一中学2023-2024学年高二上学期11月期中考试化学试题
江西省南昌市第一中学2023-2024学年高二上学期11月期中考试化学试题第三章水溶液中的离子反应与平衡黑龙江省哈尔滨师范大学附属中学2022-2023学年高二上学期期中考试化学试题广东省揭阳市惠来县第一中学2022-2023学年高二上学期12月月考化学试题(已下线)专题突破卷09 水溶液中的离子反应与平衡 ?-2024年高考化学一轮复习考点通关卷(新教材新高考)
4 . 按要求完成下列各空:
(1)25℃时,pH=2的盐酸 L与pH=10的NaOH溶液
L与pH=10的NaOH溶液 L混合,所得溶液pH=4,则
L混合,所得溶液pH=4,则
_______ 。
(2)25℃时,在等体积的①pH=1的 溶液、②
溶液、② 的
的 溶液、③pH=10的
溶液、③pH=10的 溶液、④pH=5的
溶液、④pH=5的 溶液中,发生电离的水的物质的量之比是
溶液中,发生电离的水的物质的量之比是_______ 。
(3) 相等的①
相等的① 溶液、②
溶液、② 溶液、③
溶液、③ 溶液、④
溶液、④ 溶液,其物质的量浓度由大到小的顺序为
溶液,其物质的量浓度由大到小的顺序为_______ 。(填写序号)
(4)向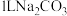 溶液中加入足量
溶液中加入足量 固体,当溶液中
固体,当溶液中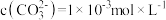 时,此时溶液中
时,此时溶液中
_______  。[已知
。[已知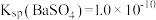 ,
,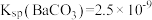 ]
]
(1)25℃时,pH=2的盐酸
 L与pH=10的NaOH溶液
L与pH=10的NaOH溶液 L混合,所得溶液pH=4,则
L混合,所得溶液pH=4,则
(2)25℃时,在等体积的①pH=1的
 溶液、②
溶液、② 的
的 溶液、③pH=10的
溶液、③pH=10的 溶液、④pH=5的
溶液、④pH=5的 溶液中,发生电离的水的物质的量之比是
溶液中,发生电离的水的物质的量之比是(3)
 相等的①
相等的① 溶液、②
溶液、② 溶液、③
溶液、③ 溶液、④
溶液、④ 溶液,其物质的量浓度由大到小的顺序为
溶液,其物质的量浓度由大到小的顺序为(4)向
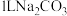 溶液中加入足量
溶液中加入足量 固体,当溶液中
固体,当溶液中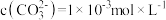 时,此时溶液中
时,此时溶液中
 。[已知
。[已知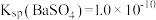 ,
,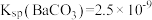 ]
]
您最近一年使用:0次
5 . 氨是重要的基础化工原料,工业上常用于制备氨水、亚硝酸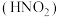 、连二次硝酸
、连二次硝酸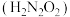 、尿素
、尿素 等多种含氮的化工产品。
等多种含氮的化工产品。
(1)已知: 时,连二次硝酸
时,连二次硝酸 的电离常数为
的电离常数为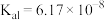 、
、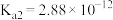 ;往
;往 溶液中滴加氢氧化钠溶液至
溶液中滴加氢氧化钠溶液至 ,
, 、
、 、离子浓度由大到小的顺序为
、离子浓度由大到小的顺序为___________ 。
(2)常温下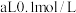 的
的 和
和 的
的 混合,混合后溶液呈中性,
混合,混合后溶液呈中性, 的电离常数为
的电离常数为___________ (用含a、b的式子表示)
(3)向浓度均为 的
的 和
和 混合液中滴加碳酸铵溶液,当加入碳酸铵溶液至生成两种沉淀,则溶液中
混合液中滴加碳酸铵溶液,当加入碳酸铵溶液至生成两种沉淀,则溶液中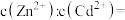
___________ 。[已知: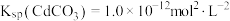 ,
,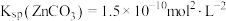 ]
]
可乐中的食品添加剂有白砂糖、二氧化碳、焦糖色、磷酸、咖啡因等。可乐的辛辣味与磷酸(化学式为 ,沸点高难挥发)有一定关系。
,沸点高难挥发)有一定关系。
(4)羟基磷灰石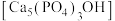 是牙釉质的主要成分,在唾液中存在平衡:
是牙釉质的主要成分,在唾液中存在平衡: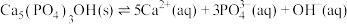 。长期过量饮用可乐会破坏牙釉质,造成龋齿。结合平衡移动原理解释原因:
。长期过量饮用可乐会破坏牙釉质,造成龋齿。结合平衡移动原理解释原因:___________
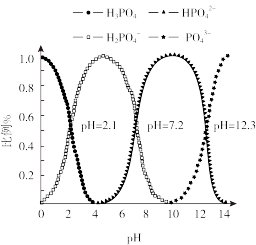
(5)常温下,向磷酸溶液中滴加 溶液,含磷微粒的分布比例与
溶液,含磷微粒的分布比例与 的关系如图所示。
的关系如图所示。 溶液显酸性,下列有关分析正确的是___________。
溶液显酸性,下列有关分析正确的是___________。
(6)联氨(又称联肼, 无色液体)是一种应用广泛的化工原料,可用作火箭燃料,回答下列问题:联氨为二元弱碱,在水中的电离方程式与氨相似,联氨第一步电离的方程式为:
无色液体)是一种应用广泛的化工原料,可用作火箭燃料,回答下列问题:联氨为二元弱碱,在水中的电离方程式与氨相似,联氨第一步电离的方程式为:____________ 平衡常数值为___________ (已知: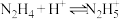 的
的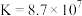 ;
;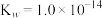 )。
)。
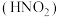 、连二次硝酸
、连二次硝酸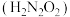 、尿素
、尿素 等多种含氮的化工产品。
等多种含氮的化工产品。(1)已知:
 时,连二次硝酸
时,连二次硝酸 的电离常数为
的电离常数为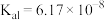 、
、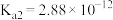 ;往
;往 溶液中滴加氢氧化钠溶液至
溶液中滴加氢氧化钠溶液至 ,
, 、
、 、离子浓度由大到小的顺序为
、离子浓度由大到小的顺序为(2)常温下
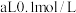 的
的 和
和 的
的 混合,混合后溶液呈中性,
混合,混合后溶液呈中性, 的电离常数为
的电离常数为(3)向浓度均为
 的
的 和
和 混合液中滴加碳酸铵溶液,当加入碳酸铵溶液至生成两种沉淀,则溶液中
混合液中滴加碳酸铵溶液,当加入碳酸铵溶液至生成两种沉淀,则溶液中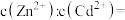
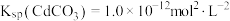 ,
,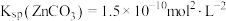 ]
]可乐中的食品添加剂有白砂糖、二氧化碳、焦糖色、磷酸、咖啡因等。可乐的辛辣味与磷酸(化学式为
 ,沸点高难挥发)有一定关系。
,沸点高难挥发)有一定关系。(4)羟基磷灰石
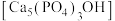 是牙釉质的主要成分,在唾液中存在平衡:
是牙釉质的主要成分,在唾液中存在平衡: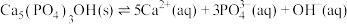 。长期过量饮用可乐会破坏牙釉质,造成龋齿。结合平衡移动原理解释原因:
。长期过量饮用可乐会破坏牙釉质,造成龋齿。结合平衡移动原理解释原因:(5)常温下,向磷酸溶液中滴加
 溶液,含磷微粒的分布比例与
溶液,含磷微粒的分布比例与 的关系如图所示。
的关系如图所示。 溶液显酸性,下列有关分析正确的是___________。
溶液显酸性,下列有关分析正确的是___________。
A.溶液中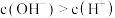 |
B. 的电离程度大于其水解程度 的电离程度大于其水解程度 |
C. c(Na+)+ c(H+)=c(H2PO )+2c(HPO )+2c(HPO )+3c(PO )+3c(PO )+c(OH—) )+c(OH—) |
| D.溶液中水的电离程度比纯水大 |
(6)联氨(又称联肼,
 无色液体)是一种应用广泛的化工原料,可用作火箭燃料,回答下列问题:联氨为二元弱碱,在水中的电离方程式与氨相似,联氨第一步电离的方程式为:
无色液体)是一种应用广泛的化工原料,可用作火箭燃料,回答下列问题:联氨为二元弱碱,在水中的电离方程式与氨相似,联氨第一步电离的方程式为: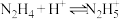 的
的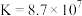 ;
;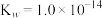 )。
)。
您最近一年使用:0次
名校
6 . 常温下,实验测得0.1mol·L-1下列物质的溶液pH如表所示:
(1)Na2CO3溶液显碱性的主要原因为____ (用离子方程式表示)。
(2)上述CH3COONH4溶液中c(NH )
)____ NH4Cl溶液中c(NH )(填“大于”“小于”或“等于”)。
)(填“大于”“小于”或“等于”)。
(3)有同学认为根据前几组实验结果,无需再实验就可以预测a的值,则a=____ 。
(4)推测上述CH3COONa溶液的pH大于NaHCO3溶液pH的可能原因:____ 。
(5)锅炉水垢的主要成分里含有CaSO4,去除水垢时经常先用饱和Na2CO3溶液浸泡,后用盐酸溶解。请应用化学平衡移动原理解释清洗CaSO4的过程:___ 。
物质 | Na2CO3 | CH3COONa | NaHCO3 | CH3COONH4 | NH4Cl |
溶液pH | 11 | 8.9 | 8.3 | 7.0 | a |
(2)上述CH3COONH4溶液中c(NH
 )
) )(填“大于”“小于”或“等于”)。
)(填“大于”“小于”或“等于”)。(3)有同学认为根据前几组实验结果,无需再实验就可以预测a的值,则a=
(4)推测上述CH3COONa溶液的pH大于NaHCO3溶液pH的可能原因:
(5)锅炉水垢的主要成分里含有CaSO4,去除水垢时经常先用饱和Na2CO3溶液浸泡,后用盐酸溶解。请应用化学平衡移动原理解释清洗CaSO4的过程:
您最近一年使用:0次
2022-01-18更新
|
121次组卷
|
2卷引用:江西省宜春市丰城中学2023-2024学年高二下学期3月月考化学试题
7 . 请回答下列问题:
(1)84消毒液是一种以NaClO为主要成分的高效消毒剂,NaClO溶液呈___________ 性(填“酸”“碱”或“中”),原因可用离子方程式表示为___________ 。
(2)常温下,某柠檬水的pH为3,则其中的c(OH-)为___________ 。
(3)浓度均为0.1mol/L的盐酸、硫酸和醋酸,其中pH最小的是___________ 。
(4)在某温度下,向含有BaSO4固体的BaSO4饱和溶液中加入少量稀硫酸,则c(Ba2+)___________ (填“增大”“减小”或“不变”,下同),Ksp___________ 。
(1)84消毒液是一种以NaClO为主要成分的高效消毒剂,NaClO溶液呈
(2)常温下,某柠檬水的pH为3,则其中的c(OH-)为
(3)浓度均为0.1mol/L的盐酸、硫酸和醋酸,其中pH最小的是
(4)在某温度下,向含有BaSO4固体的BaSO4饱和溶液中加入少量稀硫酸,则c(Ba2+)
您最近一年使用:0次
8 . 在某温度下,向含有AgCl固体的AgCl饱和溶液中加入少量稀盐酸,则AgCl的溶解度___________ (填“增大”“减小”或“不变”,下同),
___________ ,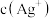
___________ 。

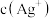
您最近一年使用:0次
2021-12-02更新
|
704次组卷
|
3卷引用:江西省宜春市丰城市东煌学校2023-2024学年高二上学期1月期末化学试题
名校
解题方法
9 . 按要求填写对应的方程式。
(1)泡沫灭火器的反应的离子方程式:___________
(2)铅蓄电池放电时正极的电极方程式:___________
(3)向AgCl悬浊液中滴加Na2S溶液的的离子方程式:___________
(4)电解精炼铜时阴极的电极方程式:___________
(1)泡沫灭火器的反应的离子方程式:
(2)铅蓄电池放电时正极的电极方程式:
(3)向AgCl悬浊液中滴加Na2S溶液的的离子方程式:
(4)电解精炼铜时阴极的电极方程式:
您最近一年使用:0次
名校
解题方法
10 . 氮、磷对水体的污染情况越来越受到人们的重视。回答下列问题:
(1)常温下,在 约为9时,用澄清石灰水可将水体中的
约为9时,用澄清石灰水可将水体中的 转化为
转化为 沉淀除去,该反应的离子方程式为
沉淀除去,该反应的离子方程式为_______ 。
(2)除去地下水中的硝态氮通常用还原剂将其还原为 。
。
①Prusse等提出的用 作催化剂,常温下,在
作催化剂,常温下,在 为4.0~6.0时,可直接用
为4.0~6.0时,可直接用 将
将 还原为
还原为 ,该反应的离子方程式为
,该反应的离子方程式为_______ 。研究发现用 和
和 的混合气体代替
的混合气体代替 ,
, 的去除效果比只用
的去除效果比只用 时更好,其原因是
时更好,其原因是_______ 。
②在 约为5时,用纳米
约为5时,用纳米 粉可将
粉可将 还原为
还原为 ,
, 粉被氧化为
粉被氧化为 ,该反应中氧化产物与还原产物的物质的量之比为
,该反应中氧化产物与还原产物的物质的量之比为_______ 。
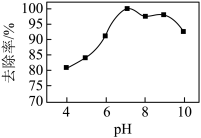
(3)实验测得相同条件下,用次氯酸钠脱除水体中的氨态氮的过程中(
 ),
), 与氨态氮的去除率关系如图所示,在
与氨态氮的去除率关系如图所示,在 大于9时,
大于9时, 越大,去除率越小,其原因是
越大,去除率越小,其原因是_______ 。
(1)常温下,在
 约为9时,用澄清石灰水可将水体中的
约为9时,用澄清石灰水可将水体中的 转化为
转化为 沉淀除去,该反应的离子方程式为
沉淀除去,该反应的离子方程式为(2)除去地下水中的硝态氮通常用还原剂将其还原为
 。
。①Prusse等提出的用
 作催化剂,常温下,在
作催化剂,常温下,在 为4.0~6.0时,可直接用
为4.0~6.0时,可直接用 将
将 还原为
还原为 ,该反应的离子方程式为
,该反应的离子方程式为 和
和 的混合气体代替
的混合气体代替 ,
, 的去除效果比只用
的去除效果比只用 时更好,其原因是
时更好,其原因是②在
 约为5时,用纳米
约为5时,用纳米 粉可将
粉可将 还原为
还原为 ,
, 粉被氧化为
粉被氧化为 ,该反应中氧化产物与还原产物的物质的量之比为
,该反应中氧化产物与还原产物的物质的量之比为(3)实验测得相同条件下,用次氯酸钠脱除水体中的氨态氮的过程中(

 ),
), 与氨态氮的去除率关系如图所示,在
与氨态氮的去除率关系如图所示,在 大于9时,
大于9时, 越大,去除率越小,其原因是
越大,去除率越小,其原因是
您最近一年使用:0次
2021-09-14更新
|
395次组卷
|
10卷引用:江西省丰城市第九中学2022-2023学年高三上学期摸底考(日新班)化学试题
江西省丰城市第九中学2022-2023学年高三上学期摸底考(日新班)化学试题山东省临沂市第一中学2020届高三10月月考化学试题2019年湖北省黄冈市高三11月新高考备考监测联考化学试题山东省新高考备考监测2020届高三10月联考化学试题(已下线)考点11 弱电解质的电离及溶液pH-2020年高考化学命题预测与模拟试题分类精编广东省普通高中2022届高三9月阶段性质量检测化学试题(已下线)第14周 周测卷-备战2022年高考化学周测与晚练(新高考专用)吉林省长春吉大附中实验学校2021-2022学年高三上学期第三次摸底考试化学试题黑龙江省牡丹江市第二高级中学2022-2023学年高三上学期第三次月考化学试题(已下线)第3讲 氧化还原反应



