解题方法
1 . 三氯化铬( )为紫色单斜晶体,熔点为83℃,易潮解,易升华,能溶于水但不易水解,高温下能被氧气氧化,工业上主要用作媒染剂和催化剂。
)为紫色单斜晶体,熔点为83℃,易潮解,易升华,能溶于水但不易水解,高温下能被氧气氧化,工业上主要用作媒染剂和催化剂。
(1)某化学小组用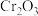 和
和 在高温下制备无水三氯化铬,部分实验装置如图所示,其中锥形瓶内装有
在高温下制备无水三氯化铬,部分实验装置如图所示,其中锥形瓶内装有 ,其沸点为76.8℃。
,其沸点为76.8℃。________ 。
(2)装置D中还会生成光气( ),D中反应的化学方程式为
),D中反应的化学方程式为________ 。
(3)该实验装置有设计不合理的地方,请写出改进方法:________ 。(写一点即可)
(4)为进一步探究 的性质,某同学取试管若干支,分别加入10滴0.1
的性质,某同学取试管若干支,分别加入10滴0.1
 溶液,并用4滴2
溶液,并用4滴2
 酸化,再分别加入不同滴数的0.1
酸化,再分别加入不同滴数的0.1
 溶液,并在不同的温度下进行实验,反应现象记录于表中。
溶液,并在不同的温度下进行实验,反应现象记录于表中。
①浓度对反应的影响: 与
与 在常温下反应,观察不到
在常温下反应,观察不到 离子的橙色,甲同学认为其中一个原因是
离子的橙色,甲同学认为其中一个原因是 离子的橙色被
离子的橙色被 离子的紫红色掩盖,另一种可能的原因是
离子的紫红色掩盖,另一种可能的原因是_______ 。所以必须将反应液加热至沸腾4~5min后,才能观察到反应液由紫红色逐渐变为橙黄色的实验现象。
② 与
与 的用量对反应的影响对表中数据进行分析,在上述反应条件下,欲将
的用量对反应的影响对表中数据进行分析,在上述反应条件下,欲将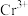 氧化为
氧化为 ,
, 与
与 最佳用量比为
最佳用量比为______ 。这与由反应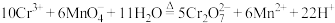 所推断得到的用量比不符,你推测的原因是
所推断得到的用量比不符,你推测的原因是________ 。
(5)Cr(Ⅲ)的存在形态的物质的量分数随溶液pH的分布如图所示。请补充完整由 溶液制备纯净的
溶液制备纯净的 的实验方案:取适量
的实验方案:取适量 溶液,
溶液,_______ ;充分反应后过滤,用蒸馏水洗涤沉淀,低温烘干沉淀,得到 晶体。
晶体。
 )为紫色单斜晶体,熔点为83℃,易潮解,易升华,能溶于水但不易水解,高温下能被氧气氧化,工业上主要用作媒染剂和催化剂。
)为紫色单斜晶体,熔点为83℃,易潮解,易升华,能溶于水但不易水解,高温下能被氧气氧化,工业上主要用作媒染剂和催化剂。(1)某化学小组用
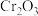 和
和 在高温下制备无水三氯化铬,部分实验装置如图所示,其中锥形瓶内装有
在高温下制备无水三氯化铬,部分实验装置如图所示,其中锥形瓶内装有 ,其沸点为76.8℃。
,其沸点为76.8℃。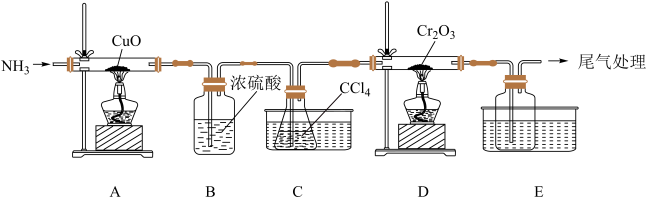
(2)装置D中还会生成光气(
 ),D中反应的化学方程式为
),D中反应的化学方程式为(3)该实验装置有设计不合理的地方,请写出改进方法:
(4)为进一步探究
 的性质,某同学取试管若干支,分别加入10滴0.1
的性质,某同学取试管若干支,分别加入10滴0.1
 溶液,并用4滴2
溶液,并用4滴2
 酸化,再分别加入不同滴数的0.1
酸化,再分别加入不同滴数的0.1
 溶液,并在不同的温度下进行实验,反应现象记录于表中。
溶液,并在不同的温度下进行实验,反应现象记录于表中。 的用量(滴数) 的用量(滴数) | 在不同温度下的反应现象 | |
| 25℃ | 90~100℃ | |
| 1 | 紫红色 | 蓝绿色溶液 |
| 2~3 | 紫红色 | 黄绿色溶液,且随 滴数增加,黄色成分增多 滴数增加,黄色成分增多 |
| 10 | 紫红色 | 澄清的橙黄色溶液 |
| 11~23 | 紫红色 | 橙黄色溶液,有棕褐色沉淀,且随 滴数增加,沉淀增多 滴数增加,沉淀增多 |
| 24~25 | 紫红色 | 紫红色溶液,有较多的棕褐色沉淀 |
 与
与 在常温下反应,观察不到
在常温下反应,观察不到 离子的橙色,甲同学认为其中一个原因是
离子的橙色,甲同学认为其中一个原因是 离子的橙色被
离子的橙色被 离子的紫红色掩盖,另一种可能的原因是
离子的紫红色掩盖,另一种可能的原因是②
 与
与 的用量对反应的影响对表中数据进行分析,在上述反应条件下,欲将
的用量对反应的影响对表中数据进行分析,在上述反应条件下,欲将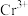 氧化为
氧化为 ,
, 与
与 最佳用量比为
最佳用量比为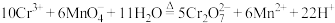 所推断得到的用量比不符,你推测的原因是
所推断得到的用量比不符,你推测的原因是(5)Cr(Ⅲ)的存在形态的物质的量分数随溶液pH的分布如图所示。请补充完整由
 溶液制备纯净的
溶液制备纯净的 的实验方案:取适量
的实验方案:取适量 溶液,
溶液, 晶体。
晶体。
您最近一年使用:0次
名校
解题方法
2 . 氯化钡是重要的化工原料,是制备其他钡盐的主要中间原料,以毒重石(主要成分为 ,还含有
,还含有 及含Ca、Mg、Fe、Al的化合物)为原料制备
及含Ca、Mg、Fe、Al的化合物)为原料制备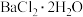 的工艺流程如下:
的工艺流程如下: 、
、 、
、 、
、 形式存在于溶液中。
形式存在于溶液中。
回答下列问题:
(1)在“浸取”时,除温度、酸的浓度、液固比等因素影响钡的浸出率外,还有___________ 因素。
(2)下表列举了不同温度、盐酸的浓度、液固比下钡的浸出率实验数据,每个实验只改变一个条件:
分析表中数据,温度越高钡的浸出率越低的可能原因是___________ ;判断“浸取”的最佳液固比为___________ 。
(3)常温时,几种金属离子沉淀的pH如图所示,加 时发生反应的离子方程式为
时发生反应的离子方程式为___________ ;“调pH(Ⅰ)”时,调节溶液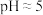 ,则“滤渣Ⅱ”的主要成分为
,则“滤渣Ⅱ”的主要成分为___________ (填化学式)。___________ 。
 ,还含有
,还含有 及含Ca、Mg、Fe、Al的化合物)为原料制备
及含Ca、Mg、Fe、Al的化合物)为原料制备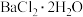 的工艺流程如下:
的工艺流程如下: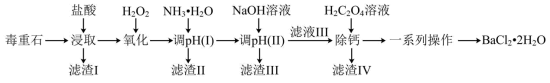
 、
、 、
、 、
、 形式存在于溶液中。
形式存在于溶液中。回答下列问题:
(1)在“浸取”时,除温度、酸的浓度、液固比等因素影响钡的浸出率外,还有
(2)下表列举了不同温度、盐酸的浓度、液固比下钡的浸出率实验数据,每个实验只改变一个条件:
| 改变的条件 | 温度(℃) | 盐酸的浓度(%) | 液固比 | ||||||||
| 30 | 55 | 75 | 10 | 15 | 20 | 25 | 3:1 | 4:1 | 5:1 | 6:1 | |
| 钡的浸出率(%) | 74.31 | 69.60 | 68.42 | 59.21 | 74.31 | 74.15 | 55.32 | 59.84 | 65.12 | 74.31 | 74.35 |
(3)常温时,几种金属离子沉淀的pH如图所示,加
 时发生反应的离子方程式为
时发生反应的离子方程式为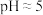 ,则“滤渣Ⅱ”的主要成分为
,则“滤渣Ⅱ”的主要成分为
您最近一年使用:0次
名校
解题方法
3 . 高磷镍铁是生产钙镁磷肥的副产品。以高磷镍铁(主要含金属单质 、
、 、非金属单质P,还含有少量
、非金属单质P,还含有少量 、
、 、
、 的磷化物)为原料生产硫酸镍晶体
的磷化物)为原料生产硫酸镍晶体 的工艺流程如图。
的工艺流程如图。
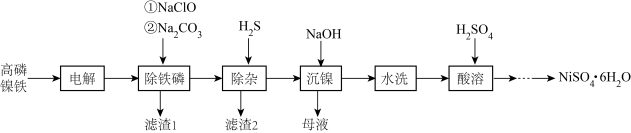
(1)“电解”时,选用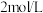 硫酸溶液为电解液。将高磷镍铁制成电极板,则该电极板作
硫酸溶液为电解液。将高磷镍铁制成电极板,则该电极板作___________ (填“阳极”或“阴极”);另一极的主要电极反应为:_____________________ 。此外,溶液中的 有部分在阴极放电。
有部分在阴极放电。
(2)“沉镍”时,离子方程式为___________________________________________ ,为确保镍沉淀完全,理论上应调节溶液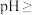
_____________ (已知:在该工业环境下, ;当溶液中离子浓度
;当溶液中离子浓度 时,可认为该离子沉淀完全)。
时,可认为该离子沉淀完全)。
(3)已知: 时,
时, 、
、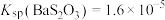 。向上述流程制得的
。向上述流程制得的 溶液中加入
溶液中加入 固体,充分反应后,过滤可得到
固体,充分反应后,过滤可得到 溶液。生成
溶液。生成 的化学方程式为
的化学方程式为________ 。
(4)从 溶液里获取
溶液里获取 的操作主要有:
的操作主要有:___________ 、__________ 、过滤、洗涤、干燥。
 、
、 、非金属单质P,还含有少量
、非金属单质P,还含有少量 、
、 、
、 的磷化物)为原料生产硫酸镍晶体
的磷化物)为原料生产硫酸镍晶体 的工艺流程如图。
的工艺流程如图。
(1)“电解”时,选用
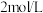 硫酸溶液为电解液。将高磷镍铁制成电极板,则该电极板作
硫酸溶液为电解液。将高磷镍铁制成电极板,则该电极板作 有部分在阴极放电。
有部分在阴极放电。(2)“沉镍”时,离子方程式为
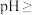
 ;当溶液中离子浓度
;当溶液中离子浓度 时,可认为该离子沉淀完全)。
时,可认为该离子沉淀完全)。(3)已知:
 时,
时, 、
、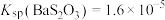 。向上述流程制得的
。向上述流程制得的 溶液中加入
溶液中加入 固体,充分反应后,过滤可得到
固体,充分反应后,过滤可得到 溶液。生成
溶液。生成 的化学方程式为
的化学方程式为(4)从
 溶液里获取
溶液里获取 的操作主要有:
的操作主要有:
您最近一年使用:0次
2024-03-01更新
|
109次组卷
|
2卷引用:江西省上饶市2023-2024学年高二上学期期末教学质量测试化学试卷
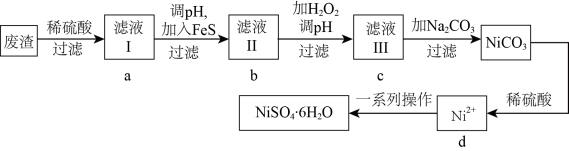
4 .  是一种绿色易溶于水的晶体,可由电镀废渣(除镍外,还含有铜、锌、铁等元素的化合物杂质)为原料获得。操作步骤如图:
是一种绿色易溶于水的晶体,可由电镀废渣(除镍外,还含有铜、锌、铁等元素的化合物杂质)为原料获得。操作步骤如图:
已知:各离子开始沉淀及完全沉淀时的 如表所示:
如表所示:
根据要求回答下列问题
(1)基态 原子核外电子的空间运动状态有
原子核外电子的空间运动状态有______________ 种,画出基态原子的价电子轨道表示式______________ 。
(2)向滤液Ⅰ中加入 固体是为了生成更难溶于水的硫化物沉淀而除去
固体是为了生成更难溶于水的硫化物沉淀而除去 、
、 等杂质,则除去
等杂质,则除去 的离子方程式为
的离子方程式为_______________________________________ ,当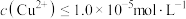 时,可认为
时,可认为 已沉淀完全,此时溶液中
已沉淀完全,此时溶液中 的浓度不小于
的浓度不小于_____________ 。[已知: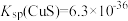 ]
]
(3)根据对滤液Ⅱ的操作作答:
①向滤液Ⅱ中加 的目的是将
的目的是将 氧化成
氧化成 ,试从结构的角度解释
,试从结构的角度解释 易被氧化为
易被氧化为 的原因
的原因__________________________ ;
②调节滤液Ⅱ的 ,
, 应控制在范围为
应控制在范围为__________________________ ;
③检验滤液Ⅲ中杂质金属离子是否除尽最合理的试剂是_______________________________________ 。
(4)滤液Ⅲ溶质的主要成分是 ,加
,加 过滤后得到
过滤后得到 固体,再加适量稀硫酸溶解又生成
固体,再加适量稀硫酸溶解又生成 ,这两步操作的目的是
,这两步操作的目的是_______________________________________ 。
 是一种绿色易溶于水的晶体,可由电镀废渣(除镍外,还含有铜、锌、铁等元素的化合物杂质)为原料获得。操作步骤如图:
是一种绿色易溶于水的晶体,可由电镀废渣(除镍外,还含有铜、锌、铁等元素的化合物杂质)为原料获得。操作步骤如图:
已知:各离子开始沉淀及完全沉淀时的
 如表所示:
如表所示:离子 | 开始沉淀时的 | 完全沉淀时的 |
| 6.3 | 9.7 |
| 2.2 | 3.2 |
| 6.4 | 8.4 |
(1)基态
 原子核外电子的空间运动状态有
原子核外电子的空间运动状态有(2)向滤液Ⅰ中加入
 固体是为了生成更难溶于水的硫化物沉淀而除去
固体是为了生成更难溶于水的硫化物沉淀而除去 、
、 等杂质,则除去
等杂质,则除去 的离子方程式为
的离子方程式为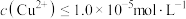 时,可认为
时,可认为 已沉淀完全,此时溶液中
已沉淀完全,此时溶液中 的浓度不小于
的浓度不小于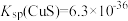 ]
](3)根据对滤液Ⅱ的操作作答:
①向滤液Ⅱ中加
 的目的是将
的目的是将 氧化成
氧化成 ,试从结构的角度解释
,试从结构的角度解释 易被氧化为
易被氧化为 的原因
的原因②调节滤液Ⅱ的
 ,
, 应控制在范围为
应控制在范围为③检验滤液Ⅲ中杂质金属离子是否除尽最合理的试剂是
(4)滤液Ⅲ溶质的主要成分是
 ,加
,加 过滤后得到
过滤后得到 固体,再加适量稀硫酸溶解又生成
固体,再加适量稀硫酸溶解又生成 ,这两步操作的目的是
,这两步操作的目的是
您最近一年使用:0次
名校
解题方法
5 . MnO2是重要化工原料,由软锰矿制备MnO2的一种工艺流程如下:

资料:
①软锰矿的主要成分为MnO2,主要杂质有Al2O3和SiO2。
②金属离子沉淀的pH:
③该工艺条件下,MnO2与H2SO4不反应。
(1)溶出
①溶出前,软锰矿需研磨,目的是___________ 。
②溶出时,Fe的氧化过程及得到Mn2+的主要途径如图所示:
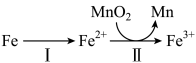
i.II是从软锰矿中溶出Mn2+的主要反应,反应的离子方程式是___________ 。
ii.若I中Fe2+全部来自于反应Fe+2H+=Fe2++H2↑,完全溶出Mn2+所需Fe与MnO2的物质的量比值为2,而实际比值(0.9)小于2,原因是___________ 。
(2)纯化
已知:MnO2的氧化性与溶液pH有关。纯化时先加入MnO2后加入NH3·H2O,调溶液pH,说明试剂加入顺序及调节pH的原因:___________ 。
(3)电解
Mn2+纯化液经电解得MnO2,生成1molMnO2电子转移的数目为___________ 。
(4)产品纯度测定
向ag产品中依次加入足量bgNa2C2O4和足量稀H2SO4,如热至充分反应,生成CO2,再滴加cmol/L KMnO4溶液至剩余Na2C2O4恰好完全反应,消耗KMnO4溶液的体积为dL,产品纯度为___________ (用质量分数表示)。[已知:MnO2及 均被还原为Mn2+,M(MnO2)=86.94g/mol、M(Na2C2O4)=134.0g/mo]
均被还原为Mn2+,M(MnO2)=86.94g/mol、M(Na2C2O4)=134.0g/mo]

资料:
①软锰矿的主要成分为MnO2,主要杂质有Al2O3和SiO2。
②金属离子沉淀的pH:
| Fe3+ | A13+ | Mn2+ | Fe2+ | |
| 开始沉淀时 | 1.5 | 3.4 | 5.8 | 6.3 |
| 完全沉淀时 | 2.8 | 4.7 | 7.8 | 8.3 |
(1)溶出
①溶出前,软锰矿需研磨,目的是
②溶出时,Fe的氧化过程及得到Mn2+的主要途径如图所示:

i.II是从软锰矿中溶出Mn2+的主要反应,反应的离子方程式是
ii.若I中Fe2+全部来自于反应Fe+2H+=Fe2++H2↑,完全溶出Mn2+所需Fe与MnO2的物质的量比值为2,而实际比值(0.9)小于2,原因是
(2)纯化
已知:MnO2的氧化性与溶液pH有关。纯化时先加入MnO2后加入NH3·H2O,调溶液pH,说明试剂加入顺序及调节pH的原因:
(3)电解
Mn2+纯化液经电解得MnO2,生成1molMnO2电子转移的数目为
(4)产品纯度测定
向ag产品中依次加入足量bgNa2C2O4和足量稀H2SO4,如热至充分反应,生成CO2,再滴加cmol/L KMnO4溶液至剩余Na2C2O4恰好完全反应,消耗KMnO4溶液的体积为dL,产品纯度为
 均被还原为Mn2+,M(MnO2)=86.94g/mol、M(Na2C2O4)=134.0g/mo]
均被还原为Mn2+,M(MnO2)=86.94g/mol、M(Na2C2O4)=134.0g/mo]
您最近一年使用:0次
2023-12-15更新
|
175次组卷
|
3卷引用:江西省上饶市广丰一中2023-2024学年高二上学期12月考试化学试卷
名校
解题方法
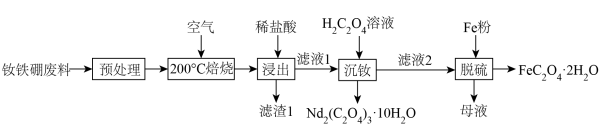
6 . 钕铁硼废料是一种具有较高经济价值的废弃物,主要成分为稀土元素钕(Nd)、Fe、B.一种采用分步沉淀从钕铁硼油泥中回收Nd2(C2O4)3·10H2O和FeC2O4·2H2O的工艺流程如图:
②H2CO4易与Fe3+形成多种配合物离子,易与Fe2+形成FeC2O4·2H2O沉淀。
回答下列问题:
(1)“预处理”是洗去钕铁硼表面的油污,可选择___________ (填化学式)溶液。
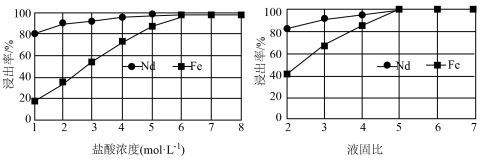
(2)“滤渣1”的主要成分是___________ (填名称)。“浸出”时,盐酸浓度和液固比对钕、铁的浸出率影响如图所示,则浸出过程的最佳条件是___________ 。___________ 。
(4)“沉铁”时,加入铁粉的作用是___________ 。
(5)FeC2O4·2H2O晶体结构片段如图所示。___________ ;碳原子采用___________ 杂化。现测定草酸亚铁晶体纯度。准确称取Wg样品于锥形瓶,加入适量的稀硫酸,用cmol·L-1KMnO4溶液滴定至终点,消耗KMnO4溶液bmL。滴定反应: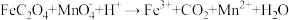 (未配平)。该样品纯度为
(未配平)。该样品纯度为___________ %。
②H2CO4易与Fe3+形成多种配合物离子,易与Fe2+形成FeC2O4·2H2O沉淀。
回答下列问题:
(1)“预处理”是洗去钕铁硼表面的油污,可选择
(2)“滤渣1”的主要成分是
(4)“沉铁”时,加入铁粉的作用是
(5)FeC2O4·2H2O晶体结构片段如图所示。
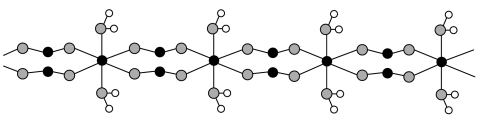
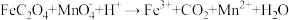 (未配平)。该样品纯度为
(未配平)。该样品纯度为
您最近一年使用:0次
2023-11-01更新
|
1024次组卷
|
5卷引用:2024届江西省南昌市第十九中学高三下学期模拟预测化学试题
名校
解题方法
7 . 铋酸钠( )是常用的氧化剂,
)是常用的氧化剂, 是活性电极。以辉铋矿(主要成分为
是活性电极。以辉铋矿(主要成分为 ,含
,含 、
、 杂质)和软锰矿(主要成分是
杂质)和软锰矿(主要成分是 )为原料联合焙烧制备
)为原料联合焙烧制备 和
和 ,流程如下:
,流程如下:
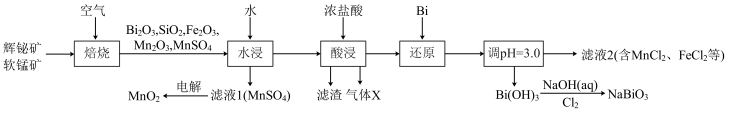
已知:①金属活动性: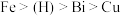 。
。
②几种金属离子的氢氧化物沉淀pH如下:
回答下列问题:
(1) 中Bi的化合价为
中Bi的化合价为___________ 。气体X是___________ (填化学式)。
(2)“焙烧”中 和
和 与空气反应生成
与空气反应生成 和
和 ,写出其反应的化学方程式:
,写出其反应的化学方程式:___________ 。被还原的元素是___________ (填元素符号)。
(3)“还原”中Bi的作用是___________ 。
(4)检验滤液2中是否有 的试剂是
的试剂是___________ (填化学式)。
(5)已知 难溶于水,
难溶于水, 难溶于冷水,写出常温下利用
难溶于冷水,写出常温下利用 制备
制备 的离子方程式:
的离子方程式:___________ 。
(6)为探究 和
和 的氧化性相对强弱,设计如下实验:
的氧化性相对强弱,设计如下实验:

实验中观察到试管B中溶液变蓝色。
由上述实验现象可知,氧化性:
___________  (填“>”或“<”)。与根据第(5)小题得出的
(填“>”或“<”)。与根据第(5)小题得出的 与
与 氧化性强弱关系相反,其主要原因是
氧化性强弱关系相反,其主要原因是___________ 。
 )是常用的氧化剂,
)是常用的氧化剂, 是活性电极。以辉铋矿(主要成分为
是活性电极。以辉铋矿(主要成分为 ,含
,含 、
、 杂质)和软锰矿(主要成分是
杂质)和软锰矿(主要成分是 )为原料联合焙烧制备
)为原料联合焙烧制备 和
和 ,流程如下:
,流程如下:
已知:①金属活动性:
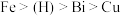 。
。②几种金属离子的氢氧化物沉淀pH如下:
| 金属离子 | 开始沉淀的pH | 完全沉淀的pH |
 | 1.5 | 2.8 |
 | 6.3 | 8.3 |
 | 8.1 | 10.1 |
(1)
 中Bi的化合价为
中Bi的化合价为(2)“焙烧”中
 和
和 与空气反应生成
与空气反应生成 和
和 ,写出其反应的化学方程式:
,写出其反应的化学方程式:(3)“还原”中Bi的作用是
(4)检验滤液2中是否有
 的试剂是
的试剂是(5)已知
 难溶于水,
难溶于水, 难溶于冷水,写出常温下利用
难溶于冷水,写出常温下利用 制备
制备 的离子方程式:
的离子方程式:(6)为探究
 和
和 的氧化性相对强弱,设计如下实验:
的氧化性相对强弱,设计如下实验:
实验中观察到试管B中溶液变蓝色。
由上述实验现象可知,氧化性:

 (填“>”或“<”)。与根据第(5)小题得出的
(填“>”或“<”)。与根据第(5)小题得出的 与
与 氧化性强弱关系相反,其主要原因是
氧化性强弱关系相反,其主要原因是
您最近一年使用:0次
2023-10-19更新
|
198次组卷
|
2卷引用:江西省大余中学2023-2024学年高三上学期10月月考化学试题
8 . 一种废镍催化剂中含有Ni、Al、Cr、Cu、FeS及碳粉,以其为原料制备环烷酸镍[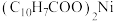 ,常温下为难溶于水的液体]的工艺流程如图所示:
,常温下为难溶于水的液体]的工艺流程如图所示:
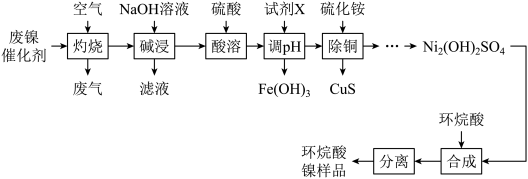
该工艺条件下,溶液中金属离子开始沉淀和完全沉淀的pH如表所示:
回答下列问题:
(1)“灼烧”后Cr转化为 ,已知
,已知 与
与 性质相似,则滤液中阴离子有
性质相似,则滤液中阴离子有 、
、___________ 。基态Cr原子的价层电子排布式为___________ 。
(2)“酸溶”时,先加入一定量的水,然后分次加入浓硫酸,与直接用稀硫酸溶解相比,其优点是___________ 。
(3)“调pH”时,溶液pH的范围为___________ 。
(4)常温下,CuS的 极小,用
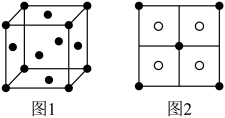
极小,用 可将
可将 完全沉淀。CuS晶胞中
完全沉淀。CuS晶胞中 的位置如图1所示,
的位置如图1所示, 位于
位于 所构成的四面体中心,晶胞侧视图如图2所示。
所构成的四面体中心,晶胞侧视图如图2所示。
①与 距离最近的
距离最近的 数目为
数目为___________ 。
②CuS的晶胞参数为apm,阿伏加德罗常数的值为 ,则CuS晶体的密度为
,则CuS晶体的密度为___________  。
。
(5)环烷酸的化学式为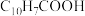 ,写出“合成”反应的化学方程式:
,写出“合成”反应的化学方程式:___________ 。
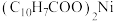 ,常温下为难溶于水的液体]的工艺流程如图所示:
,常温下为难溶于水的液体]的工艺流程如图所示:
该工艺条件下,溶液中金属离子开始沉淀和完全沉淀的pH如表所示:
| 金属离子 |  |  |  |  |
| 开始沉淀的pH | 1.9 | 7.0 | 6.4 | 5.4 |
| 完全沉淀的pH | 3.2 | 9.0 | 8.4 | 6.7 |
(1)“灼烧”后Cr转化为
 ,已知
,已知 与
与 性质相似,则滤液中阴离子有
性质相似,则滤液中阴离子有 、
、(2)“酸溶”时,先加入一定量的水,然后分次加入浓硫酸,与直接用稀硫酸溶解相比,其优点是
(3)“调pH”时,溶液pH的范围为
(4)常温下,CuS的
 极小,用
极小,用 可将
可将 完全沉淀。CuS晶胞中
完全沉淀。CuS晶胞中 的位置如图1所示,
的位置如图1所示, 位于
位于 所构成的四面体中心,晶胞侧视图如图2所示。
所构成的四面体中心,晶胞侧视图如图2所示。
①与
 距离最近的
距离最近的 数目为
数目为②CuS的晶胞参数为apm,阿伏加德罗常数的值为
 ,则CuS晶体的密度为
,则CuS晶体的密度为 。
。(5)环烷酸的化学式为
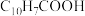 ,写出“合成”反应的化学方程式:
,写出“合成”反应的化学方程式:
您最近一年使用:0次
2023-10-16更新
|
240次组卷
|
2卷引用:江西省宜春市丰城市第九中学2023-2024学年高三上学期12月月考化学试题
名校
9 . 锂离子电池的应用很广泛,某种锂电池的正极材料为钴酸锂,该材料可以由海水(含较大浓度的LiCI及少量MgCl2、CaCl2、MnCl2等)为原料制备,其工艺流程如图所示:
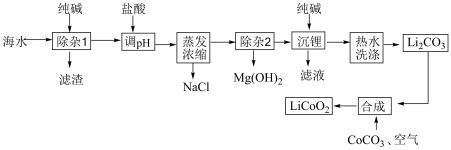
已知:①在常温下几种难溶物质的溶度积常数如表
②Li2CO3微溶于热水,可溶于冷水。回答下列问题:
(1)“除杂1”步骤中除去的杂质离子为Mg2+和_____ 。
(2)“调pH”的目的是_____ 。
(3)金属镁可以通过电解熔融MgC12得到,写出由Mg(OH)2沉淀制MgCl2固体的具体操作_____ 。
(4)20℃时碳酸锂在水中的溶解度为1.295g,饱和溶液密度为1.0148g/cm3,其中Li2CO3的物质的量浓度为_____ 。(结果保留2位有效数字)
(5)“热水洗涤”的目的是_____ 。在实验室里洗涤Li2CO3时会采用如图所示装置,该装置较于普通过滤装置的优点为_____ 。
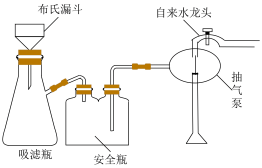
(6)“合成”工序需要高温条件,并放出能使澄清石灰水变浑浊的气体,写出该反应的化学方程式_____ 。

已知:①在常温下几种难溶物质的溶度积常数如表
| 物质 | Li2CO3 | MgCO3 | CaCO3 | MnCO3 | Mg(OH)2 |
| K | 2.5×10-2 | 6.8×10-6 | 3.4×10-9 | 2.3×10-11 | 5.6×10-12 |
(1)“除杂1”步骤中除去的杂质离子为Mg2+和
(2)“调pH”的目的是
(3)金属镁可以通过电解熔融MgC12得到,写出由Mg(OH)2沉淀制MgCl2固体的具体操作
(4)20℃时碳酸锂在水中的溶解度为1.295g,饱和溶液密度为1.0148g/cm3,其中Li2CO3的物质的量浓度为
(5)“热水洗涤”的目的是

(6)“合成”工序需要高温条件,并放出能使澄清石灰水变浑浊的气体,写出该反应的化学方程式
您最近一年使用:0次
名校
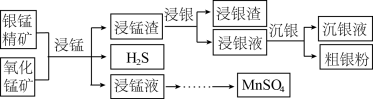
10 . 以银锰精矿(主要含 、MnS、
、MnS、 )和氧化锰矿(主要含
)和氧化锰矿(主要含 )为原料联合提取银和锰的一种流程示意图如下:
)为原料联合提取银和锰的一种流程示意图如下:
已知:Ⅰ.酸性条件下, 的氧化性强于
的氧化性强于 ;
;
Ⅱ.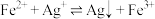 。
。
(1)“浸锰”过程是在 溶液中使矿石中的锰元素浸出,同时去除
溶液中使矿石中的锰元素浸出,同时去除 ,有利于后续银的浸出,矿石中的银以
,有利于后续银的浸出,矿石中的银以 的形式残留于浸锰渣中。
的形式残留于浸锰渣中。
①写出Mn元素基态原子的价层电子排布式:________ 。
②“浸锰”过程中,发生反应: ,则可推断:
,则可推断: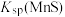
________ (填“>”或“<”)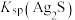 。
。
③在 溶液中,银锰精矿中的
溶液中,银锰精矿中的 和氧化锰矿中的
和氧化锰矿中的 发生反应,则浸锰液中主要的金属阳离子有
发生反应,则浸锰液中主要的金属阳离子有________ 。
(2)“浸银”时,使用过量 、HCl和
、HCl和 的混合液作为浸出剂,将
的混合液作为浸出剂,将 中的银以
中的银以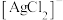 形式浸出。
形式浸出。
①将“浸银”反应的离子方程式补充完整:_____ 。
________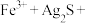 ________
________ ________
________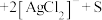
②结合平衡移动原理,解释浸出剂中 、
、 的作用:
的作用:________ 。
(3)“沉银”过程中需要过量的铁粉作为还原剂。
①该步反应的离子方程式有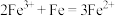 和
和________ 。
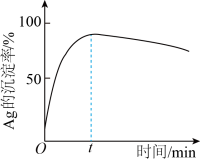
②一定温度下,Ag的沉淀率随反应时间的变化如图所示。解释t分钟后Ag的沉淀率逐渐减小的原因:________ 。
(4)结合“浸锰”过程,从两种矿石中各物质利用的角度,分析这种联合提取银和锰方法的优势:________ 。
 、MnS、
、MnS、 )和氧化锰矿(主要含
)和氧化锰矿(主要含 )为原料联合提取银和锰的一种流程示意图如下:
)为原料联合提取银和锰的一种流程示意图如下:
已知:Ⅰ.酸性条件下,
 的氧化性强于
的氧化性强于 ;
;Ⅱ.
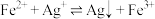 。
。(1)“浸锰”过程是在
 溶液中使矿石中的锰元素浸出,同时去除
溶液中使矿石中的锰元素浸出,同时去除 ,有利于后续银的浸出,矿石中的银以
,有利于后续银的浸出,矿石中的银以 的形式残留于浸锰渣中。
的形式残留于浸锰渣中。①写出Mn元素基态原子的价层电子排布式:
②“浸锰”过程中,发生反应:
 ,则可推断:
,则可推断: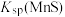
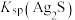 。
。③在
 溶液中,银锰精矿中的
溶液中,银锰精矿中的 和氧化锰矿中的
和氧化锰矿中的 发生反应,则浸锰液中主要的金属阳离子有
发生反应,则浸锰液中主要的金属阳离子有(2)“浸银”时,使用过量
 、HCl和
、HCl和 的混合液作为浸出剂,将
的混合液作为浸出剂,将 中的银以
中的银以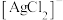 形式浸出。
形式浸出。①将“浸银”反应的离子方程式补充完整:
________
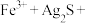 ________
________ ________
________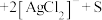
②结合平衡移动原理,解释浸出剂中
 、
、 的作用:
的作用:(3)“沉银”过程中需要过量的铁粉作为还原剂。
①该步反应的离子方程式有
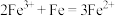 和
和②一定温度下,Ag的沉淀率随反应时间的变化如图所示。解释t分钟后Ag的沉淀率逐渐减小的原因:

(4)结合“浸锰”过程,从两种矿石中各物质利用的角度,分析这种联合提取银和锰方法的优势:
您最近一年使用:0次
2023-07-19更新
|
593次组卷
|
2卷引用:江西省宜春市宜丰中学2023-2024学年高三上学期12月月考化学试题



