解题方法
1 . 新一代脱硝催化剂(SCR)(主要含TiO2、V2O5,及SiO2、Al2O3等)。该SCR的使用寿命为3年左右,废弃SCR回收再利用至关重要。湿法回收SCR的工艺流程如下:
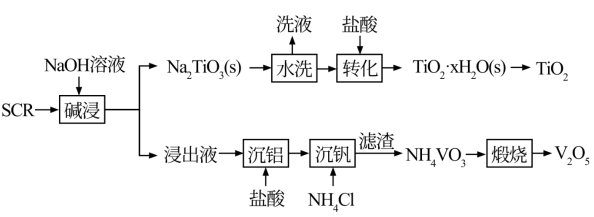
已知:V2O5是两性氧化物,在弱碱性条件下即可生成VO3,VO3易水解。Na₂TiO3难溶于水。回答下列问题:
(1)“碱浸”时,提高浸出率的措施有___________ (写出一种措施即可)。
(2)“沉铝”过程中得到的沉淀主要成分是___________ (填化学式)
(3)“转化”时的离子方程式为___________ 。
(4)“沉钒”中析出NH4VO3晶体时,需要加入过量的NH4C1,其原因是___________ 。
(5)已知NH4VO3难溶于水,Ksp=3.0×10-8,向10mL0.1mol·L-1NaVO3的滤液中加入等体积的NH4Cl溶液(忽略混合过程中的体积变化),欲使VO 沉淀完全,则NH4Cl溶液的最小浓度为
沉淀完全,则NH4Cl溶液的最小浓度为___________ (溶液中某离子浓度≤1×10-5mol·L-1时,认为该离子沉淀完全)。
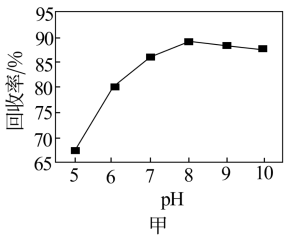
(6)钒回收率随溶液pH的变化如图甲所示,试分析pH在8左右时钒回收率最高的原因:___________ 。
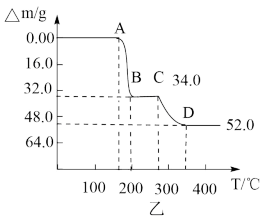
(7)为研究“煅烧”过程中发生的化学变化,某研究小组取234gNH4VO3进行探究,煅烧过程中减少的质量(Δm)随温度变化的曲线如图乙所示,则D点所得物质的化学式为___________

已知:V2O5是两性氧化物,在弱碱性条件下即可生成VO3,VO3易水解。Na₂TiO3难溶于水。回答下列问题:
(1)“碱浸”时,提高浸出率的措施有
(2)“沉铝”过程中得到的沉淀主要成分是
(3)“转化”时的离子方程式为
(4)“沉钒”中析出NH4VO3晶体时,需要加入过量的NH4C1,其原因是
(5)已知NH4VO3难溶于水,Ksp=3.0×10-8,向10mL0.1mol·L-1NaVO3的滤液中加入等体积的NH4Cl溶液(忽略混合过程中的体积变化),欲使VO
 沉淀完全,则NH4Cl溶液的最小浓度为
沉淀完全,则NH4Cl溶液的最小浓度为(6)钒回收率随溶液pH的变化如图甲所示,试分析pH在8左右时钒回收率最高的原因:

(7)为研究“煅烧”过程中发生的化学变化,某研究小组取234gNH4VO3进行探究,煅烧过程中减少的质量(Δm)随温度变化的曲线如图乙所示,则D点所得物质的化学式为

您最近一年使用:0次
2 . 利用水钴矿(主要成分为 ,含少量
,含少量 、
、 、MnO、MgO、CaO、
、MnO、MgO、CaO、 等)可以制取多种化工试剂,以下为草酸钴晶体和氯化钴晶体的制备工艺流程。
等)可以制取多种化工试剂,以下为草酸钴晶体和氯化钴晶体的制备工艺流程。
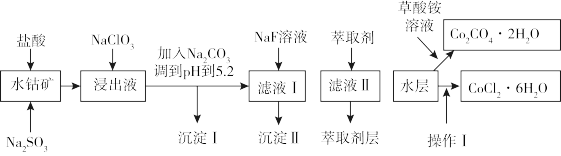
该工艺条件下,溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
回答下列问题:
(1)“浸出”过程中 发生反应的离子方程式为
发生反应的离子方程式为_______ 。
(2) 在浸出液中发生反应的离子方程式为
在浸出液中发生反应的离子方程式为_______ 。
(3)加入 调pH至5.2,目的是
调pH至5.2,目的是_______ ;加萃取剂的目的是除去锰元素,则沉淀Ⅱ的主要成分为_______ (填化学式)。
(4)“操作Ⅰ”包括:将水层加入浓盐酸调整pH为2〜3,_______ 、_______ 、过滤、洗涤、减压烘干等过程。
(5)将5.49g草酸钴晶体( )置于空气中加热,受热过程中不同温度范围内分别得到一种固体物质,其质量如表。
)置于空气中加热,受热过程中不同温度范围内分别得到一种固体物质,其质量如表。
经测定,整个受热过程,只产生水蒸气和 气体,则在290〜320℃温度范围,剩余固体物质的化学式为
气体,则在290〜320℃温度范围,剩余固体物质的化学式为_______ 。(已知: 的摩尔质量为
的摩尔质量为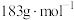 )
)
 ,含少量
,含少量 、
、 、MnO、MgO、CaO、
、MnO、MgO、CaO、 等)可以制取多种化工试剂,以下为草酸钴晶体和氯化钴晶体的制备工艺流程。
等)可以制取多种化工试剂,以下为草酸钴晶体和氯化钴晶体的制备工艺流程。
该工艺条件下,溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
| 金属离子 |  |  |  |  |  |
| 开始沉淀pH | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀pH | 3.7 | 9. 6 | 9.2 | 5.2 | 9.8 |
(1)“浸出”过程中
 发生反应的离子方程式为
发生反应的离子方程式为(2)
 在浸出液中发生反应的离子方程式为
在浸出液中发生反应的离子方程式为(3)加入
 调pH至5.2,目的是
调pH至5.2,目的是(4)“操作Ⅰ”包括:将水层加入浓盐酸调整pH为2〜3,
(5)将5.49g草酸钴晶体(
 )置于空气中加热,受热过程中不同温度范围内分别得到一种固体物质,其质量如表。
)置于空气中加热,受热过程中不同温度范围内分别得到一种固体物质,其质量如表。| 温度范围/℃ | 固体质量/g |
| 150〜210 | 4.41 |
| 290〜320 | 2.41 |
 气体,则在290〜320℃温度范围,剩余固体物质的化学式为
气体,则在290〜320℃温度范围,剩余固体物质的化学式为 的摩尔质量为
的摩尔质量为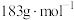 )
)
您最近一年使用:0次
名校
解题方法
3 . 锌灰是热镀锌厂和电解锌厂在生产过程中产生的一种副产品,主要成分是氧化锌和金属锌,杂质为PbO、FeO、Fe3O4、Cu等。利用锌灰生产皓矾(ZnSO4·7H2O)和ZnO等化工产品的工艺流程之一如下:
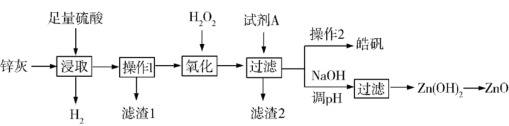
已知pH>11.5时,Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-。下表列出了几种离子生成氢氧化物沉淀的pH:
请回答下列问题:
(1)“滤渣1”的主要成分是___________ 。
(2)加入过量H2O2的目的是___________ (结合离子方程式回答),除去剩余H2O2的简便方法是___________ 。
(3)“试剂A”最好是下列物质中的___________。
(4)“操作2”包括蒸发浓缩、___________ 、过滤洗涤。
(5)加NaOH调pH时,应该控制的pH范围是___________ 。

已知pH>11.5时,Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-。下表列出了几种离子生成氢氧化物沉淀的pH:
| 开始沉淀的pH | 完全沉淀的pH | |
| Fe3+ | 1.5 | 3.2 |
| Fe2+ | 6.5 | 9.0 |
| Zn2+ | 5.6 | 8.1 |
| Pb2+ | 6.6 | 9.1 |
请回答下列问题:
(1)“滤渣1”的主要成分是
(2)加入过量H2O2的目的是
(3)“试剂A”最好是下列物质中的___________。
| A.NH3·H2O | B.Zn | C.NaOH | D.ZnCO3 |
(5)加NaOH调pH时,应该控制的pH范围是
您最近一年使用:0次
2021-12-31更新
|
194次组卷
|
2卷引用:江西省赣州市教育发展联盟2021-2022学年高二上学期第7次联考化学试题
名校
4 . 某科研人员以废镍催化剂(主要成分为 ,另含
,另含 、
、 、
、 、
、 )为原料回收镍,工艺流程如图:
)为原料回收镍,工艺流程如图:
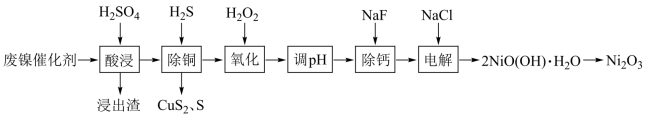
已知:常温下,有关氢氧化物开始沉淀和沉淀完全的 如表:
如表:
回答下列问题:
(1)浸出渣主要成分为___________ 、___________ (填化学式)。
(2)“除铜”时, 与
与 反应的离子方程式为
反应的离子方程式为___________ 。
(3)“氧化”的目的是将溶液中的 氧化为
氧化为 ,温度需控制在
,温度需控制在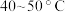 之间,该步骤温度不能太高的原因是
之间,该步骤温度不能太高的原因是___________ 。
(4)“调 ”时,
”时, 的控制范围为
的控制范围为___________ 。
(5)“除钙”后,若溶液中 浓度为
浓度为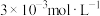 ,则
,则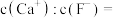
___________ 。[已知常温下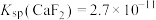 ]
]
 ,另含
,另含 、
、 、
、 、
、 )为原料回收镍,工艺流程如图:
)为原料回收镍,工艺流程如图:
已知:常温下,有关氢氧化物开始沉淀和沉淀完全的
 如表:
如表: |  |  |
| 1.5 | 6.5 | 7.7 |
| 3.7 | 9.7 | 9.2 |
回答下列问题:
(1)浸出渣主要成分为
(2)“除铜”时,
 与
与 反应的离子方程式为
反应的离子方程式为(3)“氧化”的目的是将溶液中的
 氧化为
氧化为 ,温度需控制在
,温度需控制在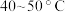 之间,该步骤温度不能太高的原因是
之间,该步骤温度不能太高的原因是(4)“调
 ”时,
”时, 的控制范围为
的控制范围为(5)“除钙”后,若溶液中
 浓度为
浓度为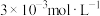 ,则
,则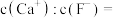
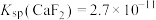 ]
]
您最近一年使用:0次
2021-12-09更新
|
985次组卷
|
4卷引用:江西省六校2021-2022学年高二上学期期末联考化学试题
名校
5 . “翠矾”(NiSO4·7H2O)在印染工业作媒染剂,生产酞菁艳蓝络合剂;氟镍化钾(K2NiF4)是结构化学研究的热点物质。以镍废渣(主要成分为Ni,含少量Fe、Al、Fe3O4、Al2O3和不溶性杂质等)为原料合成“翠矾”和氟镍化钾的流程如下:
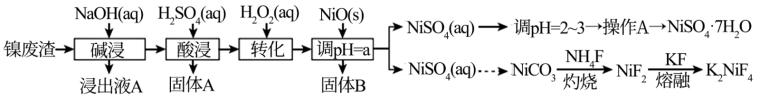
几种金属离子的氢氧化物沉淀pH如表:
请回答下列问题:
(1)“碱浸”过程中,为提高浸出率,可采取的措施是___________ (写一种即可)。
(2)“转化”过程中加入H2O2的目的是___________ (用离子方程式表示),经实验测定该过程温度高于40℃,转化率急速降低的原因可能是______________________ 。
(3)调节pH=a,其中a的取值范围是___________ 。
(4)写出“灼烧”NiCO3和NH4F的混合物时的化学反应方程式:___________ ,为避免污染环境,选择下列装置吸收尾气,最宜选择___________ (填选项)。
A.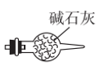 B.
B.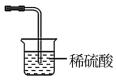
C.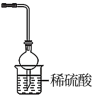 D.
D.

几种金属离子的氢氧化物沉淀pH如表:
| 金属离子 | 开始沉淀的pH | 完全沉淀的pH |
| Fe3+ | 2.7 | 3.7 |
| Al3+ | 3.8 | 5.2 |
| Fe2+ | 7.6 | 9.7 |
| Ni2+ | 7.1 | 9.2 |
(1)“碱浸”过程中,为提高浸出率,可采取的措施是
(2)“转化”过程中加入H2O2的目的是
(3)调节pH=a,其中a的取值范围是
(4)写出“灼烧”NiCO3和NH4F的混合物时的化学反应方程式:
A.
 B.
B.
C.
 D.
D.
您最近一年使用:0次
2021-11-05更新
|
98次组卷
|
3卷引用:江西省赣州市赣县第三中学2021-2022学年高三上学期10月月考化学试题
名校
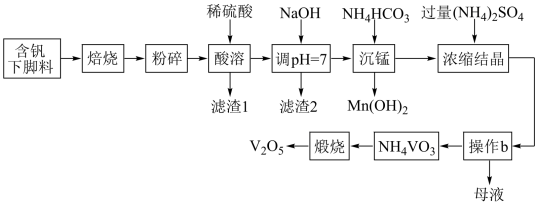
6 . V2O5是硫酸生产中的催化剂,某种含钒工业下脚料主要成分是V2O3,其中含铝、硅、铜、锰等氧化物及油脂等杂质,一种以该下脚料为原料提取V2O5的工艺流程如下:
已知:i.V2O5+2H+=2VO +H2O;VO
+H2O;VO +H2O⇌VO
+H2O⇌VO +2H+。
+2H+。
ii.常温时,有关氢氧化物的溶度积常数如下表:
回答下列问题:
(1)“焙烧”可以除去油脂,还有一个作用是_______ 。
(2)将焙烧冷却后的固体残留物进行“粉碎”,其目的是_______ 。
(3)“滤渣1”的主要成分是_______ (写化学式),“调pH=7”,析出沉淀后,滤液中c(Cu2+):c(Al3+)=_______ 。
(4)“沉锰”反应的离子方程式是_______ 。
(5)“浓缩结晶”时,需要加入过量(NH4)2SO4,其原因是_______ 。
(6)利用制得的V2O5可通过电解的方法制备金属钒,电解装置如图:
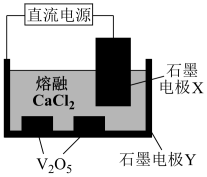
石墨电极Y接直流电源_______ (填“正极”或“负极”),阴极反应式是_______ 。

已知:i.V2O5+2H+=2VO
 +H2O;VO
+H2O;VO +H2O⇌VO
+H2O⇌VO +2H+。
+2H+。ii.常温时,有关氢氧化物的溶度积常数如下表:
| 氢氧化物 | Mn(OH)2 | Cu(OH)2 | Al(OH)3 |
| Ksp | 4.00×10-14 | 2.20×10-20 | 1.90×10-33 |
回答下列问题:
(1)“焙烧”可以除去油脂,还有一个作用是
(2)将焙烧冷却后的固体残留物进行“粉碎”,其目的是
(3)“滤渣1”的主要成分是
(4)“沉锰”反应的离子方程式是
(5)“浓缩结晶”时,需要加入过量(NH4)2SO4,其原因是
(6)利用制得的V2O5可通过电解的方法制备金属钒,电解装置如图:

石墨电极Y接直流电源
您最近一年使用:0次
2021高三·山东·专题练习
名校
解题方法
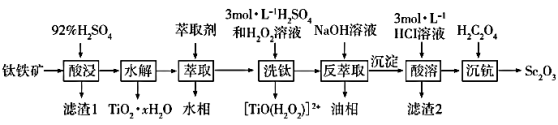
7 . 氧化钪(Sc2O3)是一种稀土氧化物,广泛地应用于航天、激光、导弹等尖端科学领域。钛铁矿主要成分为TiO2、FeO、Fe2O3,还含有Mg、Si、Sc等元素,从钛铁矿中提取Sc2O3的流程如图:
已知:①当离子浓度减小至10-5 mol·L-1时可认为沉淀完全。
②室温下TiO2+完全沉淀的pH为1.05
③Ksp[Fe(OH)3]=4.0×10-38,Ksp[Sc(OH)3]=1.25×10-33,lg2=0.3。
回答下列问题:
(1)“酸浸”时,要适当升高温度或将钛铁矿粉碎等措施,其目的是___________ 。
(2)“酸浸”后Ti元素转化为TiOSO4,其水解反应的化学方程式是
___________ 。
(3)“洗钛”时H2O2的作用之一是与TiO2+反应生成[TiO(H2O2)]2+,该离子为橘黄色的稳定离子,Ti的化合价为___________ ,H2O2还起到的作用是___________ 。
(4)“酸溶”后滤液中存在的金属阳离子Sc3+、TiO2+、Fe3+浓度均小于0.01 mol·L-1,再用氨水调节溶液pH使TiO2+、Fe3+沉淀完全而Sc3+不沉淀,则调pH应控制的范围是___________ 。
(5)加草酸“沉钪”的离子方程式为___________ ,获得Sc2O3的实验操作方法是___________ 。

已知:①当离子浓度减小至10-5 mol·L-1时可认为沉淀完全。
②室温下TiO2+完全沉淀的pH为1.05
③Ksp[Fe(OH)3]=4.0×10-38,Ksp[Sc(OH)3]=1.25×10-33,lg2=0.3。
回答下列问题:
(1)“酸浸”时,要适当升高温度或将钛铁矿粉碎等措施,其目的是
(2)“酸浸”后Ti元素转化为TiOSO4,其水解反应的化学方程式是

(3)“洗钛”时H2O2的作用之一是与TiO2+反应生成[TiO(H2O2)]2+,该离子为橘黄色的稳定离子,Ti的化合价为
(4)“酸溶”后滤液中存在的金属阳离子Sc3+、TiO2+、Fe3+浓度均小于0.01 mol·L-1,再用氨水调节溶液pH使TiO2+、Fe3+沉淀完全而Sc3+不沉淀,则调pH应控制的范围是
(5)加草酸“沉钪”的离子方程式为
您最近一年使用:0次
名校
解题方法
8 . 对电镀污泥(含Cu,Ca,Ni,Fe的氢氧化物)进行无害化和资源化处理,从其中回收金属、并制备硫酸镍的工艺流程如下图所示:
已知:氯酸不稳定,易发生歧化反应,可生成 气体。
气体。
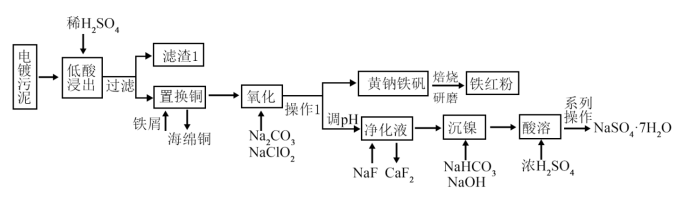
(1)“低酸浸出”工序提高浸出率的措施为___________ (只写一条即可),实验室配制500mL 1.84mol/L该低酸溶液应量取质量分数为98%,密度为 的浓硫酸
的浓硫酸___________ mL。
(2)“氧化”工序中被氧化的元素为___________ (填元素符号),“氧化”工序中加入试剂 调pH的原因为
调pH的原因为___________ (结合离子方程式解释原因),写出氧化工序生成黄钠铁矾 的离子方程式
的离子方程式___________ 。
(3)控制净化液的pH不能过低,否则会导致 沉淀不完全,原因为
沉淀不完全,原因为___________ [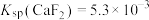 ,
,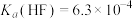 ]。
]。
(4)酸溶后的“系列操作”为___________ ,过滤、洗涤、干燥,该结晶工序得到的废液可以返回___________ 工序循环利用。
已知:氯酸不稳定,易发生歧化反应,可生成
 气体。
气体。
(1)“低酸浸出”工序提高浸出率的措施为
 的浓硫酸
的浓硫酸(2)“氧化”工序中被氧化的元素为
 调pH的原因为
调pH的原因为 的离子方程式
的离子方程式(3)控制净化液的pH不能过低,否则会导致
 沉淀不完全,原因为
沉淀不完全,原因为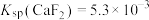 ,
,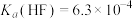 ]。
]。(4)酸溶后的“系列操作”为
您最近一年使用:0次
2021-10-17更新
|
41次组卷
|
2卷引用:江西省抚州市临川区第十中学2022届高三月考化学试卷
名校
解题方法
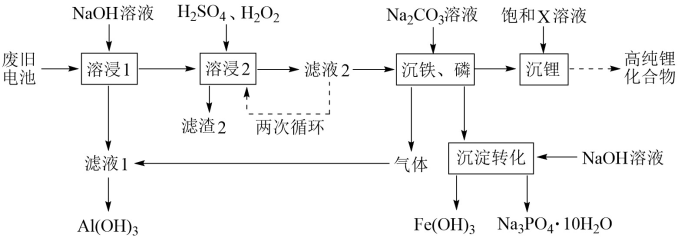
9 . 从废旧磷酸铁锂电池的正极材料(含LiFePO4、石墨粉和铝箔等)中综合回收锂、铁和磷等的工艺流程如图所示:
回答下列问题:
(1)“溶浸1”中铝溶解的化学方程式为___________ 。
(2)完成“溶浸2”反应的离子方程式________
 LiFePO4+
LiFePO4+ H2O2+
H2O2+ ___________=
___________= Li++
Li++ ___________+
___________+ H2PO
H2PO +
+ H2O
H2O
(3)“滤渣2”的主要成分是___________ 。
(4)“滤液2”循环两次的目的是___________ 。
(5)“沉铁、磷”时,析出FePO4沉淀,反应的离子方程式为___________ 。
(6)为了充分沉淀,“沉锂”时所用的X和适宜温度是___________(填标号)。

 | 0 | 20 | 40 | 60 | 80 | 100 |
| LiOH | 11.9 | 12.4 | 13.2 | 14.6 | 16.6 | 19.1 |
| Li2CO3 | 1.54 | 1.33 | 1.17 | 1.01 | 0.85 | 0.72 |
(1)“溶浸1”中铝溶解的化学方程式为
(2)完成“溶浸2”反应的离子方程式
 LiFePO4+
LiFePO4+ H2O2+
H2O2+ ___________=
___________= Li++
Li++ ___________+
___________+ H2PO
H2PO +
+ H2O
H2O(3)“滤渣2”的主要成分是
(4)“滤液2”循环两次的目的是
(5)“沉铁、磷”时,析出FePO4沉淀,反应的离子方程式为
(6)为了充分沉淀,“沉锂”时所用的X和适宜温度是___________(填标号)。
| A.NaOH 20-40℃ | B.NaOH 80-100℃ |
| C.Na2CO3 20-40℃ | D.Na2CO3 60-80℃ |
您最近一年使用:0次
2021-09-28更新
|
79次组卷
|
2卷引用:江西省上高二中2022届高三第二次月考化学试卷
10 . 近年来,随着锂离子电池的广泛应用,废锂离子电池的回收处理至关重要。下面是利用废锂离子电池正极材料(有Al、LiCoO2、Ni、Mn、Fe等)回收钴、镍、锂的流程图。
已知:Ksp[Fe(OH)3]=4×10-38,Ksp[Al(OH)3]=1.3×10-33,P204[二(2-乙基己基)磷酸酯]常用于萃取锰,P507(2-乙基己基磷酸-2-乙基己酯)和Cyanex272[二(2,4,4)三甲基戊基次磷酸]常用于萃取钴和镍。

回答下列问题:
(1)在硫酸存在的条件下,正极材料粉末中LiCoO2与H2O2反应能生成使带火星木条复燃的气体,请写出反应的化学方程式:___________ ,将浸出液pH调至4的目的是___________ 。
(2)已知P507萃取金属离子的原理为nHR(Org)+Mn+(aq)⇌MRn(Org)+nH+(aq),且随着萃取过程中pH降低,萃取效率下降。萃取前先用NaOH对萃取剂进行皂化处理,皂化萃取剂萃取金属离子的反应为nNaR(Org)+Mn+(aq)⇌MRn(Org)+nNa+(aq)。对萃取剂进行皂化处理的原因为___________ 。
(3)控制水相pH=5.2,温度25℃,分别用P507、Cyanex272作萃取剂,萃取剂浓度对萃取分离钴、镍的影响实验结果如图所示。
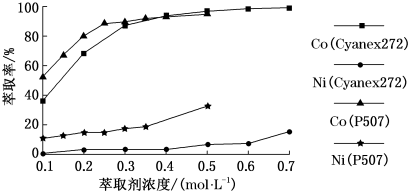
由图可知,钴、镍的萃取率随萃取剂浓度增大而___________ (填“增大”或“减小”);两种萃取剂中___________ (填“P507”或“Cyanex272”)的分离效果比较好,若选P507为萃取剂,则最适宜的萃取剂浓度大约为___________ mol·L-1。
(4)室温下,用NaOH溶液调节钴萃余液的pH=12,搅拌一段时间后,静置,离心分离得到淡绿色氢氧化镍固体,镍沉淀率可达99.62%。已知Ksp[Ni(OH)2]=5.25×10-16,则沉镍母液中Ni2+的浓度为2.1×10-11 mol·L-1时,pH=___________ (lg5=0.7)。
已知:Ksp[Fe(OH)3]=4×10-38,Ksp[Al(OH)3]=1.3×10-33,P204[二(2-乙基己基)磷酸酯]常用于萃取锰,P507(2-乙基己基磷酸-2-乙基己酯)和Cyanex272[二(2,4,4)三甲基戊基次磷酸]常用于萃取钴和镍。

回答下列问题:
(1)在硫酸存在的条件下,正极材料粉末中LiCoO2与H2O2反应能生成使带火星木条复燃的气体,请写出反应的化学方程式:
(2)已知P507萃取金属离子的原理为nHR(Org)+Mn+(aq)⇌MRn(Org)+nH+(aq),且随着萃取过程中pH降低,萃取效率下降。萃取前先用NaOH对萃取剂进行皂化处理,皂化萃取剂萃取金属离子的反应为nNaR(Org)+Mn+(aq)⇌MRn(Org)+nNa+(aq)。对萃取剂进行皂化处理的原因为
(3)控制水相pH=5.2,温度25℃,分别用P507、Cyanex272作萃取剂,萃取剂浓度对萃取分离钴、镍的影响实验结果如图所示。

由图可知,钴、镍的萃取率随萃取剂浓度增大而
(4)室温下,用NaOH溶液调节钴萃余液的pH=12,搅拌一段时间后,静置,离心分离得到淡绿色氢氧化镍固体,镍沉淀率可达99.62%。已知Ksp[Ni(OH)2]=5.25×10-16,则沉镍母液中Ni2+的浓度为2.1×10-11 mol·L-1时,pH=
您最近一年使用:0次



