名校
解题方法
1 . 某NiO的废料中有FeO、CuO、Al2O3、MgO、SiO2等杂质,用此废料提取NiSO4和Ni的流程如下:

已知:有关金属离子生成氢氧化物沉淀所需的pH如下表:
(1)滤渣1的主要成分为_______ 。
(2)从滤液2中获得NiSO4∙6H2O的实验操作_______ 、_______ 、过滤、洗涤、干燥。
(3)用离子方程式解释加入H2O2的作用______ 。
(4)加NiO调节溶液的pH至3.2,则生成沉淀的离子方程式_______ 。
(5)电解浓缩后的滤液2可获得金属镍,其基本反应原理如图:

若一段时间后,在A、B两极均收集到11.2L气体(标准状况下),能得到Ni______ g。

已知:有关金属离子生成氢氧化物沉淀所需的pH如下表:
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Ni(OH)2 | Fe(OH)2 | Mg(OH)2 |
| 开始沉淀时pH | 1.5 | 3.6 | 7.3 | 7.0 | 9.6 |
| 完全沉淀时pH | 3.8 | 4.7 | 9.3 | 9.0 | 12.0 |
(1)滤渣1的主要成分为
(2)从滤液2中获得NiSO4∙6H2O的实验操作
(3)用离子方程式解释加入H2O2的作用
(4)加NiO调节溶液的pH至3.2,则生成沉淀的离子方程式
(5)电解浓缩后的滤液2可获得金属镍,其基本反应原理如图:

若一段时间后,在A、B两极均收集到11.2L气体(标准状况下),能得到Ni
您最近一年使用:0次
2 . 碳酸锶(SrCO3)是一种重要的工业原料,广泛用于生产锶铁氧体磁性材料。一种以菱锶矿(主要含有SrCO3及少量MgCO3、CaCO3、BaCO3等)制备高纯碳酸锶的工艺流程如图所示。
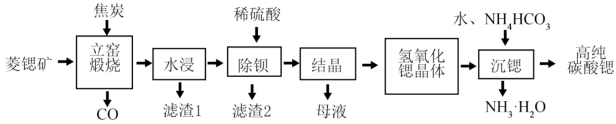
已知:①不溶性碳酸盐高温下分解,生成金属氧化物和CO2,可溶性碳酸盐高温不分解。
②298K时,Ksp[SrCO3]=5.6×10-10、Ksp[CaCO3]=3.36×10-9
③Sr(OH)2在水中的溶解度数据如表:
回答下列问题:
(1)SrCO3中Sr的化合价____ 。
(2)向“立窑煅烧”中投料前,将菱锶矿、焦炭混合粉碎的目的是____ (任写两点)。
(3)“水浸”中用____ (填“冷水”、“热水”),“滤渣1”中含有焦炭、MgO和____ (填化学式)。
(4)“立窑煅烧”中SrCO3与焦炭反应的化学方程式为____ 。
(5)“沉锶”中反应的化学方程式为____ 。
(6)计算298K时,反应CaCO3(s)+Sr2+(aq) SrCO3(s)+Ca2+(aq)平衡常数的数值是
SrCO3(s)+Ca2+(aq)平衡常数的数值是____ 。

已知:①不溶性碳酸盐高温下分解,生成金属氧化物和CO2,可溶性碳酸盐高温不分解。
②298K时,Ksp[SrCO3]=5.6×10-10、Ksp[CaCO3]=3.36×10-9
③Sr(OH)2在水中的溶解度数据如表:
| 温度/℃ | 10 | 60 | 90 | 100 |
| 溶解度/(g/100g) | 1.25 | 8.42 | 44.5 | 91.2 |
回答下列问题:
(1)SrCO3中Sr的化合价
(2)向“立窑煅烧”中投料前,将菱锶矿、焦炭混合粉碎的目的是
(3)“水浸”中用
(4)“立窑煅烧”中SrCO3与焦炭反应的化学方程式为
(5)“沉锶”中反应的化学方程式为
(6)计算298K时,反应CaCO3(s)+Sr2+(aq)
 SrCO3(s)+Ca2+(aq)平衡常数的数值是
SrCO3(s)+Ca2+(aq)平衡常数的数值是
您最近一年使用:0次
解题方法
3 . 钨有“烈火金刚”的美称,以其高熔点、高比重、高硬度的特点,广泛应用于机械加工、冶金、采矿行业、电光源、建筑工业、兵器工业、航天航空等领域,是一种重要的战略资源,可以说没有钨就没有发达的现代工业。含钨的矿物有黑钨矿和白钨矿,白钨矿主要含CaWO4、Fe2O3、SiO2等,从白钨矿提取钨的工艺流程如下图所示。
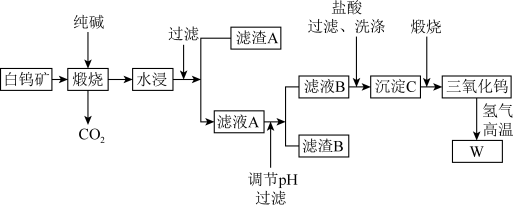
(1)写出CaWO4在煅烧时生成Na2WO4发生反应的化学方程式:_______ 。
(2)在“水浸”时,为加快浸出速率,写出一种可以采取的措施:_______ 。
(3)写出滤渣A的一种用途_______ 。
(4)调节pH的目的:_______ 。
(5)洗涤沉淀C的操作为:_______ 。
(6)为了获取高纯度的金属钨,不宜用碳而必须用氢气做还原剂的原因除了碳和金属钨在高温下会反应生成碳化钨,还存在的原因有_______ (写出一种合理的原因即可)。
(7)钨酸的酸性很弱,难溶于水,写出往滤液B中加入盐酸所发生的反应离子方程式:_______ 。

(1)写出CaWO4在煅烧时生成Na2WO4发生反应的化学方程式:
(2)在“水浸”时,为加快浸出速率,写出一种可以采取的措施:
(3)写出滤渣A的一种用途
(4)调节pH的目的:
(5)洗涤沉淀C的操作为:
(6)为了获取高纯度的金属钨,不宜用碳而必须用氢气做还原剂的原因除了碳和金属钨在高温下会反应生成碳化钨,还存在的原因有
(7)钨酸的酸性很弱,难溶于水,写出往滤液B中加入盐酸所发生的反应离子方程式:
您最近一年使用:0次
4 . 含锌催化剂(主要为ZnO、同时含有少量Fe、Cu、Pb等氧化物)用于合成氨工业和有机合成工业。为充分利用资源,通过如下工艺流程回收锌并制备纳米氧化锌。
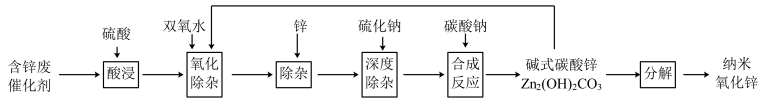
(1)90℃酸浸中,硫酸质量分数控制在30%左右,原因是___________ 。
(2)氧化除杂阶段主要是除去铁,氧化时发生的离子方程式是_______ 。调节pH发生的离子方程式为________ 。
(3)加入锌除去的杂质离子是________ ,深度除杂的目的是__________ 。
(4)由碱式碳酸锌分解得到纳米氧化锌的方法是__________ 。
(5)酸浸中,硫酸的量是理论用量的90%,硫酸不能过量的主要原因是___________ 。

(1)90℃酸浸中,硫酸质量分数控制在30%左右,原因是
(2)氧化除杂阶段主要是除去铁,氧化时发生的离子方程式是
(3)加入锌除去的杂质离子是
(4)由碱式碳酸锌分解得到纳米氧化锌的方法是
(5)酸浸中,硫酸的量是理论用量的90%,硫酸不能过量的主要原因是
您最近一年使用:0次
名校
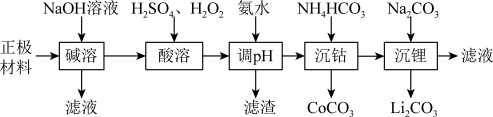
5 . 锂被誉为“高能金属”,废旧锂离子电池的正极材料主要含有LiCoO2及少量Al、Fe等,处理该废料的一种工艺流程如图所示:
已知:①LiCoO2难溶于水:
②相关金属离子形成氢氧化物沉淀的pH值如下表所示:
③碳酸锂的溶解度(S)如下表所示:
回答下列问题:
(1)写出“碱溶”时发生主要反应的离子方程式:_______ 。
(2)为提高“酸溶”的浸出速率,可采取的措施有_______ (任写一种)。
(3)“酸溶”时,LiCoO2发生的主要反应的离子方程式为_______ ;若用浓盐酸代替H2SO4和H2O2的混合液,缺点是_______ 。
(4)用氨水调节pH的范围为_______ 。
(5)沉锂过程的操作方法:加入略过量的碳酸钠后,搅拌、_______ 、_______ 、洗涤、干燥。

已知:①LiCoO2难溶于水:
②相关金属离子形成氢氧化物沉淀的pH值如下表所示:
| Al3+ | Fe3+ | Fe2+ | Co2+ | |
| 开始沉淀的pH | 4.0 | 2.7 | 7.6 | 7.0 |
| 沉淀完全的pH | 5.2 | 3.7 | 9.6 | 9.0 |
③碳酸锂的溶解度(S)如下表所示:
| T℃ | 20 | 80 | 100 |
| S(Li2CO3)/g | 1.33 | 0.85 | 0.72 |
回答下列问题:
(1)写出“碱溶”时发生主要反应的离子方程式:
(2)为提高“酸溶”的浸出速率,可采取的措施有
(3)“酸溶”时,LiCoO2发生的主要反应的离子方程式为
(4)用氨水调节pH的范围为
(5)沉锂过程的操作方法:加入略过量的碳酸钠后,搅拌、
您最近一年使用:0次
2022-02-16更新
|
123次组卷
|
2卷引用:江西省赣州市赣县第三中学2021-2022学年高二下学期3月月考化学试题
解题方法
6 . 实验室用绿矾(FeSO4·7H2O,M=278g/mol)制备补血剂甘氨酸亚铁[(NH2CH2COO)2Fe,M=204g/mol]。
①甘氨酸易溶于水,微溶于乙醇;甘氨酸亚铁易溶于水,难溶于乙醇。
②柠檬酸易溶于水和乙醇,具有较强的还原性和酸性。
实验步骤:
1.配制220mL0.800mol·L-1FeSO4溶液,取200mL于烧杯中,并向其中缓慢加入200mL2.000mol·L-1NH4HCO3溶液,边加边搅拌,反应结束后过滤并洗涤沉淀FeCO3。
ii.实验装置如图所示(夹持和加热仪器略去),将i得到的沉淀和甘氨酸的水溶液混合后加入C中,然后利用A中的反应将C中空气排净,接着滴入柠檬酸溶液并加热。

iii.反应结束后过滤,将滤液进行蒸发浓缩,加入无水乙醇,过滤、洗涤并干燥,得到产品24.480g。
回答下列问题:
(1)配制FeSO4溶液,用到的玻璃仪器除量筒、烧杯、胶头滴管之外,还必须使用的仪器有________ 。需要用电子天平(精确到0.001g)称量绿矾________ g。
(2)实验i中生成沉淀的化学方程式为________ ,洗涤沉淀的操作是________ 。
(3)A中反应的离子方程式为________ ,表明C中空气被排尽的实验现象是________ 。
(4)C装置中加入柠檬酸溶液的作用是防止Fe2+被氧化和________ 。
(5)步骤ⅲ中加入无水乙醇的作用是________ 。
(6)该实验产率为________ 。
①甘氨酸易溶于水,微溶于乙醇;甘氨酸亚铁易溶于水,难溶于乙醇。
②柠檬酸易溶于水和乙醇,具有较强的还原性和酸性。
实验步骤:
1.配制220mL0.800mol·L-1FeSO4溶液,取200mL于烧杯中,并向其中缓慢加入200mL2.000mol·L-1NH4HCO3溶液,边加边搅拌,反应结束后过滤并洗涤沉淀FeCO3。
ii.实验装置如图所示(夹持和加热仪器略去),将i得到的沉淀和甘氨酸的水溶液混合后加入C中,然后利用A中的反应将C中空气排净,接着滴入柠檬酸溶液并加热。

iii.反应结束后过滤,将滤液进行蒸发浓缩,加入无水乙醇,过滤、洗涤并干燥,得到产品24.480g。
回答下列问题:
(1)配制FeSO4溶液,用到的玻璃仪器除量筒、烧杯、胶头滴管之外,还必须使用的仪器有
(2)实验i中生成沉淀的化学方程式为
(3)A中反应的离子方程式为
(4)C装置中加入柠檬酸溶液的作用是防止Fe2+被氧化和
(5)步骤ⅲ中加入无水乙醇的作用是
(6)该实验产率为
您最近一年使用:0次
解题方法
7 . 新一代脱硝催化剂(SCR)(主要含TiO2、V2O5,及SiO2、Al2O3等)。该SCR的使用寿命为3年左右,废弃SCR回收再利用至关重要。湿法回收SCR的工艺流程如下:
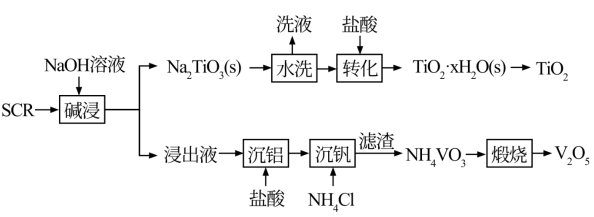
已知:V2O5是两性氧化物,在弱碱性条件下即可生成VO3,VO3易水解。Na₂TiO3难溶于水。回答下列问题:
(1)“碱浸”时,提高浸出率的措施有___________ (写出一种措施即可)。
(2)“沉铝”过程中得到的沉淀主要成分是___________ (填化学式)
(3)“转化”时的离子方程式为___________ 。
(4)“沉钒”中析出NH4VO3晶体时,需要加入过量的NH4C1,其原因是___________ 。
(5)已知NH4VO3难溶于水,Ksp=3.0×10-8,向10mL0.1mol·L-1NaVO3的滤液中加入等体积的NH4Cl溶液(忽略混合过程中的体积变化),欲使VO 沉淀完全,则NH4Cl溶液的最小浓度为
沉淀完全,则NH4Cl溶液的最小浓度为___________ (溶液中某离子浓度≤1×10-5mol·L-1时,认为该离子沉淀完全)。
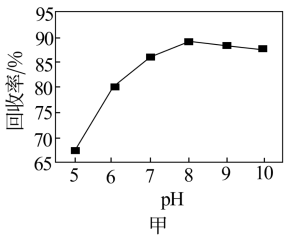
(6)钒回收率随溶液pH的变化如图甲所示,试分析pH在8左右时钒回收率最高的原因:___________ 。
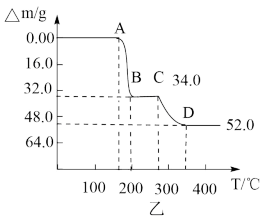
(7)为研究“煅烧”过程中发生的化学变化,某研究小组取234gNH4VO3进行探究,煅烧过程中减少的质量(Δm)随温度变化的曲线如图乙所示,则D点所得物质的化学式为___________

已知:V2O5是两性氧化物,在弱碱性条件下即可生成VO3,VO3易水解。Na₂TiO3难溶于水。回答下列问题:
(1)“碱浸”时,提高浸出率的措施有
(2)“沉铝”过程中得到的沉淀主要成分是
(3)“转化”时的离子方程式为
(4)“沉钒”中析出NH4VO3晶体时,需要加入过量的NH4C1,其原因是
(5)已知NH4VO3难溶于水,Ksp=3.0×10-8,向10mL0.1mol·L-1NaVO3的滤液中加入等体积的NH4Cl溶液(忽略混合过程中的体积变化),欲使VO
 沉淀完全,则NH4Cl溶液的最小浓度为
沉淀完全,则NH4Cl溶液的最小浓度为(6)钒回收率随溶液pH的变化如图甲所示,试分析pH在8左右时钒回收率最高的原因:

(7)为研究“煅烧”过程中发生的化学变化,某研究小组取234gNH4VO3进行探究,煅烧过程中减少的质量(Δm)随温度变化的曲线如图乙所示,则D点所得物质的化学式为

您最近一年使用:0次
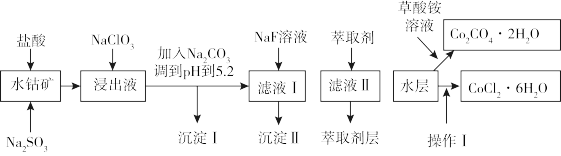
8 . 利用水钴矿(主要成分为 ,含少量
,含少量 、
、 、MnO、MgO、CaO、
、MnO、MgO、CaO、 等)可以制取多种化工试剂,以下为草酸钴晶体和氯化钴晶体的制备工艺流程。
等)可以制取多种化工试剂,以下为草酸钴晶体和氯化钴晶体的制备工艺流程。
该工艺条件下,溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
回答下列问题:
(1)“浸出”过程中 发生反应的离子方程式为
发生反应的离子方程式为_______ 。
(2) 在浸出液中发生反应的离子方程式为
在浸出液中发生反应的离子方程式为_______ 。
(3)加入 调pH至5.2,目的是
调pH至5.2,目的是_______ ;加萃取剂的目的是除去锰元素,则沉淀Ⅱ的主要成分为_______ (填化学式)。
(4)“操作Ⅰ”包括:将水层加入浓盐酸调整pH为2〜3,_______ 、_______ 、过滤、洗涤、减压烘干等过程。
(5)将5.49g草酸钴晶体( )置于空气中加热,受热过程中不同温度范围内分别得到一种固体物质,其质量如表。
)置于空气中加热,受热过程中不同温度范围内分别得到一种固体物质,其质量如表。
经测定,整个受热过程,只产生水蒸气和 气体,则在290〜320℃温度范围,剩余固体物质的化学式为
气体,则在290〜320℃温度范围,剩余固体物质的化学式为_______ 。(已知: 的摩尔质量为
的摩尔质量为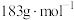 )
)
 ,含少量
,含少量 、
、 、MnO、MgO、CaO、
、MnO、MgO、CaO、 等)可以制取多种化工试剂,以下为草酸钴晶体和氯化钴晶体的制备工艺流程。
等)可以制取多种化工试剂,以下为草酸钴晶体和氯化钴晶体的制备工艺流程。
该工艺条件下,溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
| 金属离子 |  |  |  |  |  |
| 开始沉淀pH | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀pH | 3.7 | 9. 6 | 9.2 | 5.2 | 9.8 |
(1)“浸出”过程中
 发生反应的离子方程式为
发生反应的离子方程式为(2)
 在浸出液中发生反应的离子方程式为
在浸出液中发生反应的离子方程式为(3)加入
 调pH至5.2,目的是
调pH至5.2,目的是(4)“操作Ⅰ”包括:将水层加入浓盐酸调整pH为2〜3,
(5)将5.49g草酸钴晶体(
 )置于空气中加热,受热过程中不同温度范围内分别得到一种固体物质,其质量如表。
)置于空气中加热,受热过程中不同温度范围内分别得到一种固体物质,其质量如表。| 温度范围/℃ | 固体质量/g |
| 150〜210 | 4.41 |
| 290〜320 | 2.41 |
 气体,则在290〜320℃温度范围,剩余固体物质的化学式为
气体,则在290〜320℃温度范围,剩余固体物质的化学式为 的摩尔质量为
的摩尔质量为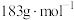 )
)
您最近一年使用:0次
名校
解题方法
9 . 锌灰是热镀锌厂和电解锌厂在生产过程中产生的一种副产品,主要成分是氧化锌和金属锌,杂质为PbO、FeO、Fe3O4、Cu等。利用锌灰生产皓矾(ZnSO4·7H2O)和ZnO等化工产品的工艺流程之一如下:
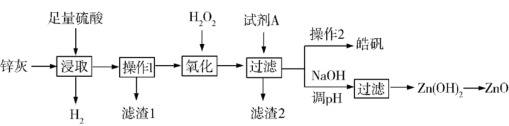
已知pH>11.5时,Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-。下表列出了几种离子生成氢氧化物沉淀的pH:
请回答下列问题:
(1)“滤渣1”的主要成分是___________ 。
(2)加入过量H2O2的目的是___________ (结合离子方程式回答),除去剩余H2O2的简便方法是___________ 。
(3)“试剂A”最好是下列物质中的___________。
(4)“操作2”包括蒸发浓缩、___________ 、过滤洗涤。
(5)加NaOH调pH时,应该控制的pH范围是___________ 。

已知pH>11.5时,Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-。下表列出了几种离子生成氢氧化物沉淀的pH:
| 开始沉淀的pH | 完全沉淀的pH | |
| Fe3+ | 1.5 | 3.2 |
| Fe2+ | 6.5 | 9.0 |
| Zn2+ | 5.6 | 8.1 |
| Pb2+ | 6.6 | 9.1 |
请回答下列问题:
(1)“滤渣1”的主要成分是
(2)加入过量H2O2的目的是
(3)“试剂A”最好是下列物质中的___________。
| A.NH3·H2O | B.Zn | C.NaOH | D.ZnCO3 |
(5)加NaOH调pH时,应该控制的pH范围是
您最近一年使用:0次
2021-12-31更新
|
194次组卷
|
2卷引用:江西省赣州市教育发展联盟2021-2022学年高二上学期第7次联考化学试题
名校
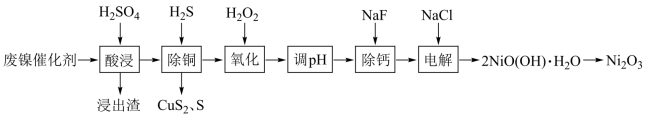
10 . 某科研人员以废镍催化剂(主要成分为 ,另含
,另含 、
、 、
、 、
、 )为原料回收镍,工艺流程如图:
)为原料回收镍,工艺流程如图:
已知:常温下,有关氢氧化物开始沉淀和沉淀完全的 如表:
如表:
回答下列问题:
(1)浸出渣主要成分为___________ 、___________ (填化学式)。
(2)“除铜”时, 与
与 反应的离子方程式为
反应的离子方程式为___________ 。
(3)“氧化”的目的是将溶液中的 氧化为
氧化为 ,温度需控制在
,温度需控制在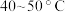 之间,该步骤温度不能太高的原因是
之间,该步骤温度不能太高的原因是___________ 。
(4)“调 ”时,
”时, 的控制范围为
的控制范围为___________ 。
(5)“除钙”后,若溶液中 浓度为
浓度为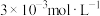 ,则
,则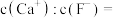
___________ 。[已知常温下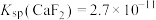 ]
]
 ,另含
,另含 、
、 、
、 、
、 )为原料回收镍,工艺流程如图:
)为原料回收镍,工艺流程如图:
已知:常温下,有关氢氧化物开始沉淀和沉淀完全的
 如表:
如表: |  |  |
| 1.5 | 6.5 | 7.7 |
| 3.7 | 9.7 | 9.2 |
回答下列问题:
(1)浸出渣主要成分为
(2)“除铜”时,
 与
与 反应的离子方程式为
反应的离子方程式为(3)“氧化”的目的是将溶液中的
 氧化为
氧化为 ,温度需控制在
,温度需控制在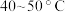 之间,该步骤温度不能太高的原因是
之间,该步骤温度不能太高的原因是(4)“调
 ”时,
”时, 的控制范围为
的控制范围为(5)“除钙”后,若溶液中
 浓度为
浓度为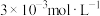 ,则
,则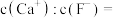
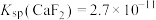 ]
]
您最近一年使用:0次
2021-12-09更新
|
982次组卷
|
4卷引用:江西省六校2021-2022学年高二上学期期末联考化学试题



