名校
解题方法
1 . 从废旧磷酸铁锂电池的正极材料(含LiFePO4、石墨粉和铝箔等)中综合回收锂、铁和磷等的工艺流程如图所示:
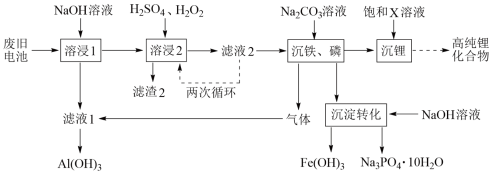
回答下列问题:
(1)“溶浸1”中铝溶解的化学方程式为___________________________ 。
(2)完成“溶浸2”反应的离子方程式___________________________ :
 LiFePO4+
LiFePO4+ H2O2+
H2O2+ =
= Li++
Li++ +
+ H2PO4-+
H2PO4-+ H2O
H2O
(3)“滤渣2”的主要成分是_______________ 。
(4)“滤液2”循环两次的目的是___________________________ 。
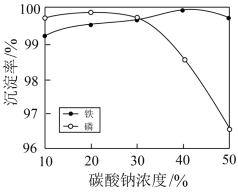
(5)“沉铁、磷”时,析出FePO4沉淀,反应的离子方程式为_______________________ 。实验中,铁、磷的沉淀率结果如图所示。碳酸钠浓度大于30%后,铁沉淀率仍然升高,磷沉淀率明显降低,其可能原因是___________________________ 。
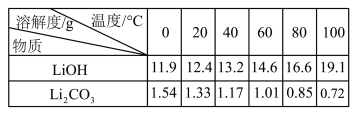
(6)为了充分沉淀,“沉锂”时所用的X和适宜温度是___ (填标号)。
A.NaOH20-40℃B.NaOH80-100℃
C.Na2CO320-40℃D.Na2CO360-80℃


回答下列问题:
(1)“溶浸1”中铝溶解的化学方程式为
(2)完成“溶浸2”反应的离子方程式
 LiFePO4+
LiFePO4+ H2O2+
H2O2+ =
= Li++
Li++ +
+ H2PO4-+
H2PO4-+ H2O
H2O(3)“滤渣2”的主要成分是
(4)“滤液2”循环两次的目的是
(5)“沉铁、磷”时,析出FePO4沉淀,反应的离子方程式为

(6)为了充分沉淀,“沉锂”时所用的X和适宜温度是
A.NaOH20-40℃B.NaOH80-100℃
C.Na2CO320-40℃D.Na2CO360-80℃
您最近一年使用:0次
名校
2 . 亚硝酰氯(ClNO)是有机物合成中的重要试剂,红褐色液体或黄色气体,具有刺鼻恶臭味,遇水反应生成一种氢化物和两种氧化物。某学习小组在实验室用Cl2和NO制备ClNO并测定其纯度:
(1)实验室可用下图装置制备亚硝酰氯(ClNO);
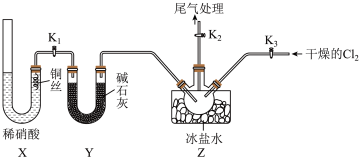
①X装置的优点为_________________________ 。
②检验装置气密性并装入药品,打开k2,然后再打开________ (填“k1”“k2”或“k3”),
通入一段时间气体,(其目的为________________________________________ ),然后进行其它操作,当Z有一定量液体生成时,停止实验。
③若无装置Y,则Z中ClNO可能发生反应的化学方程式为__________________ 。
(2)亚硝酰氯(ClNO)的纯度测定:取Z中所得液体m g溶于水,配制成250mL溶液,取出25.00mL,以K2CrO4溶液为指示剂,用c mol·L-1AgNO3标准溶液滴定至终点,消耗标准溶液的体积为22.50mL。(已知:Ag2CrO4为砖红色固体;Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=1×10-12),则亚硝酰氯(ClNO)的质量分数为_________ (用代数式表示)。
(1)实验室可用下图装置制备亚硝酰氯(ClNO);

①X装置的优点为
②检验装置气密性并装入药品,打开k2,然后再打开
通入一段时间气体,(其目的为
③若无装置Y,则Z中ClNO可能发生反应的化学方程式为
(2)亚硝酰氯(ClNO)的纯度测定:取Z中所得液体m g溶于水,配制成250mL溶液,取出25.00mL,以K2CrO4溶液为指示剂,用c mol·L-1AgNO3标准溶液滴定至终点,消耗标准溶液的体积为22.50mL。(已知:Ag2CrO4为砖红色固体;Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=1×10-12),则亚硝酰氯(ClNO)的质量分数为
您最近一年使用:0次
2020-10-10更新
|
221次组卷
|
3卷引用:江西省南昌市第二中学2021届高三上学期第三次考试化学试题
名校
解题方法
3 . V2O5是硫酸生产中的催化剂,某种含钒工业下脚料主要成分是V2O3,其中含铝、硅、铜、锰等氧化物及油脂等杂质,一种以该下脚料为原料提取V2O5的工艺流程如下:
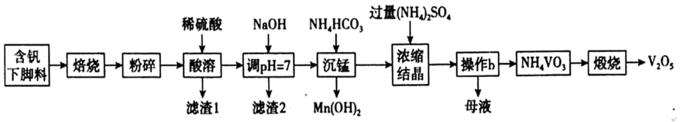
已知:i.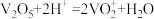 ;
;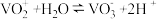 。
。
ii.常温时,有关氢氧化物的溶度积常数如下表:

回答下列问题:
(1)“焙烧”可以除去油脂,还有一个作用是_______________________________________ 。
(2)将焙烧冷却后的固体残留物进行“粉碎”,其目的是______________________________ 。
(3)“滤渣1”的主要成分是____________ (写化学式),“调pH=7”,析出沉淀后,滤液中c(Cu2+):c(Al3+)=____________ 。
(4)“沉锰”操作需微热,微热的目的是______________________________ ,该反应的离子方程式是________________________________________ 。
(5)“浓缩结晶”时,需要加入过量(NH4)2SO4,其原因是_______________ 。
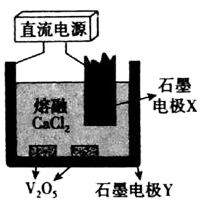
(6)利用制得的V2O5可通过电解的方法制备金属钒,电解装置如图:石墨电极Y接直流电池___________ (填“正极”或“负极”),阴极反应式是_________________________ 。

已知:i.
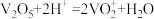 ;
;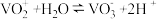 。
。ii.常温时,有关氢氧化物的溶度积常数如下表:

回答下列问题:
(1)“焙烧”可以除去油脂,还有一个作用是
(2)将焙烧冷却后的固体残留物进行“粉碎”,其目的是
(3)“滤渣1”的主要成分是
(4)“沉锰”操作需微热,微热的目的是
(5)“浓缩结晶”时,需要加入过量(NH4)2SO4,其原因是
(6)利用制得的V2O5可通过电解的方法制备金属钒,电解装置如图:石墨电极Y接直流电池

您最近一年使用:0次
2020-10-10更新
|
364次组卷
|
4卷引用:江西省南昌市第二中学2021届高三上学期第三次考试化学试题
江西省南昌市第二中学2021届高三上学期第三次考试化学试题(已下线)【南昌新东方】2. 南昌二中 左佳鑫江西省靖安中学2021届高三上学期第四次月考化学试题百校联盟2021届高三高考9月份联考化学试题
名校
4 . 已知草酸镍晶体(NiC2O4·2H2O)难溶于水,工业上从废镍催化剂(主要成分为Ni,含有一定量的Al2O3、FeO、SiO2、CaO等)制备草酸镍晶体的流程如图所示:
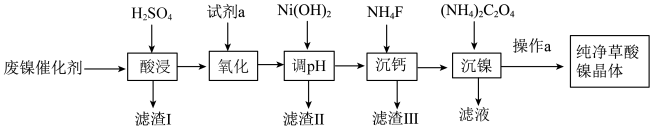
已知:①相关金属离子生成氢氧化物沉淀的pH见表中数据:
②Ksp(CaF2)=1.46×10-10;
③当某物质浓度小于1.0×10-5 mol·L-1时,视为完全沉淀。
请回答下列问题:
(1)请写出一种能提高“酸浸”速率的措施:______________ 。
(2)试剂a是一种绿色氧化剂,写出“氧化”时反应的离子方程式:_____________ 。
(3)“调pH”时pH的调控范围为__________________ 。
(4)写出“沉镍”时发生反应的离子方程式:__________ ,当Ca2+沉淀完全时,溶液中 c(F-)>________ mol·L-1(写出计算式即可)。
(5)操作a的内容是____________________ 。

已知:①相关金属离子生成氢氧化物沉淀的pH见表中数据:
| 金属离子 | Fe3+ | Fe2+ | Al3+ | Ni2+ |
| 开始沉淀的pH | 1.1 | 5.8 | 3.0 | 6.8 |
| 完全沉淀的pH | 3.2 | 8.8 | 5.0 | 9.5 |
③当某物质浓度小于1.0×10-5 mol·L-1时,视为完全沉淀。
请回答下列问题:
(1)请写出一种能提高“酸浸”速率的措施:
(2)试剂a是一种绿色氧化剂,写出“氧化”时反应的离子方程式:
(3)“调pH”时pH的调控范围为
(4)写出“沉镍”时发生反应的离子方程式:
(5)操作a的内容是
您最近一年使用:0次
名校
解题方法
5 . 以下是25℃时几种难溶电解质的溶解度:
在无机化合物的提纯中,常利用难溶电解质的溶解平衡原理除去某些离子.如:
①为了除去氯化铵中的杂质Fe3+,先将混合物溶于水,再加入一定量的试剂反应,过滤结晶即可;
②为了除去氯化镁晶体中的杂质Fe3+,先将混合物溶于水,加入足量的氢氧化镁,充分反应,过滤结晶即可;
③为了除去硫酸铜晶体中的杂质Fe2+,先将混合物溶于水,加入一定量的H2O2,将Fe2+氧化成Fe3+,调节溶液的pH=4,过滤结晶即可.
请回答下列问题:
(1)上述三个除杂方案都能够达到很好的效果,Fe2+、Fe3+都被转化为____________ (填化学式)而除去.
(2)①中加入的试剂应该选择________ 为宜,其原因是__________ .
(3)②中除去Fe3+所发生的总反应的离子方程式为______________________________ .
(4)下列与方案③相关的叙述中,正确的是______ (填字母).
A.H2O2是绿色氧化剂,在氧化过程中不引进杂质,不产生污染
B.将Fe2+氧化为Fe3+的主要原因是Fe(OH)2沉淀比Fe(OH)3沉淀较难过滤
C.调节溶液pH=4可选择的试剂是氢氧化铜或碱式碳酸铜或氧化铜
D.Cu2+可以大量存在于pH=4的溶液中
E.在pH>4的溶液中Fe3+一定不能大量存在
| 难溶电解质 | Mg(OH)2 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 溶解度/g | 9×10-4 | 1.7×10-6 | 1.5×10-4 | 3.0×10-9 |
①为了除去氯化铵中的杂质Fe3+,先将混合物溶于水,再加入一定量的试剂反应,过滤结晶即可;
②为了除去氯化镁晶体中的杂质Fe3+,先将混合物溶于水,加入足量的氢氧化镁,充分反应,过滤结晶即可;
③为了除去硫酸铜晶体中的杂质Fe2+,先将混合物溶于水,加入一定量的H2O2,将Fe2+氧化成Fe3+,调节溶液的pH=4,过滤结晶即可.
请回答下列问题:
(1)上述三个除杂方案都能够达到很好的效果,Fe2+、Fe3+都被转化为
(2)①中加入的试剂应该选择
(3)②中除去Fe3+所发生的总反应的离子方程式为
(4)下列与方案③相关的叙述中,正确的是
A.H2O2是绿色氧化剂,在氧化过程中不引进杂质,不产生污染
B.将Fe2+氧化为Fe3+的主要原因是Fe(OH)2沉淀比Fe(OH)3沉淀较难过滤
C.调节溶液pH=4可选择的试剂是氢氧化铜或碱式碳酸铜或氧化铜
D.Cu2+可以大量存在于pH=4的溶液中
E.在pH>4的溶液中Fe3+一定不能大量存在
您最近一年使用:0次
6 . 磁性材料产业是21世纪各国竞相发展的高科技支柱产业之一,磁性材料广泛用于电子信息、军事技术等领域。碳酸锰主要用于制备软磁铁氧体,工业上用氯化铵焙烧菱锰矿粉制备高纯度碳酸锰的工艺流程如下:
已知:①菱锰矿粉的主要成分是MnCO3,还含少量Fe、Al、Ca、Mg等元素。
②相关金属Mn+离子c(Mn+) ═ 0.1 mol• L -1形成M(OH) n沉淀的pH范围如下:

回答下列问题:
(1)“焙烧”时发生的主要反应的化学方程式为_____________________________ 。
(2)浸出液“净化除杂”过程如下:①加入MnO2将Fe2+氧化为Fe3+;②调节溶液pH,将Al3+、Fe3+变为沉淀除去,调节pH范围为__________ ③加入NH4F将___________ 离子(填离子符号)沉淀除去。
(3)碳化结晶时,反应的离子方程式为_____________________________________ 。
(4)碳化结晶过程中不能用碳酸铵溶液代替碳酸氢铵溶液可能的原因是________________ 。流程中能循环利用的物质除了氯化铵之外还有____________ 。
(5)测定碳酸锰产品的纯度。
称取0.5000 g碳酸锰产品于锥形瓶中,加25.00 mL磷酸,加热,碳酸锰全部转化为[Mn(PO4)2]3-,冷却至室温。加水稀释至100 mL,滴加2~3滴指示剂,然后用浓度为0.2000 mol·L-1的硫酸亚铁铵[(NH4)2Fe(SO4)2]标准溶液滴定(反应为:[Mn(PO4)2]3- +Fe2+ ═Mn2+ +Fe3++2PO43-)。重复操作3次,记录数据如下表:
则产品的纯度=__________ ,若滴定终点时发现滴定管尖嘴处产生了气泡,则测得的碳酸锰粗产品的纯度_______ (填“偏高”“ 偏低”或“无影响”)。
已知:①菱锰矿粉的主要成分是MnCO3,还含少量Fe、Al、Ca、Mg等元素。
②相关金属Mn+离子c(Mn+) ═ 0.1 mol• L -1形成M(OH) n沉淀的pH范围如下:
| 金属离子 | Fe3+ | Al3+ | Fe2+ | Mg2+ | Ca2+ | Mn2+ |
| 开始沉淀的pH | 1.5 | 3.8 | 6.3 | 9.6 | 10.6 | 8.8 |
| 沉淀完全的pH | 2.8 | 5.2 | 8.3 | 11.6 | 12.6 | 10.8 |

回答下列问题:
(1)“焙烧”时发生的主要反应的化学方程式为
(2)浸出液“净化除杂”过程如下:①加入MnO2将Fe2+氧化为Fe3+;②调节溶液pH,将Al3+、Fe3+变为沉淀除去,调节pH范围为
(3)碳化结晶时,反应的离子方程式为
(4)碳化结晶过程中不能用碳酸铵溶液代替碳酸氢铵溶液可能的原因是
(5)测定碳酸锰产品的纯度。
称取0.5000 g碳酸锰产品于锥形瓶中,加25.00 mL磷酸,加热,碳酸锰全部转化为[Mn(PO4)2]3-,冷却至室温。加水稀释至100 mL,滴加2~3滴指示剂,然后用浓度为0.2000 mol·L-1的硫酸亚铁铵[(NH4)2Fe(SO4)2]标准溶液滴定(反应为:[Mn(PO4)2]3- +Fe2+ ═Mn2+ +Fe3++2PO43-)。重复操作3次,记录数据如下表:
| 滴定次数 | 0.2000 mol·L-1的硫酸亚铁铵标准溶液读数(mL) | |
| 滴定前 | 滴定后 | |
| 1 | 0.10 | 20.20 |
| 2 | 1.32 | 21.32 |
| 3 | 1.05 | 20.95 |
则产品的纯度=
您最近一年使用:0次
7 . 已知草酸镍晶体(NiC2O4·2H2O)难溶于水,工业上从废镍催化剂(主要成分为Ni,含有一定量的Al2O3、FeO、SiO2、CaO等)制备草酸镍晶体的流程如图所示:
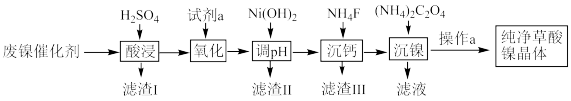
已知:①相关金属离子生成氢氧化物沉淀的pH见表中数据:
②Ksp(CaF2)=1.46×10-10;
③当某物质浓度小于1.0×10-5 mol·L-1时,视为完全沉淀。
请回答下列问题:
(1)请写出一种能提高“酸浸”速率的措施:_______________________________ 。
(2)试剂a是一种绿色氧化剂,写出“氧化”时反应的离子方程式:_____________ 。
(3)“调pH”时pH的调控范围为__________________ 。
(4)写出“沉镍”时发生反应的离子方程式:________________________________ ,证明Ni2+已经沉淀完全的实验步骤及现象是______________________________ ,当Ca2+沉淀完全时,溶液中c(F-)>____________ mol·L-1(写出计算式即可)。

已知:①相关金属离子生成氢氧化物沉淀的pH见表中数据:
| 金属离子 | Fe3+ | Fe2+ | Al3+ | Ni2+ |
| 开始沉淀的pH | 1.1 | 5.8 | 3.0 | 6.8 |
| 完全沉淀的pH | 3.2 | 8.8 | 5.0 | 9.5 |
③当某物质浓度小于1.0×10-5 mol·L-1时,视为完全沉淀。
请回答下列问题:
(1)请写出一种能提高“酸浸”速率的措施:
(2)试剂a是一种绿色氧化剂,写出“氧化”时反应的离子方程式:
(3)“调pH”时pH的调控范围为
(4)写出“沉镍”时发生反应的离子方程式:
您最近一年使用:0次
2019-12-24更新
|
148次组卷
|
2卷引用:江西省赣州市会昌中学2019-2020学年高二上学期第二次月考化学试题
名校
解题方法
8 . 一种以辉铜矿(主要成分为Cu2S,含少量SiO2)为原料制备硝酸铜的工艺流程如图所示:
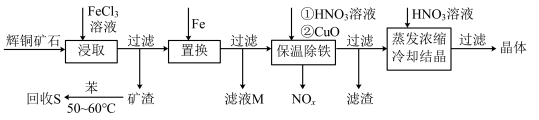
(1)写出“浸取”过程中Cu2S溶解时发生反应的离子方程式:___ 。
(2)恒温“浸取”的过程中发现铜元素的浸取速率先增大后减少,有研究指出CuCl2是该反应的催化剂,该过程的反应原理可用化学方程式表示为:①Cu2S +2CuCl2=4CuCl+S;②___ 。
(3)“回收S”过程中温度控制在50~60℃之间,不宜过高的原因是___ 。
(4)向滤液M中加入(或通入)___ (填字母),可得到一种可循环利用的物质。
a.铁 b.氯气 c.高锰酸钾 d.氯化氢
(5)“保温除铁”过程中,加入CuO的目的是__ ;“蒸发浓缩、冷却结晶”过程中,要用HNO3溶液调节溶液的pH,其理由_ 。
(6)辉铜矿可由黄铜矿(主要成分为CuFeS2)通过电化学反应转变而成,有关转化见图,转化时转移0.2mol电子,生成Cu2S___ mol。


(1)写出“浸取”过程中Cu2S溶解时发生反应的离子方程式:
(2)恒温“浸取”的过程中发现铜元素的浸取速率先增大后减少,有研究指出CuCl2是该反应的催化剂,该过程的反应原理可用化学方程式表示为:①Cu2S +2CuCl2=4CuCl+S;②
(3)“回收S”过程中温度控制在50~60℃之间,不宜过高的原因是
(4)向滤液M中加入(或通入)
a.铁 b.氯气 c.高锰酸钾 d.氯化氢
(5)“保温除铁”过程中,加入CuO的目的是
(6)辉铜矿可由黄铜矿(主要成分为CuFeS2)通过电化学反应转变而成,有关转化见图,转化时转移0.2mol电子,生成Cu2S

您最近一年使用:0次
2019-12-19更新
|
1285次组卷
|
10卷引用:江西省南昌市第二中学2020届高三5月模拟理综化学试题
江西省南昌市第二中学2020届高三5月模拟理综化学试题江西省南昌市第二中学2021届高三上学期第四次考试理综化学试题江西省新余市第四中学2021届高三化学上学期第四次考试试题广东省六校联盟(深圳实验,广州二中,珠海一中,惠州一中,东莞中学,中山纪中)2020届高三第二次联考理综化学试题2020届高三《新题速递·化学》1月第01期(考点11-13)宁夏六盘山高级中学2020届高三下学期第二次模拟考试理综化学试题宁夏石嘴山市第三中学2020届高三第五次模拟考试理综化学试题2022届陕西省宝鸡市陈仓区高考模拟检测(二)理综化学试题天津市河东区2022-2023学年高三上学期期中检测化学试题(已下线)第三章 金属及其化合物 第15练 金属材料 金属冶炼
名校
9 . 工业锅炉内壁的水垢,不仅浪费燃料,而且容易引发安全隐患。某碳素钢锅炉水垢(主要成分有CaCO3、CaSO4、Mg(OH)2、Fe2O3、SiO2等)碱煮法清除的流程如下:
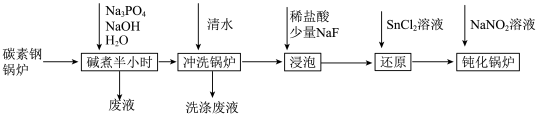
已知:20℃时几种难溶物的溶度积常数如下表(单位省略):
回答下列问题:
(1)“碱煮”环节,加入Na3PO4的主要目的是将CaSO4转化为Ca3(PO4)2,请写出该离子方程式______________________ 。
(2)“浸泡过程中,稀盐酸会溶解Fe2O3。溶解后的Fe2O3会加速锅炉腐蚀,故需“还原”处理。
①锅炉被加速腐蚀的原因是______________________ ;
②浸泡液还原”处理时,Sn2+转化为Sn4+,则反应中氧化剂与还原剂的物质的量之比为______________________ 。
(3)“钝化”处理的目的是在锅炉表面形成Fe3O4保护膜,同时生成可直接参与大气循环的气体。
①反应的离子方程式为_________________________________ ;
②为检验锅炉“钝化”处理后是否形成致密的保护膜,可往锅炉内壁刷上硫酸铜溶液。若观察到______________________ (填现象),则保护膜致密性欠佳。
(4)柠檬酸(用H3R表示)可用作清除锅炉水垢的酸洗剂,溶液中H3R、H2R-、HR2-、R3-的含量与pH的关系如图所示。由此可推知,0.1 mol ·L-1 Na2HR溶液中各种阴离子浓度由大到小的排列顺序为______________________ 。

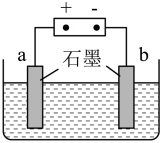
(5)用如图装置对锅炉用水(含Ca2+、Mg2+、HCO3-)进行预处理,可有效防止水垢形成。电解时,Ca2+形成沉淀的电极反应式为______________________ 。

已知:20℃时几种难溶物的溶度积常数如下表(单位省略):
| 难溶物 | CaCO3 | CaSO4 | Mg(OH)2 | MgCO3 | Ca3(PO4)2 |
| Ksp | 2.8×10-9 | 7.1×10-5 | 5.6×10-12 | 6.8×10-6 | 2.1×10-33 |
(1)“碱煮”环节,加入Na3PO4的主要目的是将CaSO4转化为Ca3(PO4)2,请写出该离子方程式
(2)“浸泡过程中,稀盐酸会溶解Fe2O3。溶解后的Fe2O3会加速锅炉腐蚀,故需“还原”处理。
①锅炉被加速腐蚀的原因是
②浸泡液还原”处理时,Sn2+转化为Sn4+,则反应中氧化剂与还原剂的物质的量之比为
(3)“钝化”处理的目的是在锅炉表面形成Fe3O4保护膜,同时生成可直接参与大气循环的气体。
①反应的离子方程式为
②为检验锅炉“钝化”处理后是否形成致密的保护膜,可往锅炉内壁刷上硫酸铜溶液。若观察到
(4)柠檬酸(用H3R表示)可用作清除锅炉水垢的酸洗剂,溶液中H3R、H2R-、HR2-、R3-的含量与pH的关系如图所示。由此可推知,0.1 mol ·L-1 Na2HR溶液中各种阴离子浓度由大到小的排列顺序为

(5)用如图装置对锅炉用水(含Ca2+、Mg2+、HCO3-)进行预处理,可有效防止水垢形成。电解时,Ca2+形成沉淀的电极反应式为

您最近一年使用:0次
2019-03-06更新
|
1213次组卷
|
3卷引用:江西省赣州市信丰中学2020-2021学年高三上学期第五次月考化学试题
10 . 以冶炼金属铝的废弃物铝灰为原料制取超细α-氧化铝,既能降低环境污染又可提高铝资源的利用率。已知铝灰的主要成分为A12O3(含少量杂质SiO2、FeO、Fe2O3),其制备流程如下:_____ (填选项编号)。___________________________________ 。
(3)通过调节溶液的pH来“沉铁”,得到Fe(OH)3.已知:
为保证产品的纯度,可以选用下列物质中的_______ 调节溶液pH(填字母),调节pH的范围为______________ 。
a.Al2O3 b.NaOH c.Al(OH)3 d.Na2CO3____________ (填化学式)。
②装有KMnO4溶液洗气瓶的作用是____________________________ 。
③选用一种常用化学试剂和稀硝酸检验硫酸铝铵,该试剂_________ 。写出硫酸铝铵加入足量该试剂的离子方程式__________________________________________________ 。
④20℃时,0.1mol·L-1硫酸铝铵,其溶液pH=3,则溶液中,2c(SO42-)-c(NH4+)-3c(Al3+)=____________ mol·L-1(填具体数字计算式,不必化简)
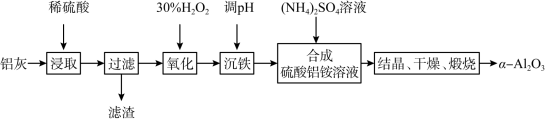

(3)通过调节溶液的pH来“沉铁”,得到Fe(OH)3.已知:
| Fe3+ | Fe2+ | Al3+ | |
| 开始沉淀时的pH | 2.2 | 7.5 | 3.7 |
| 完全沉淀时的pH | 3.2 | 9.0 | 4.7 |
a.Al2O3 b.NaOH c.Al(OH)3 d.Na2CO3
(4)煅烧硫酸铝铵晶体,发生的主要反应为:4[NH4Al(SO4)2•12H2O] 2Al2O3+2NH3↑+N2↑+5SO3↑+3SO2↑+53H2O,将产生的气体通过下图所示的装置:
2Al2O3+2NH3↑+N2↑+5SO3↑+3SO2↑+53H2O,将产生的气体通过下图所示的装置:
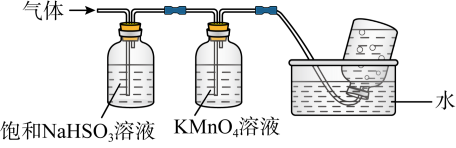
②装有KMnO4溶液洗气瓶的作用是
③选用一种常用化学试剂和稀硝酸检验硫酸铝铵,该试剂
④20℃时,0.1mol·L-1硫酸铝铵,其溶液pH=3,则溶液中,2c(SO42-)-c(NH4+)-3c(Al3+)=
您最近一年使用:0次
2018-12-17更新
|
288次组卷
|
2卷引用:【校级联考】江西省上饶市弋阳县第一中学等六校2018-2019学年高二(课改班)上学期12月联考化学试题



