 是一种绿色易溶于水的晶体,可由电镀废渣(除镍外,还含有铜、锌、铁等元素的化合物杂质)为原料获得。操作步骤如图:
是一种绿色易溶于水的晶体,可由电镀废渣(除镍外,还含有铜、锌、铁等元素的化合物杂质)为原料获得。操作步骤如图: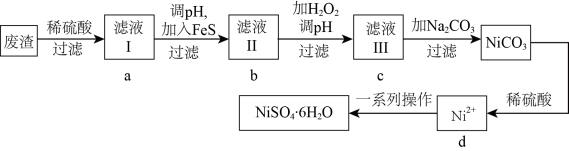
已知:各离子开始沉淀及完全沉淀时的
 如表所示:
如表所示:离子 | 开始沉淀时的 | 完全沉淀时的 |
| 6.3 | 9.7 |
| 2.2 | 3.2 |
| 6.4 | 8.4 |
(1)基态
 原子核外电子的空间运动状态有
原子核外电子的空间运动状态有(2)向滤液Ⅰ中加入
 固体是为了生成更难溶于水的硫化物沉淀而除去
固体是为了生成更难溶于水的硫化物沉淀而除去 、
、 等杂质,则除去
等杂质,则除去 的离子方程式为
的离子方程式为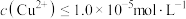 时,可认为
时,可认为 已沉淀完全,此时溶液中
已沉淀完全,此时溶液中 的浓度不小于
的浓度不小于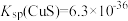 ]
](3)根据对滤液Ⅱ的操作作答:
①向滤液Ⅱ中加
 的目的是将
的目的是将 氧化成
氧化成 ,试从结构的角度解释
,试从结构的角度解释 易被氧化为
易被氧化为 的原因
的原因②调节滤液Ⅱ的
 ,
, 应控制在范围为
应控制在范围为③检验滤液Ⅲ中杂质金属离子是否除尽最合理的试剂是
(4)滤液Ⅲ溶质的主要成分是
 ,加
,加 过滤后得到
过滤后得到 固体,再加适量稀硫酸溶解又生成
固体,再加适量稀硫酸溶解又生成 ,这两步操作的目的是
,这两步操作的目的是
更新时间:2024-02-01 14:58:03
|
相似题推荐
【推荐1】铜镉渣主要含锌、铜、铁、镉(Cd)、钻(Co)等单质。湿法炼锌产生的铜镉渣用于生产金属镉的工艺流程如图:

表中列出了相关金属离子生成氢氧化物沉淀的pH(金属离子的起始浓度为0.1mol·L-1)
(1)酸浸铜镉渣时,加快反应速率的措施有_______ (写一条)。
(2)操作Ⅲ中先加入适量H2O2,发生反应的离子方程式_______ ;再加入ZnO控制反应液的pH,pH范围为_______ ﹔选择_______ (填“铁氰化钾”或“硫氰化钾”)试剂,能证明添加的H2O2已过量。
(3)常用沉淀转化法处理含Cd2+废水,写出碳酸钙处理Cd2+的离子方程式_______ ;若反应达到平衡后溶液中c(Ca2+)=0.1mol·L-1,溶液中c(Cd2+)=_______ mol·L-1。[已知25℃,Ksp(CdCO3)=5.6×10-12,Ksp(CaCO3)=2.8×10-9]
(4)电解后的废液可用于电镀锌,电镀锌时阴极反应式为_______ 。

表中列出了相关金属离子生成氢氧化物沉淀的pH(金属离子的起始浓度为0.1mol·L-1)
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cd(OH)2 | Zn(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 | 7.2 | 8.0 |
| 沉淀完全的pH | 3.3 | 9.9 | 9.5 | 11.1 |
(1)酸浸铜镉渣时,加快反应速率的措施有
(2)操作Ⅲ中先加入适量H2O2,发生反应的离子方程式
(3)常用沉淀转化法处理含Cd2+废水,写出碳酸钙处理Cd2+的离子方程式
(4)电解后的废液可用于电镀锌,电镀锌时阴极反应式为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐2】煤粉灰的主要成分为SiO2、Al2O3、FeO、Fe2O3、MgO、TiO2等。研究小组对其进行综合处理的流程如图:
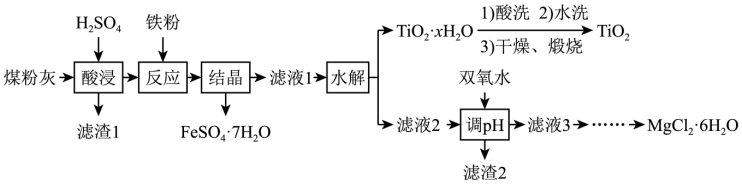
已知:①“酸浸”后钛主要以TiOSO4形式存在,强电解质TiOSO4在溶液中仅能电离出SO 和一种阳离子。
和一种阳离子。
②常温下,Ksp[Al(OH)3]=1.0×10-32,Ksp[Fe(OH)3]=4.0×10-38,Ksp[Mg(OH)2]=1×10-11。
请回答下列问题:
(1)向Mg(OH)2的悬浊液中,加入几滴FeCl3溶液,出现红褐色沉淀,请用离子方程式表示这一过程_____ 。
(2)“酸浸”时TiO2发生反应的离子方程式为____ ;“反应”时加入铁粉的作用是____ 。
(3)“结晶”需控制在70℃左右,温度过高会导致的后果是____ 。
(4)“水解”反应的离子方程式是____ 。所得TiO2·xH2O沉淀进行酸洗的目的为____ 。
(5)为使滤渣2沉淀完全(溶液中离子浓度小于10-5mol·L-1)需“调pH”最小为____ 。
(6)实验室用MgCl2溶液制备MgCl2·6H2O,需进行的操作是____ 、降温结晶、过滤、洗涤、干燥。

已知:①“酸浸”后钛主要以TiOSO4形式存在,强电解质TiOSO4在溶液中仅能电离出SO
 和一种阳离子。
和一种阳离子。②常温下,Ksp[Al(OH)3]=1.0×10-32,Ksp[Fe(OH)3]=4.0×10-38,Ksp[Mg(OH)2]=1×10-11。
请回答下列问题:
(1)向Mg(OH)2的悬浊液中,加入几滴FeCl3溶液,出现红褐色沉淀,请用离子方程式表示这一过程
(2)“酸浸”时TiO2发生反应的离子方程式为
(3)“结晶”需控制在70℃左右,温度过高会导致的后果是
(4)“水解”反应的离子方程式是
(5)为使滤渣2沉淀完全(溶液中离子浓度小于10-5mol·L-1)需“调pH”最小为
(6)实验室用MgCl2溶液制备MgCl2·6H2O,需进行的操作是
您最近一年使用:0次
【推荐3】(1)在粗制MgCl2晶体中常含有杂质Fe2+,在提纯时为了除去Fe2+,常加入合适氧化剂,使Fe2+氧化为Fe3+,下列物质最好采用的是_________ (填下面的选项),加入该氧化剂时,温度不能太高,原因是_________ 。
A.KMnO4 B.H2O2 C.HNO3 D.氯水
然后再加入适当物质调节溶液pH,可以达到除去Fe3+而不损失MgCl2的目的,调节溶液pH可选用下列中的有_________ 。
A.Mg2(OH)2CO3 B.MgO C.NH3·H2O D.Mg(OH)2
某溶液中含Mg2+和Fe3+,c(Mg2+)=0.02mol/L,加入双氧水和磷酸(设溶液体积增加1倍),使Fe3+恰好沉淀完全,即溶液中c(Fe3+)=1.0×10-5mol/L,此时是否有Mg3(PO4)2沉淀生成?_________ (FePO4、Mg3(PO4)2的Ksp分别为1.3×10-22、1.0×10-24)
(2)常温下Ksp[Fe(OH)3]=8.0×10−38,Ksp[Cu(OH)2]=3.0×10−20,通常认为残留在溶液中的离子浓度小于1×10−5mol⋅L−1时就认为沉淀完全,设溶液中CuSO4的浓度为3.0mol⋅L−1,为除去溶液中的Fe3+而不影响Cu2+,溶液的pH的范围为_________ 。(已知lg5=0.7)。
(3)矿物中各种原生铜的硫化物经氧化、淋滤后可变成CuSO4溶液,并向内部渗透,遇到深层的闪锌矿(ZnS)和方铅矿(PbS),可慢慢转化为铜蓝(CuS)。写出硫酸铜与ZnS反应的离子方程式为:_________ 。
A.KMnO4 B.H2O2 C.HNO3 D.氯水
然后再加入适当物质调节溶液pH,可以达到除去Fe3+而不损失MgCl2的目的,调节溶液pH可选用下列中的有
A.Mg2(OH)2CO3 B.MgO C.NH3·H2O D.Mg(OH)2
某溶液中含Mg2+和Fe3+,c(Mg2+)=0.02mol/L,加入双氧水和磷酸(设溶液体积增加1倍),使Fe3+恰好沉淀完全,即溶液中c(Fe3+)=1.0×10-5mol/L,此时是否有Mg3(PO4)2沉淀生成?
(2)常温下Ksp[Fe(OH)3]=8.0×10−38,Ksp[Cu(OH)2]=3.0×10−20,通常认为残留在溶液中的离子浓度小于1×10−5mol⋅L−1时就认为沉淀完全,设溶液中CuSO4的浓度为3.0mol⋅L−1,为除去溶液中的Fe3+而不影响Cu2+,溶液的pH的范围为
(3)矿物中各种原生铜的硫化物经氧化、淋滤后可变成CuSO4溶液,并向内部渗透,遇到深层的闪锌矿(ZnS)和方铅矿(PbS),可慢慢转化为铜蓝(CuS)。写出硫酸铜与ZnS反应的离子方程式为:
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】化学中存在许多平衡,如化学平衡、电离平衡、水解平衡、溶解平衡等等,对应的有化学平衡常数、电离平衡常数等。按要求回答下列问题:
(1)反应H2(g)+I2(g)⇌2HI(g)的平衡常数为K1;反应HI(g)⇌ H2(g)+
H2(g)+ I2(g)的平衡常数为K2,则K1、K2之间的关系式为
I2(g)的平衡常数为K2,则K1、K2之间的关系式为___ (平衡常数为同温度下的测定值)
(2)汽车净化原理为2NO(g)+2CO(g) 2CO2(g)+N2(g) ΔH<0。若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且说明反应在进行到t1时刻达到平衡状态的是
2CO2(g)+N2(g) ΔH<0。若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且说明反应在进行到t1时刻达到平衡状态的是___ 。
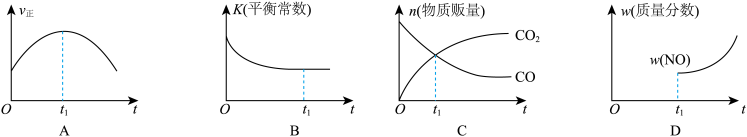
(3)某二元酸(分子式用H2B表示)在水中的电离方程式是:H2B=H++HB-;HB-⇌H++B2-。在0.1mol/L的Na2B溶液中,下列粒子浓度关系式正确的是___ 。
A.c(B2-)+c(HB-)=0.1mol/L B.c(B2-)+c(HB-)+c(H2B)= c(Na+)
c(Na+)
C.c(OH-)=c(H+)+c(HB-) D.c(Na+)+c(OH-)=c(H+)+c(HB-)
(4)下表为几种酸的电离平衡常数
则pH相同的CH3COONa、Na2CO3、NaHS溶液物质的量浓度由大到小的顺序为___ ,少量CO2与NaHS反应的离子方程式为___ 。
(5)25℃时,向0.01mol•L-1的MgCl2溶液中,逐滴加入浓NaOH溶液,刚好出现沉淀时,溶液的pH为___ ;当Mg2+完全沉淀时,溶液的pH为___ (忽略溶液体积变化,已知25℃时,Ksp[Mg(OH)2]=1.8×10-11,已知lg2.4=0.4,lg7.7=0.9。
(6)已知25℃时,Ksp[Fe(OH)3]=2.79×10-39,该温度下反应:Fe(OH)3+3H+⇌Fe3++3H2O的平衡常数K=___ 。
(1)反应H2(g)+I2(g)⇌2HI(g)的平衡常数为K1;反应HI(g)⇌
 H2(g)+
H2(g)+ I2(g)的平衡常数为K2,则K1、K2之间的关系式为
I2(g)的平衡常数为K2,则K1、K2之间的关系式为(2)汽车净化原理为2NO(g)+2CO(g)
 2CO2(g)+N2(g) ΔH<0。若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且说明反应在进行到t1时刻达到平衡状态的是
2CO2(g)+N2(g) ΔH<0。若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且说明反应在进行到t1时刻达到平衡状态的是
(3)某二元酸(分子式用H2B表示)在水中的电离方程式是:H2B=H++HB-;HB-⇌H++B2-。在0.1mol/L的Na2B溶液中,下列粒子浓度关系式正确的是
A.c(B2-)+c(HB-)=0.1mol/L B.c(B2-)+c(HB-)+c(H2B)=
 c(Na+)
c(Na+)C.c(OH-)=c(H+)+c(HB-) D.c(Na+)+c(OH-)=c(H+)+c(HB-)
(4)下表为几种酸的电离平衡常数
| CH3COOH | H2CO3 | H2S |
| 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=9.1×10-8 K2=1.1×10-12 |
(5)25℃时,向0.01mol•L-1的MgCl2溶液中,逐滴加入浓NaOH溶液,刚好出现沉淀时,溶液的pH为
(6)已知25℃时,Ksp[Fe(OH)3]=2.79×10-39,该温度下反应:Fe(OH)3+3H+⇌Fe3++3H2O的平衡常数K=
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐2】用废镍渣粉(含Ni、NiO、Al、Al2O3、FeO、SiO2)制备某镍催化剂(Ni/硅藻土)的工艺流程如下。
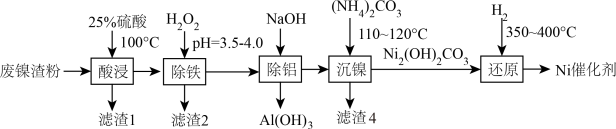
I、该工艺条件下,溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
II、室温时,Ksp[Al(OH)3]=1×10-33。
回答下列问题:。
(1)“酸浸”时,为提高浸出率,可采取的措施有___________ (列举2条)。
(2)滤渣1、滤渣2的成分依次是___________ 、___________ (填化学式)。
(3)“除铝”时,室温下,除去溶液中的Al3+[使c(Al3+)<1×10-6mol·L-1]理论上需调节溶液pH范围为___________ 。
(4)“沉镍”时,足量 沉淀Ni2+得到Ni2(OH)2CO3的离子方程式为
沉淀Ni2+得到Ni2(OH)2CO3的离子方程式为___________ ;“沉镍”时会加入硅藻土,硅藻土的作用是___________ 。;滤液4中主要阳离子为___________ (填化学式)。
(5)“还原”时,发生反应的化学方程式为___________ 。

I、该工艺条件下,溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
| 金属离子 | Fe3+ | Fe2+ | Ni2+ |
| 开始沉淀pH | 2.2 | 7.0 | 6.4 |
| 完全沉淀pH | 3.2 | 9.0 | 8.4 |
回答下列问题:。
(1)“酸浸”时,为提高浸出率,可采取的措施有
(2)滤渣1、滤渣2的成分依次是
(3)“除铝”时,室温下,除去溶液中的Al3+[使c(Al3+)<1×10-6mol·L-1]理论上需调节溶液pH范围为
(4)“沉镍”时,足量
 沉淀Ni2+得到Ni2(OH)2CO3的离子方程式为
沉淀Ni2+得到Ni2(OH)2CO3的离子方程式为(5)“还原”时,发生反应的化学方程式为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐3】钴蓝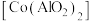 是一种重要的蓝色颜料。利用含钴废料(主要成分为
是一种重要的蓝色颜料。利用含钴废料(主要成分为 ,还含有少量的铝箔、
,还含有少量的铝箔、 等杂质)制备钴蓝的一种工艺流程如下:
等杂质)制备钴蓝的一种工艺流程如下:
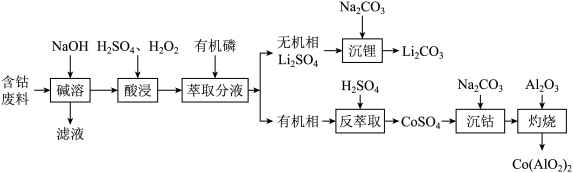
已知: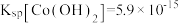
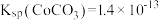
请回答以下问题:
(1)“滤液”中阴离子主要是 和
和___________ 。
(2)在实际工业生产中,“酸浸”不选用盐酸,原因是___________ 。
(3)“酸浸”过程中 发生的主要反应是
发生的主要反应是___________ (用离子方程式表示)。
(4)已知钴、锂在有机磷萃取剂中的萃取率与 的关系如图1所示,则有机磷萃取的最佳
的关系如图1所示,则有机磷萃取的最佳 为
为___________ 。
(5)根据图2判断,沉锂中若要进一步提高 的产量,还须进行的操作依次是
的产量,还须进行的操作依次是___________ 、___________ 、洗涤、干燥等步骤。
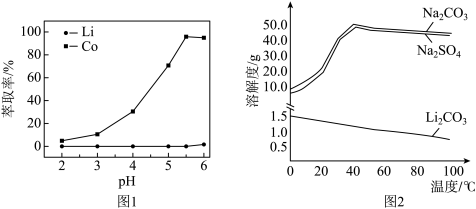
(6)若 溶液中,
溶液中,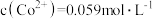 ,为防止沉钴过程中产生
,为防止沉钴过程中产生 沉淀,需控制溶液的
沉淀,需控制溶液的
___________ 。
(7)写出灼烧过程中主要反应的化学方程式___________ 。
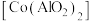 是一种重要的蓝色颜料。利用含钴废料(主要成分为
是一种重要的蓝色颜料。利用含钴废料(主要成分为 ,还含有少量的铝箔、
,还含有少量的铝箔、 等杂质)制备钴蓝的一种工艺流程如下:
等杂质)制备钴蓝的一种工艺流程如下:
已知:
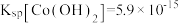
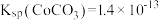
请回答以下问题:
(1)“滤液”中阴离子主要是
 和
和(2)在实际工业生产中,“酸浸”不选用盐酸,原因是
(3)“酸浸”过程中
 发生的主要反应是
发生的主要反应是(4)已知钴、锂在有机磷萃取剂中的萃取率与
 的关系如图1所示,则有机磷萃取的最佳
的关系如图1所示,则有机磷萃取的最佳 为
为(5)根据图2判断,沉锂中若要进一步提高
 的产量,还须进行的操作依次是
的产量,还须进行的操作依次是
(6)若
 溶液中,
溶液中,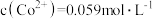 ,为防止沉钴过程中产生
,为防止沉钴过程中产生 沉淀,需控制溶液的
沉淀,需控制溶液的
(7)写出灼烧过程中主要反应的化学方程式
您最近一年使用:0次
【推荐1】A、B、C、D、E、F、G、H是元素周期表前四周期常见元素,且原子序数依次增大,其相关信息如下表:
请用化学用语填空:
(1)A元素位于元素周期表第________ 周期________ 族;B元素和C元素的第一电离能比较,较大的是________ ;C元素和F元素的电负性比较,较小的是________ 。
(2)B元素与宇宙中含量最丰富的元素形成的最简单化合物的分子构型为________ ,B元素所形成的单质分子中σ键与π键数目之比为________ 。
(3)G元素的低价阳离子的离子结构示意图是________ ,F元素原子的价电子的轨道表示式是________ ,H元素的基态原子核外电子排布式是________ 。
(4)G的高价阳离子的溶液与H单质反应的离子方程式为______________________________ ;与E元素成对角线关系的某元素的最高价氧化物的水化物具有两性,写出该两性物质与D元素的最高价氧化物的水化物反应的化学方程式:______________________________ 。
| 元素 | 相关信息 |
| A | 原子核外有6种不同运动状态的电子 |
| C | 基态原子中s电子总数与p电子总数相等 |
| D | 原子半径在同周期元素中最大 |
| E | 基态原子最外层电子排布式为3s23p1 |
| F | 基态原子的最外层p轨道有两个电子的自旋方向与其他电子的自旋方向相反 |
| G | 基态原子核外有7个能级且能量最高的能级上有6个电子 |
| H | 是我国使用最早的合金中的最主要元素 |
请用化学用语填空:
(1)A元素位于元素周期表第
(2)B元素与宇宙中含量最丰富的元素形成的最简单化合物的分子构型为
(3)G元素的低价阳离子的离子结构示意图是
(4)G的高价阳离子的溶液与H单质反应的离子方程式为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐2】五种前四周期元素A、B、C、D、E的原子序数依次增大,其原子结构等信息如下表;
回答下列问题:
(1)元素B在周期表中的位置为______ 。
(2)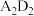 分子的电子式为
分子的电子式为______ 。
(3)A和C形成的 分子中,中心原子的杂化方式为
分子中,中心原子的杂化方式为______ 。
(4)1mol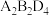 分子中含有的
分子中含有的 键数目为
键数目为______ 。
(5)与化合物BD互为等电子体的一种阴离子为______ (填化学符号)。
(6)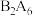 、
、 分子中均含有18个电子,但它们的沸点相差较大,主要原因是
分子中均含有18个电子,但它们的沸点相差较大,主要原因是______ 。
元素 | 元素性质或原子结构 |
A | 周期表中原子半径最小的元素 |
B | 原子核外有三种不同的能级且各个能级所填充的电子数相同 |
C | 最外层p轨道半充满 |
D | 位于短周期,原子的核外成对电子数是未成对电子数的3倍 |
E | 位于ds区且原子的最外层电子数与A相同 |
(1)元素B在周期表中的位置为
(2)
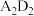 分子的电子式为
分子的电子式为(3)A和C形成的
 分子中,中心原子的杂化方式为
分子中,中心原子的杂化方式为(4)1mol
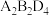 分子中含有的
分子中含有的 键数目为
键数目为(5)与化合物BD互为等电子体的一种阴离子为
(6)
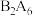 、
、 分子中均含有18个电子,但它们的沸点相差较大,主要原因是
分子中均含有18个电子,但它们的沸点相差较大,主要原因是
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】
(1)Na位于元素周期表第________ 周期第_______ 族;S的基态原子核外有_______ 个未成对电子;Si的基态原子核外电子排布式为_______ 。
(2)Cu+基态核外电子排布式为________ 。
(3)基态铁原子有_______ 个未成对电子,Fe3+的电子排布式为___________ 。
(4)31Ga基态原子的核外电子排布式是___________ 。
(5)铝原子核外电子云有______ 种不同的伸展方向,有______ 种不同运动状态的电子。
(1)Na位于元素周期表第
(2)Cu+基态核外电子排布式为
(3)基态铁原子有
(4)31Ga基态原子的核外电子排布式是
(5)铝原子核外电子云有
您最近一年使用:0次
【推荐1】金属钨是一种银白色金属,主要用于优质钢的冶炼和制造钨丝等。一种以黑钨矿(主要成分是 和
和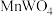 ,还含有少量
,还含有少量 杂质)为原料制备金属钨的工业流程如图所示。
杂质)为原料制备金属钨的工业流程如图所示。

已知:焙烧得到的产物的主要成分为 、
、 、
、 、
、 。
。
回答下列问题:
(1)“焙烧”时需对黑钨矿进行粉碎,其目的是_______ 。
(2)写出“焙烧”过程中 与纯碱反应的化学方程式:
与纯碱反应的化学方程式:_______ 。“滤渣1”的主要成分为_______ (填化学式)。
(3)“调pH”时发生主要反应的离子方程式为_______ 。
(4)实验室由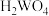 制备
制备 时,需要焙烧,此操作需要的硅酸盐仪器有酒精灯、玻璃棒、
时,需要焙烧,此操作需要的硅酸盐仪器有酒精灯、玻璃棒、_______ 。
 和
和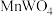 ,还含有少量
,还含有少量 杂质)为原料制备金属钨的工业流程如图所示。
杂质)为原料制备金属钨的工业流程如图所示。
已知:焙烧得到的产物的主要成分为
 、
、 、
、 、
、 。
。回答下列问题:
(1)“焙烧”时需对黑钨矿进行粉碎,其目的是
(2)写出“焙烧”过程中
 与纯碱反应的化学方程式:
与纯碱反应的化学方程式:(3)“调pH”时发生主要反应的离子方程式为
(4)实验室由
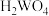 制备
制备 时,需要焙烧,此操作需要的硅酸盐仪器有酒精灯、玻璃棒、
时,需要焙烧,此操作需要的硅酸盐仪器有酒精灯、玻璃棒、
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
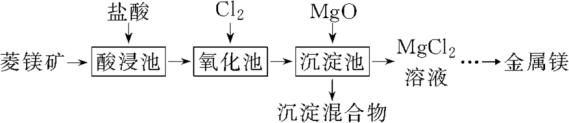
【推荐2】如图是工业利用菱镁矿MgCO3(含杂质Al2O3、FeCO3)制取镁的工艺流程。
回答有关问题:
(1)菱镁矿送入酸浸池前需要粉碎,目的是___________ 。
(2)氧化池中通入氯气的目的是氧化___________ (填化学式),工业上不选用硝酸作氧化剂的原因是___________ 和___________ 。
(3)沉淀混合物为___________ 和___________ (填化学式)。
(4)利用熔融氯化镁制取金属镁,选用的方法是___________(填字母)。

回答有关问题:
(1)菱镁矿送入酸浸池前需要粉碎,目的是
(2)氧化池中通入氯气的目的是氧化
(3)沉淀混合物为
(4)利用熔融氯化镁制取金属镁,选用的方法是___________(填字母)。
| A.电解法 | B.氢气还原法 |
| C.碳还原法 | D.分解法 |
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐3】高纯硝酸银广泛应用于感光照相、电子浆料、保温瓶胆、制镜等行业。工业上利用粗银粉制备高纯硝酸银的工艺流程如下:

已知:ⅰ.粗 粉中含有
粉中含有 、
、 、
、 、
、 等杂质;
等杂质;
ⅱ.25℃时几种氯化物的溶度积常数如下表:
ⅲ. 在较浓盐酸中,可生成
在较浓盐酸中,可生成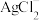 、
、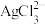 离子。
离子。
(1)酸浸:
①为加快化学反应速率,可采取的措施有_______ (写出一条即可)。
②硝酸与银的反应中,体现了硝酸的_______ 性(填“氧化”或“还原”)。
(2)沉银:在粗 溶液中主要含有
溶液中主要含有 、
、 、
、 、
、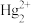 、
、 等离子。向粗
等离子。向粗 溶液中加入盐酸、氯化钠,投加量对
溶液中加入盐酸、氯化钠,投加量对 沉淀率的影响如图。
沉淀率的影响如图。
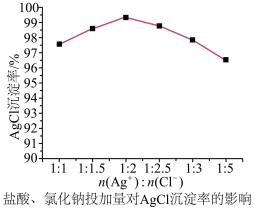
随着氯离子投加量的增加, 的沉淀率出现先增后降的趋势。
的沉淀率出现先增后降的趋势。
①当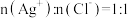 时,
时, 沉淀率并没有达到最高,原因是
沉淀率并没有达到最高,原因是_______ 。
②当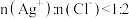 时,
时, 沉淀率降低,原因是
沉淀率降低,原因是_______ 。
(3)还原:精制 被
被 还原时,有
还原时,有 生成。反应的化学方程式为
生成。反应的化学方程式为_______ 。

已知:ⅰ.粗
 粉中含有
粉中含有 、
、 、
、 、
、 等杂质;
等杂质;ⅱ.25℃时几种氯化物的溶度积常数如下表:
| 化学式 |  |  | 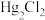 |
 |  |  | 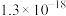 |
 在较浓盐酸中,可生成
在较浓盐酸中,可生成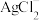 、
、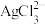 离子。
离子。(1)酸浸:
①为加快化学反应速率,可采取的措施有
②硝酸与银的反应中,体现了硝酸的
(2)沉银:在粗
 溶液中主要含有
溶液中主要含有 、
、 、
、 、
、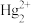 、
、 等离子。向粗
等离子。向粗 溶液中加入盐酸、氯化钠,投加量对
溶液中加入盐酸、氯化钠,投加量对 沉淀率的影响如图。
沉淀率的影响如图。
随着氯离子投加量的增加,
 的沉淀率出现先增后降的趋势。
的沉淀率出现先增后降的趋势。①当
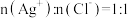 时,
时, 沉淀率并没有达到最高,原因是
沉淀率并没有达到最高,原因是②当
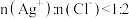 时,
时, 沉淀率降低,原因是
沉淀率降低,原因是(3)还原:精制
 被
被 还原时,有
还原时,有 生成。反应的化学方程式为
生成。反应的化学方程式为
您最近一年使用:0次




