按要求完成下列各空:
(1)25℃时,pH=2的盐酸 L与pH=10的NaOH溶液
L与pH=10的NaOH溶液 L混合,所得溶液pH=4,则
L混合,所得溶液pH=4,则
_______ 。
(2)25℃时,在等体积的①pH=1的 溶液、②
溶液、② 的
的 溶液、③pH=10的
溶液、③pH=10的 溶液、④pH=5的
溶液、④pH=5的 溶液中,发生电离的水的物质的量之比是
溶液中,发生电离的水的物质的量之比是_______ 。
(3) 相等的①
相等的① 溶液、②
溶液、② 溶液、③
溶液、③ 溶液、④
溶液、④ 溶液,其物质的量浓度由大到小的顺序为
溶液,其物质的量浓度由大到小的顺序为_______ 。(填写序号)
(4)向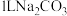 溶液中加入足量
溶液中加入足量 固体,当溶液中
固体,当溶液中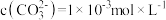 时,此时溶液中
时,此时溶液中
_______  。[已知
。[已知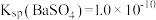 ,
,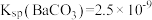 ]
]
(1)25℃时,pH=2的盐酸
 L与pH=10的NaOH溶液
L与pH=10的NaOH溶液 L混合,所得溶液pH=4,则
L混合,所得溶液pH=4,则
(2)25℃时,在等体积的①pH=1的
 溶液、②
溶液、② 的
的 溶液、③pH=10的
溶液、③pH=10的 溶液、④pH=5的
溶液、④pH=5的 溶液中,发生电离的水的物质的量之比是
溶液中,发生电离的水的物质的量之比是(3)
 相等的①
相等的① 溶液、②
溶液、② 溶液、③
溶液、③ 溶液、④
溶液、④ 溶液,其物质的量浓度由大到小的顺序为
溶液,其物质的量浓度由大到小的顺序为(4)向
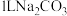 溶液中加入足量
溶液中加入足量 固体,当溶液中
固体,当溶液中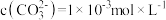 时,此时溶液中
时,此时溶液中
 。[已知
。[已知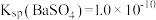 ,
,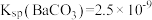 ]
]
更新时间:2022-06-30 20:49:18
|
相似题推荐
填空题
|
适中
(0.65)
【推荐1】现有浓度均为0.1 mol/L的下列溶液:①硫酸 ②醋酸 ③氢氧化钠 ④氯化铵⑤硫酸铝 ⑥碳酸氢钠。请回答下列问题:
(1)①②③④四种溶液中由水电离出的H+浓度由大到小的顺序是__________ (填序号)。
(2)已知T℃,Kw = 1×10-13,则T℃______ (填“>”、“<”、“=”)25℃。在T℃时,将pH = 11的③溶液a L与pH =2的①溶液b L混合(忽略混合后溶液体积的变化),若所得溶液的pH = 10,则a:b =__________________ 。
(3)将⑤溶液和⑥溶液混合时,可看到的实验现象是___________________________ ,产生该现象的原因是______________________________________ (用离子方程式解释原因)。
(1)①②③④四种溶液中由水电离出的H+浓度由大到小的顺序是
(2)已知T℃,Kw = 1×10-13,则T℃
(3)将⑤溶液和⑥溶液混合时,可看到的实验现象是
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】现有常温下的六份溶液:①0.01mol/L CH3COOH溶液;②0.01mol/L HCl溶液;③pH=12的氨水;④pH=12的NaOH溶液;⑤0.01mol/L CH3COOH溶液与 0.01mol/L的氨水等体积混合后所得溶液;⑥0.01mol/L HCl溶液与 pH=12的NaOH溶液等体积混合所得溶液。
(1)其中水的电离程度最大的是________ (选填序号,下同),水的电离程度相同的是________ ;
(2)若将②、③混合后所得溶液pH=7,则消耗溶液的体积:②________ ③(选填“>”、“<”或“=”,下同);若将②、③溶液等体积混合后,所得溶液pH________ 7。
(3)若将①、④溶液按体积比为2∶1混合后,所得溶液pH______ 7(选填“>”、“<”或“=”)此时溶液中除水分子外的各微粒的浓度由大到小的顺序为:__________ ;将①、④混合,若有c(CH3COO-)>c(H+),则混合液可能呈_________ (填序号)。
A.酸性 B.碱性 C.中性
(1)其中水的电离程度最大的是
(2)若将②、③混合后所得溶液pH=7,则消耗溶液的体积:②
(3)若将①、④溶液按体积比为2∶1混合后,所得溶液pH
A.酸性 B.碱性 C.中性
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】已知常温下部分弱电解质的电离平衡常数如下表(已知lg2=0.3):
(1)常温下,0.1mol/L的HClO溶液和0.1mol/L的NaClO溶液等体积混合,判断混合溶液的酸碱性___________ (填“酸性”“碱性”“中性”)。
(2)25℃时,将amol/L的氨水与0.01mol/L的盐酸等体积混合,反应后溶液呈中性,用含a的代数式表示NH3·H2O的电离平衡常数Kb___________ 。
(3)CO2可以被NaOH溶液捕获。若所得溶液中c(CO )=c(H2CO3)时,则溶液的pH=
)=c(H2CO3)时,则溶液的pH=______ 。
(4)含H2S的尾气用足量的Na2CO3溶液来吸收,写出离子方程式:___________ 。
(5)已知100℃下,Kw=10-12.将pH11的苛性钠溶液V1L与pH=1的稀硫酸V2L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则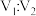 =
=___________ 。
(6)常温下,向0.1mol/LH2S溶液中通入HCl气体或加入NaOH固体,测得c(S2-)与溶液pH的关系如图(忽略溶液体积的变化及H2S的挥发)。请计算:

①当溶液中c(S2-)=1.4×10-19mol/L溶液时,水电离产生的c(H+)___________ mol/L。
②当pH=13时,溶液中c(H2S)+c(HS-)=___________ mol/L。
| 化学式 | H2S | HClO | H2CO3 |
| 电离常数 | K1=9.1×10-8 K2=1.1×10-12 | 4.7×10-8 | K1=4×10-7 K2=5×10-11 |
(1)常温下,0.1mol/L的HClO溶液和0.1mol/L的NaClO溶液等体积混合,判断混合溶液的酸碱性
(2)25℃时,将amol/L的氨水与0.01mol/L的盐酸等体积混合,反应后溶液呈中性,用含a的代数式表示NH3·H2O的电离平衡常数Kb
(3)CO2可以被NaOH溶液捕获。若所得溶液中c(CO
 )=c(H2CO3)时,则溶液的pH=
)=c(H2CO3)时,则溶液的pH=(4)含H2S的尾气用足量的Na2CO3溶液来吸收,写出离子方程式:
(5)已知100℃下,Kw=10-12.将pH11的苛性钠溶液V1L与pH=1的稀硫酸V2L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则
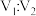 =
=(6)常温下,向0.1mol/LH2S溶液中通入HCl气体或加入NaOH固体,测得c(S2-)与溶液pH的关系如图(忽略溶液体积的变化及H2S的挥发)。请计算:

①当溶液中c(S2-)=1.4×10-19mol/L溶液时,水电离产生的c(H+)
②当pH=13时,溶液中c(H2S)+c(HS-)=
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐1】填空
(1)实验室可用NaOH溶液吸收 ,反应为
,反应为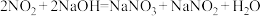 。含0.2molNaOH的水溶液与0.2mol
。含0.2molNaOH的水溶液与0.2mol 恰好完全反应得1L溶液A,溶液B为
恰好完全反应得1L溶液A,溶液B为 的
的 溶液,则两溶液中
溶液,则两溶液中 和
和 由大到小的顺序为
由大到小的顺序为_______ (已知 的电离常数
的电离常数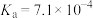 ,
, 的电离常数
的电离常数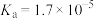 )。可使溶液A和溶液B的pH相等的方法是
)。可使溶液A和溶液B的pH相等的方法是_______ (填序号)。
a.向溶液A中加适量水 b.向溶液A中加适量NaOH
c.向溶液B中加适量水 d.向溶液B中加适量NaOH
(2)直接排放含 的烟气会形成酸雨,危害环境。利用钠碱循环法可脱除烟气中的
的烟气会形成酸雨,危害环境。利用钠碱循环法可脱除烟气中的 。吸收液(NaOH溶液)吸收
。吸收液(NaOH溶液)吸收 的过程中,pH随
的过程中,pH随 的变化如下表:
的变化如下表:
①由上表判断 溶液显
溶液显_______ 性,用化学平衡原理解释:_______ 。
②当吸收液呈中性时,溶液中离子浓度关系正确的是_______ (填序号)。
a.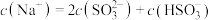
b.
c.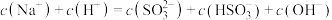
(1)实验室可用NaOH溶液吸收
 ,反应为
,反应为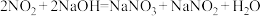 。含0.2molNaOH的水溶液与0.2mol
。含0.2molNaOH的水溶液与0.2mol 恰好完全反应得1L溶液A,溶液B为
恰好完全反应得1L溶液A,溶液B为 的
的 溶液,则两溶液中
溶液,则两溶液中 和
和 由大到小的顺序为
由大到小的顺序为 的电离常数
的电离常数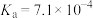 ,
, 的电离常数
的电离常数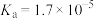 )。可使溶液A和溶液B的pH相等的方法是
)。可使溶液A和溶液B的pH相等的方法是a.向溶液A中加适量水 b.向溶液A中加适量NaOH
c.向溶液B中加适量水 d.向溶液B中加适量NaOH
(2)直接排放含
 的烟气会形成酸雨,危害环境。利用钠碱循环法可脱除烟气中的
的烟气会形成酸雨,危害环境。利用钠碱循环法可脱除烟气中的 。吸收液(NaOH溶液)吸收
。吸收液(NaOH溶液)吸收 的过程中,pH随
的过程中,pH随 的变化如下表:
的变化如下表: | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
①由上表判断
 溶液显
溶液显②当吸收液呈中性时,溶液中离子浓度关系正确的是
a.
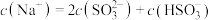
b.

c.
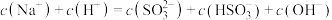
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】已知常温下部分弱电解质的电离平衡常数如表:
(1)常温下,物质的量溶度相同的三种溶液①NaF溶液②NaClO溶液③Na2CO3溶液,其pH由大到小的顺序是___________ (填序号)。
(2)25℃时,pH=4的NH4Cl溶液中各离子浓度的大小关系为___________ 。
(3)NaClO溶液中的电荷守恒关系为___________ 。
(4)向NaClO溶液中通入少量的CO2,所发生的离子方程式为___________ 。
(5)25℃下,将 的苛性钠溶液
的苛性钠溶液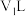 与
与 的稀硫酸
的稀硫酸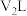 混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的
混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的 ,则
,则
___________ 。
(6)25℃时, 的电离常数
的电离常数 ,则该温度下
,则该温度下 的水解常数
的水解常数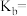
___________ ;若向 溶液中加入少量的
溶液中加入少量的 ,则溶液中
,则溶液中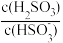 将
将___________ (填“增大”“减小”或“不变”)。
| 化学式 | HF | HClO | H2CO3 | NH3·H2O |
| 电离常数 | 6.8×10-4 | 4.7×10-8 | K1=4.3×10-7 K2=5.6×10-11 | Kb=1.7×10-5 |
(2)25℃时,pH=4的NH4Cl溶液中各离子浓度的大小关系为
(3)NaClO溶液中的电荷守恒关系为
(4)向NaClO溶液中通入少量的CO2,所发生的离子方程式为
(5)25℃下,将
 的苛性钠溶液
的苛性钠溶液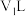 与
与 的稀硫酸
的稀硫酸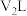 混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的
混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的 ,则
,则
(6)25℃时,
 的电离常数
的电离常数 ,则该温度下
,则该温度下 的水解常数
的水解常数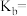
 溶液中加入少量的
溶液中加入少量的 ,则溶液中
,则溶液中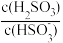 将
将
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】已知K、Ka、Kw、Ksp分别表示化学平衡常数、弱酸的电离平衡常数、水的离子积常数、难溶电解质的溶度积常数。
(1)有关上述常数的说法正确的是___ 。
 它们都能反映一定条件下对应变化进行的程度
它们都能反映一定条件下对应变化进行的程度
 它们的大小都随温度的升高而增大
它们的大小都随温度的升高而增大
 常温下,CH3COOH在水中的Ka大于在饱和CH3COONa溶液中的Ka
常温下,CH3COOH在水中的Ka大于在饱和CH3COONa溶液中的Ka
(2)已知25℃时CH3COOH和NH3·H2O电离常数相等,则该温度下CH3COONH4溶液中水电离的H+浓度为___ ,溶液中离子浓度大小关系为___ 。
(3)氯化铝溶液蒸干、灼烧后得到的固体物质是___ 。
(4)泡沫灭火器的反应原理(硫酸铝溶液与小苏打)___ 。(写离子方程式)
(5)已知在25℃时Ksp[Mg(OH)2]=3.2×10-11,Ksp[Cu(OH)2]=2.2×10-20。25℃时,向浓度均为0.02mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入NaOH溶液,先生成沉淀___ (填化学式);当两种沉淀共存时,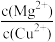 =
=___ 。
(1)有关上述常数的说法正确的是
 它们都能反映一定条件下对应变化进行的程度
它们都能反映一定条件下对应变化进行的程度 它们的大小都随温度的升高而增大
它们的大小都随温度的升高而增大 常温下,CH3COOH在水中的Ka大于在饱和CH3COONa溶液中的Ka
常温下,CH3COOH在水中的Ka大于在饱和CH3COONa溶液中的Ka(2)已知25℃时CH3COOH和NH3·H2O电离常数相等,则该温度下CH3COONH4溶液中水电离的H+浓度为
(3)氯化铝溶液蒸干、灼烧后得到的固体物质是
(4)泡沫灭火器的反应原理(硫酸铝溶液与小苏打)
(5)已知在25℃时Ksp[Mg(OH)2]=3.2×10-11,Ksp[Cu(OH)2]=2.2×10-20。25℃时,向浓度均为0.02mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入NaOH溶液,先生成沉淀
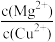 =
=
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐1】(1)对于Ag2S(s)⇌2Ag+(aq)+S2-(aq),其Ksp的表达式为_______
(2)下列说法不正确的是_______ (填序号)。
①用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl少
②一般来说,物质的溶解度随温度的升高而增加,故物质的溶解过程大多是吸热过程
③对于Al(OH)3(s)⇌Al3+(aq)+3OH-(aq)和Al(OH)3⇌Al3++3OH-,前者为溶解平衡,后者为电离平衡
④除去溶液中的Mg2+,用OH-沉淀比用CO 好,说明Mg(OH)2的溶解度比MgCO3大
好,说明Mg(OH)2的溶解度比MgCO3大
⑤沉淀反应中常加入过量的沉淀剂,其目的是使沉淀更完全
(3)如何除去Mg(OH)2中混有的Ca(OH)2_______
(4)已知在25 ℃时Ksp[Mg(OH)2]=3.2×10-11,向0.02 mol·L-1的MgCl2溶液中加入NaOH固体,如要生成Mg(OH)2沉淀,应使溶液中的c(OH-)最小为_______ mol·L-1。
(2)下列说法不正确的是
①用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl少
②一般来说,物质的溶解度随温度的升高而增加,故物质的溶解过程大多是吸热过程
③对于Al(OH)3(s)⇌Al3+(aq)+3OH-(aq)和Al(OH)3⇌Al3++3OH-,前者为溶解平衡,后者为电离平衡
④除去溶液中的Mg2+,用OH-沉淀比用CO
 好,说明Mg(OH)2的溶解度比MgCO3大
好,说明Mg(OH)2的溶解度比MgCO3大⑤沉淀反应中常加入过量的沉淀剂,其目的是使沉淀更完全
(3)如何除去Mg(OH)2中混有的Ca(OH)2
(4)已知在25 ℃时Ksp[Mg(OH)2]=3.2×10-11,向0.02 mol·L-1的MgCl2溶液中加入NaOH固体,如要生成Mg(OH)2沉淀,应使溶液中的c(OH-)最小为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】AgNO3为中学常用化学试剂,某学习小组研究其性质。
(1)测量 0.1 mol/LAgNO3溶液pH值为4,用离子方程式解释其原因___________ 。
(2)AgSCN为白色沉淀,设计实验证明Ksp(AgSCN)>Ksp(AgI),完善以下实验步骤:
取0.1 mL1 mol/L AgNO3溶液于洁净的试管中,加入___________ ,振荡,再加入___________ ,振荡,观察到白色沉淀变成黄色,则证明上述结论。
探究一:证明AgNO3具有氧化性
(3)往4 mL0.1 mol/L(NH4)2Fe(SO4)2 [pH≈2]溶液中滴加几滴___________ ,把混合溶液均分到加a、b两支试管中。同学甲往a试管中滴加少量0.1 mol/L AgNO3溶液,观察到产生少量白色沉淀和___________ (填实验现象),证明AgNO3具有氧化性。
(4)同学乙认为:氧化Fe2+的,可能是Ag+,也可能是 。若向b试管中滴加少量“检测试剂”,无明显现象,则证明氧化剂为Ag+。写出这种“检测试剂”的配方:
。若向b试管中滴加少量“检测试剂”,无明显现象,则证明氧化剂为Ag+。写出这种“检测试剂”的配方:___________ 。
探究二:AgNO3溶液与过量 铁粉的反应
向酸化的0.1 mol/L AgNO3溶液[pH≈2]中加入过量铁粉,搅拌后静置,随着反应进行,在不同时间取上层清液,滴加KSCN溶液,溶液变红,同时有白色沉淀生成,且溶液颜色深浅、沉淀量多少与取样时间有关,对比实验记录如下:
(5)用离子方程式解释实验中①出现红色的原因: ,
,___________ ,___________ 。
(6)解释实验②的现象:___________ 。
(7)用离子方程式解释实验③中红色变浅的原因:___________ 。
(1)测量 0.1 mol/LAgNO3溶液pH值为4,用离子方程式解释其原因
(2)AgSCN为白色沉淀,设计实验证明Ksp(AgSCN)>Ksp(AgI),完善以下实验步骤:
取0.1 mL1 mol/L AgNO3溶液于洁净的试管中,加入
探究一:证明AgNO3具有氧化性
(3)往4 mL0.1 mol/L(NH4)2Fe(SO4)2 [pH≈2]溶液中滴加几滴
(4)同学乙认为:氧化Fe2+的,可能是Ag+,也可能是
 。若向b试管中滴加少量“检测试剂”,无明显现象,则证明氧化剂为Ag+。写出这种“检测试剂”的配方:
。若向b试管中滴加少量“检测试剂”,无明显现象,则证明氧化剂为Ag+。写出这种“检测试剂”的配方:探究二:AgNO3溶液与
向酸化的0.1 mol/L AgNO3溶液[pH≈2]中加入过量铁粉,搅拌后静置,随着反应进行,在不同时间取上层清液,滴加KSCN溶液,溶液变红,同时有白色沉淀生成,且溶液颜色深浅、沉淀量多少与取样时间有关,对比实验记录如下:
| 序号 | 取样时间/min | 现象 |
| ① | 3 | 产生大量白色沉淀;溶液呈红色 |
| ② | 30 | 产生白色沉淀,较3 min时量少;溶液红色较3 min时加深 |
| ③ | 120 | 产生白色沉淀,较30 min时量少;溶液红色较30 min时变浅 |
 ,
,(6)解释实验②的现象:
(7)用离子方程式解释实验③中红色变浅的原因:
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】常温下,CaS的 ,饱和溶液中存在平衡:
,饱和溶液中存在平衡: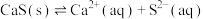 。试根据沉淀溶解平衡知识回答问题:
。试根据沉淀溶解平衡知识回答问题:
(1)该温度下,将 氯化钙溶液
氯化钙溶液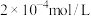 硫化钠溶液等体积混合,
硫化钠溶液等体积混合,___________ (填“能”或“不能”)产生沉淀。滴加少量盐酸,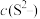
___________ (填“增大”或“减小”),请从平衡移动原理的角度解释:___________ 。
(2)若向CaS悬浊液中加入CuSO4溶液,生成一种黑色固体物质,写出该过程中反应的离子方程式___________ 。
(3)已知 ,在
,在 的溶液中,当
的溶液中,当 刚开始沉淀时,溶液的pH为
刚开始沉淀时,溶液的pH为___________ (保留1为小数,下同);若要使其沉淀完全,pH的范围是___________ 。
 ,饱和溶液中存在平衡:
,饱和溶液中存在平衡: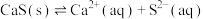 。试根据沉淀溶解平衡知识回答问题:
。试根据沉淀溶解平衡知识回答问题:(1)该温度下,将
 氯化钙溶液
氯化钙溶液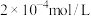 硫化钠溶液等体积混合,
硫化钠溶液等体积混合,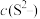
(2)若向CaS悬浊液中加入CuSO4溶液,生成一种黑色固体物质,写出该过程中反应的离子方程式
(3)已知
 ,在
,在 的溶液中,当
的溶液中,当 刚开始沉淀时,溶液的pH为
刚开始沉淀时,溶液的pH为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】硫代硫酸钠(Na2S2O3)应用广泛,可用作定影液、含砷废水去除剂、定量分析还原剂等。
(1)Na2S2O3可用作定影液熔解未曝光的溴化银(AgBr),通过如图1所示转化可实现定影液再生,也可达到回收银的目的。
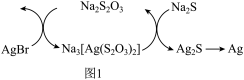
AgBr溶于Na2S2O3溶液反应的离子方程式为________ 。
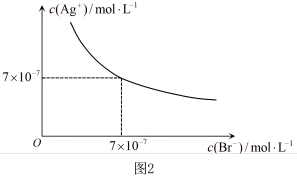
(2)在t℃时,AgBr在水中的沉淀溶解平衡曲线如图2所示。已知t℃时,Ksp(AgCl)=4.9×10-10,在t℃时,反应AgCl(s)+Br-(aq) AgBr(s)+Cl-(aq)的平衡常数K=
AgBr(s)+Cl-(aq)的平衡常数K=_______ 。
(3)Na2S2O3去除酸性废水中H3AsO3的反应机理如图3所示(图中“HS”为自由基,“•”表示孤单电子)。
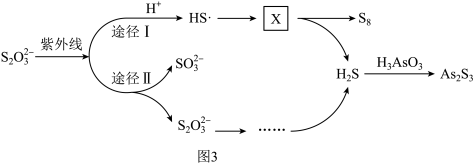
方框中X的化学式为_______ 。
(4)Na2S2O3可测定含Cr2O 废水中Cr元素的含量。量取废水20.00mL,硫酸酸化后加入过量KI溶液,发生反应:6I-+14H++Cr2O
废水中Cr元素的含量。量取废水20.00mL,硫酸酸化后加入过量KI溶液,发生反应:6I-+14H++Cr2O =3I2+2Cr3++7H2O。加入少量淀粉作为指示剂,用0.1000mol•L-1Na2S2O3标准溶液滴定至终点,发生反应:I2+2S2O
=3I2+2Cr3++7H2O。加入少量淀粉作为指示剂,用0.1000mol•L-1Na2S2O3标准溶液滴定至终点,发生反应:I2+2S2O =2I-+S4O
=2I-+S4O 平行滴定3次,平均消耗标准Na2S2O3溶液24.00mL。
平行滴定3次,平均消耗标准Na2S2O3溶液24.00mL。
①滴定终点的现象为_______ 。
②废水中Cr元素的量为_______ 。
(1)Na2S2O3可用作定影液熔解未曝光的溴化银(AgBr),通过如图1所示转化可实现定影液再生,也可达到回收银的目的。
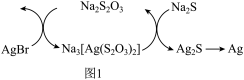
AgBr溶于Na2S2O3溶液反应的离子方程式为
(2)在t℃时,AgBr在水中的沉淀溶解平衡曲线如图2所示。已知t℃时,Ksp(AgCl)=4.9×10-10,在t℃时,反应AgCl(s)+Br-(aq)
 AgBr(s)+Cl-(aq)的平衡常数K=
AgBr(s)+Cl-(aq)的平衡常数K=
(3)Na2S2O3去除酸性废水中H3AsO3的反应机理如图3所示(图中“HS”为自由基,“•”表示孤单电子)。

方框中X的化学式为
(4)Na2S2O3可测定含Cr2O
 废水中Cr元素的含量。量取废水20.00mL,硫酸酸化后加入过量KI溶液,发生反应:6I-+14H++Cr2O
废水中Cr元素的含量。量取废水20.00mL,硫酸酸化后加入过量KI溶液,发生反应:6I-+14H++Cr2O =3I2+2Cr3++7H2O。加入少量淀粉作为指示剂,用0.1000mol•L-1Na2S2O3标准溶液滴定至终点,发生反应:I2+2S2O
=3I2+2Cr3++7H2O。加入少量淀粉作为指示剂,用0.1000mol•L-1Na2S2O3标准溶液滴定至终点,发生反应:I2+2S2O =2I-+S4O
=2I-+S4O 平行滴定3次,平均消耗标准Na2S2O3溶液24.00mL。
平行滴定3次,平均消耗标准Na2S2O3溶液24.00mL。①滴定终点的现象为
②废水中Cr元素的量为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】弱电解质的电离平衡、盐类的水解平衡和难溶物的溶解平衡均属于化学平衡。
(1)已知H2A在水中存在以下平衡:H2A=H++HA-,HA- H++A2-。
H++A2-。
①等物质的量浓度的两种溶液:NaHA溶液的pH________ (填“大于”“小于”或“等于”)Na2A溶液的pH。NaHA溶液中存在_______ 个平衡。
②某温度下,若向0.1mol·L-1的NaHA溶液中逐滴滴加0.1mol·L-1 KOH溶液至溶液呈中性。此时该混合溶液中,下列关系中一定正确的是________ 。
A.c(H+)·c(OH-)=1×10-14
B.c(Na+)+c(K+)=c(HA-)+2c(A2-)
C.c(Na+)<c(K+)
D.c(Na+)+c(K+)=0.1mol·L-1
③已知常温下H2A的钙盐(CaA)的饱和溶液中存在以下平衡:CaA(s) Ca2+(aq)+A2-(aq) ΔH>0。若要使该溶液中Ca2+浓度变小,可采取的措施有
Ca2+(aq)+A2-(aq) ΔH>0。若要使该溶液中Ca2+浓度变小,可采取的措施有________ 。
A.升高温度 B.降低温度 C.加入NH4Cl晶体 D.加入Na2A固体
(2)已知:常温时CH3COOH CH3COO-+H+,Ka=2×10-5则反应CH3COO-+H2O
CH3COO-+H+,Ka=2×10-5则反应CH3COO-+H2O CH3COOH+OH-的平衡常数Kh=
CH3COOH+OH-的平衡常数Kh=________ 。
(3)常温下,若在0.10mol·L-1 CuSO4溶液中加入NaOH稀溶液充分搅拌,有浅蓝色氢氧化铜沉淀生成,当溶液的pH=8时,c(Cu2+)=________ mol·L-1{Ksp[Cu(OH)2]=2.2×10-20}。
(1)已知H2A在水中存在以下平衡:H2A=H++HA-,HA-
 H++A2-。
H++A2-。①等物质的量浓度的两种溶液:NaHA溶液的pH
②某温度下,若向0.1mol·L-1的NaHA溶液中逐滴滴加0.1mol·L-1 KOH溶液至溶液呈中性。此时该混合溶液中,下列关系中一定正确的是
A.c(H+)·c(OH-)=1×10-14
B.c(Na+)+c(K+)=c(HA-)+2c(A2-)
C.c(Na+)<c(K+)
D.c(Na+)+c(K+)=0.1mol·L-1
③已知常温下H2A的钙盐(CaA)的饱和溶液中存在以下平衡:CaA(s)
 Ca2+(aq)+A2-(aq) ΔH>0。若要使该溶液中Ca2+浓度变小,可采取的措施有
Ca2+(aq)+A2-(aq) ΔH>0。若要使该溶液中Ca2+浓度变小,可采取的措施有A.升高温度 B.降低温度 C.加入NH4Cl晶体 D.加入Na2A固体
(2)已知:常温时CH3COOH
 CH3COO-+H+,Ka=2×10-5则反应CH3COO-+H2O
CH3COO-+H+,Ka=2×10-5则反应CH3COO-+H2O CH3COOH+OH-的平衡常数Kh=
CH3COOH+OH-的平衡常数Kh=(3)常温下,若在0.10mol·L-1 CuSO4溶液中加入NaOH稀溶液充分搅拌,有浅蓝色氢氧化铜沉淀生成,当溶液的pH=8时,c(Cu2+)=
您最近一年使用:0次
【推荐3】重金属元素铬的毒性较大,含铬废水需经处理达标后才能排放。
(Ⅰ)某工业废水中主要含有Cr3+,同时还含有少量的Fe2+、Fe3+、Al3+、Ca2+和Mg2+等,且酸性较强。为回收利用,通常采用如下流程处理:
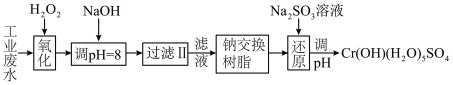
注:部分阳离子常温下以氢氧化物形式完全沉淀时溶液的pH见下表。
(1)氧化过程中可代替H2O2加入的试剂是________ 。(填序号)
(2)已知钠离子交换树脂的原理:Mn++nNaR→MRn+nNa+,此步操作被交换除去的杂质离子_________ (填序号)
(3)常温下,Cr(OH)3的溶度积Ksp=1.0×10-32溶液中pH应为________ 时Cr3+恰好完全沉淀,则还原过程中的离子方程式________________________ (已知在氧化过程中Cr3+转化为 )。
)。
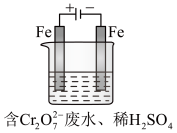
(Ⅱ)酸性条件下,铬元素主要以 形式存在,工业上常用电解法处理含
形式存在,工业上常用电解法处理含 的废水。实验室利用如图装置模拟处理该废水,阳极反应是
的废水。实验室利用如图装置模拟处理该废水,阳极反应是 ,阴极反应式是
,阴极反应式是 。
。
(1)电解时能否用Cu电极来代替Fe电极?________ (填“能”或“不能”)
(2)电解时阳极附近溶液中转化为Cr3+的离子方程式为________________________________ 。
(3)若溶液中初始含有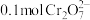 ,则生成的阳离子全部转化成沉淀的质量是
,则生成的阳离子全部转化成沉淀的质量是________ g。
(Ⅰ)某工业废水中主要含有Cr3+,同时还含有少量的Fe2+、Fe3+、Al3+、Ca2+和Mg2+等,且酸性较强。为回收利用,通常采用如下流程处理:

注:部分阳离子常温下以氢氧化物形式完全沉淀时溶液的pH见下表。
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 | Al(OH)3 | Cr(OH)3 |
| pH | 3.7 | 9.6 | 11.1 | 8 | 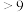 溶解 溶解 |
(1)氧化过程中可代替H2O2加入的试剂是
A.Na2O2 B.HNO3 C.FeCl3 D.KMnO4
(2)已知钠离子交换树脂的原理:Mn++nNaR→MRn+nNa+,此步操作被交换除去的杂质离子
A.Fe3+ B.Al3+ C.Ca2+ D.Mg2+
(3)常温下,Cr(OH)3的溶度积Ksp=1.0×10-32溶液中pH应为
 )。
)。(Ⅱ)酸性条件下,铬元素主要以
 形式存在,工业上常用电解法处理含
形式存在,工业上常用电解法处理含 的废水。实验室利用如图装置模拟处理该废水,阳极反应是
的废水。实验室利用如图装置模拟处理该废水,阳极反应是 ,阴极反应式是
,阴极反应式是 。
。(1)电解时能否用Cu电极来代替Fe电极?
(2)电解时阳极附近溶液中转化为Cr3+的离子方程式为
(3)若溶液中初始含有
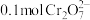 ,则生成的阳离子全部转化成沉淀的质量是
,则生成的阳离子全部转化成沉淀的质量是
您最近一年使用:0次



