1 . 回答下列问题:
I.用石油裂化和裂解过程得到的乙烯、丙烯来合成聚丙烯酸乙酯的路线如下:
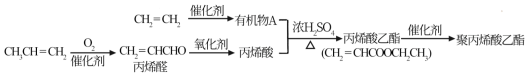
根据以上材料和你所学的化学知识回答:
(1)由CH2=CH2制得有机物A的化学反应类型是_______ 。
(2)有机物A与丙烯酸反应的方程式是_______ 。
(3)聚丙烯酸乙酯的结构简式是_______ 。
II.孔雀石的主要成分是CuCO3•Cu(OH)2,还含有少量的SiO2和铁的化合物。实验室以该孔雀石为原料制备CuSO4•5H2O的流程设计如下:
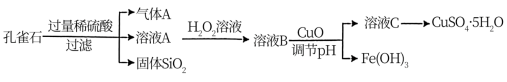
请回答:
(4)溶液A的金属离子有Cu2+、Fe3+、Fe2+。若要检验溶液A中的Fe2+,可选用的试剂_______ (填序号)。
a. KMnO4 b. KSCN c. NaCl d. K3[Fe(CN)6]
(5)溶液A中加入H2O2溶液的目的是将溶液中的Fe2+氧化为Fe3+,反应的离子方程式是:______ 。
(6)从溶液C中获得CuSO4•5H2O,需要经过蒸发浓缩、_______ 、过滤等操作。
I.用石油裂化和裂解过程得到的乙烯、丙烯来合成聚丙烯酸乙酯的路线如下:

根据以上材料和你所学的化学知识回答:
(1)由CH2=CH2制得有机物A的化学反应类型是
(2)有机物A与丙烯酸反应的方程式是
(3)聚丙烯酸乙酯的结构简式是
II.孔雀石的主要成分是CuCO3•Cu(OH)2,还含有少量的SiO2和铁的化合物。实验室以该孔雀石为原料制备CuSO4•5H2O的流程设计如下:

请回答:
(4)溶液A的金属离子有Cu2+、Fe3+、Fe2+。若要检验溶液A中的Fe2+,可选用的试剂
a. KMnO4 b. KSCN c. NaCl d. K3[Fe(CN)6]
(5)溶液A中加入H2O2溶液的目的是将溶液中的Fe2+氧化为Fe3+,反应的离子方程式是:
(6)从溶液C中获得CuSO4•5H2O,需要经过蒸发浓缩、
您最近一年使用:0次
解题方法
2 . 高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含 、
、 、
、 、
、 、
、 、
、 等元素的氧化物)制备,工艺如图所示。回答下列问题:
等元素的氧化物)制备,工艺如图所示。回答下列问题:

相关金属离子[起始浓度为 ]形成氢氧化物沉淀的
]形成氢氧化物沉淀的 范围如表:
范围如表:
(1)“滤渣1”含有 和
和___________ 。
(2)“氧化”中添加适量的 的作用是将
的作用是将 氧化为
氧化为 ,写出该反应的离子方程式为
,写出该反应的离子方程式为___________ 。
(3)调 范围为4.7~6,滤渣2成分的化学式为
范围为4.7~6,滤渣2成分的化学式为___________ 。
(4)“除杂1”的目的是除去 和
和 ,“滤渣3”的主要成分是
,“滤渣3”的主要成分是___________ 。
(5)“除杂2”的目的是生成 沉淀除去
沉淀除去 。若溶液酸度过高,
。若溶液酸度过高, 沉淀不完全,原因是
沉淀不完全,原因是___________ (从沉淀溶解平衡角度解释)。
(6)写出“沉锰”的离子方程式___________ 。
 、
、 、
、 、
、 、
、 、
、 等元素的氧化物)制备,工艺如图所示。回答下列问题:
等元素的氧化物)制备,工艺如图所示。回答下列问题:
相关金属离子[起始浓度为
 ]形成氢氧化物沉淀的
]形成氢氧化物沉淀的 范围如表:
范围如表:| 金属离子 | Mn2+ | Fe2+ | Fe3+ | Al3+ | Mg2+ | Zn2+ | Ni2+ |
| 开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 | 6.9 |
| 沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 | 8.9 |
(1)“滤渣1”含有
 和
和(2)“氧化”中添加适量的
 的作用是将
的作用是将 氧化为
氧化为 ,写出该反应的离子方程式为
,写出该反应的离子方程式为(3)调
 范围为4.7~6,滤渣2成分的化学式为
范围为4.7~6,滤渣2成分的化学式为(4)“除杂1”的目的是除去
 和
和 ,“滤渣3”的主要成分是
,“滤渣3”的主要成分是(5)“除杂2”的目的是生成
 沉淀除去
沉淀除去 。若溶液酸度过高,
。若溶液酸度过高, 沉淀不完全,原因是
沉淀不完全,原因是(6)写出“沉锰”的离子方程式
您最近一年使用:0次
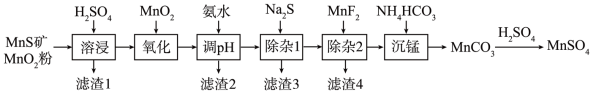
3 . 高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺如图所示。回答下列问题:
相关金属离子[c0(Mn+)=0.1mol∙L-1]形成氢氧化物沉淀的 pH范围如表:
(1)“滤渣1”含有S和_______ ; 写出“溶浸”中二氧化锰与硫化锰反应的化学方程式为_______
(2)“氧化”中添加适量的MnO2的作用是将 Fe2+氧化为 Fe3+,写出该反应的离子方程式为_______ 。
(3)调pH范围为4.7~6,滤渣2成分的化学式为_________ 。
(4)“除杂1”的目的是除去Zn2+和 Ni2+,“滤渣3”的主要成分是__________ 。
(5)“除杂2”的目的是生成MgF2沉淀除去Mg2+。若溶液酸度过高,Mg2+沉淀不完全,原因是_______ 。
(6)写出“沉锰”的离子方程式_______
(7)层状镍钴锰三元材料可作为锂离子电池正极材料,其化学式为 LiNixCoyMnzO2,其中Ni、Co、Mn 的化合价分别为+2、+3、+4 当x=y= 时,z=
时,z=_______ 。

相关金属离子[c0(Mn+)=0.1mol∙L-1]形成氢氧化物沉淀的 pH范围如表:
| 金属离子 | Mn2+ | Fe2+ | Fe³⁺ | Al3⁺ | Mg2+ | Zn2+ | Ni2+ |
| 开始沉淀的 pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 | 6.9 |
| 沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 | 8.9 |
(1)“滤渣1”含有S和
(2)“氧化”中添加适量的MnO2的作用是将 Fe2+氧化为 Fe3+,写出该反应的离子方程式为
(3)调pH范围为4.7~6,滤渣2成分的化学式为
(4)“除杂1”的目的是除去Zn2+和 Ni2+,“滤渣3”的主要成分是
(5)“除杂2”的目的是生成MgF2沉淀除去Mg2+。若溶液酸度过高,Mg2+沉淀不完全,原因是
(6)写出“沉锰”的离子方程式
(7)层状镍钴锰三元材料可作为锂离子电池正极材料,其化学式为 LiNixCoyMnzO2,其中Ni、Co、Mn 的化合价分别为+2、+3、+4 当x=y=
 时,z=
时,z=
您最近一年使用:0次
解题方法
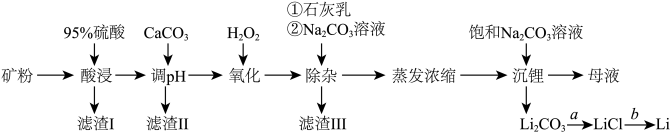
4 . 锂辉石是我国重要的锂资源之一,其主要成分为 Li2O、SiO2、Al2O3以及含有少量 Na+、Fe2+、Fe3+、Ca2+、Mg2+等金属离子。工业上用锂辉石制备金属锂的工艺流程如下:
已知:①部分阳离子以氢氧化物形式沉淀时溶液的 pH 见下表:
②常温下,Ksp(Li2CO3)= 2.0×10-3。Li2CO3在水中溶解度随着温度升高而减小。
③有水存在时,LiCl 受热可发生水解。
回答下列问题:
(1)为提高“酸浸”速率,上述流程中采取的措施有_____ 。
(2)滤渣 I 的主要成分是_____ 。滤渣 II 的主要成分是 Fe(OH)3、Al(OH)3。“氧化” 和“除杂”步骤主要除去的离子有_________ 。
(3) “沉锂”过程中发生反应的离子方程式是_____ 。用热水洗涤 Li2CO3固体,而不用冷水洗涤,其原因是_____ 。
(4)设计简单的实验方案实现由过程 a 制取固体 LiCl:_____ 。
(5)工业上实现过程 b 常用的方法是_____ 。
(6)Li 可用于制备重要还原剂四氢铝锂(LiAlH4)。在有机合成中,还原剂的还原能力常用“有效氢”表示,其含义为 1克还原剂相当于多少克 H2的还原能力。LiAlH4的“ 有效氢”为_____ (保留 2 位小数)。

已知:①部分阳离子以氢氧化物形式沉淀时溶液的 pH 见下表:
| 沉淀物 | Al(OH)3 | Fe(OH)2 | Fe(OH)3 | Ca(OH)2 | Mg(OH)2 |
| 完全沉淀的pH | 5.2 | 9.6 | 3.2 | 13.1 | 10.9 |
②常温下,Ksp(Li2CO3)= 2.0×10-3。Li2CO3在水中溶解度随着温度升高而减小。
③有水存在时,LiCl 受热可发生水解。
回答下列问题:
(1)为提高“酸浸”速率,上述流程中采取的措施有
(2)滤渣 I 的主要成分是
(3) “沉锂”过程中发生反应的离子方程式是
(4)设计简单的实验方案实现由过程 a 制取固体 LiCl:
(5)工业上实现过程 b 常用的方法是
(6)Li 可用于制备重要还原剂四氢铝锂(LiAlH4)。在有机合成中,还原剂的还原能力常用“有效氢”表示,其含义为 1克还原剂相当于多少克 H2的还原能力。LiAlH4的“ 有效氢”为
您最近一年使用:0次
5 . Ⅰ.(1)工业废水中常含有Cu2+等重金属离子,直接排放会造成污染,目前在工业废水处理过程中,依据沉淀转化的原理,常用FeS等难溶物质作为沉淀剂除去这些离子。已知室温下Ksp(FeS)=6.3×10-18,Ksp(CuS)=1.3×10-36。请用离子方程式说明上述除杂的原理__ 。
(2)在t℃时,某NaOH稀溶液中,c(H+)=10-amol/L,c(OH-)=10-bmol/L,已知a+b=12,则该温度下水的离子积常数KW=__ 。在该温度 下,将100mL0.1mol/L的稀硫酸与100mL0.4mol/L的NaOH溶液混合后,溶液的pH=___ 。
Ⅱ.工业生成尿素的原理是以NH3和CO2为原料合成尿素,反应的化学方程式为2NH3(g)+ CO2(g) CO(NH2)2(1)+H2O(1),该反应的平衡常数和温度关系如下:
CO(NH2)2(1)+H2O(1),该反应的平衡常数和温度关系如下:
(1)ΔH___ 0(填“>”、“<”或“=”)。
(2)在一定温度和压强下,若原料气中的NH3和CO2的物质的量之比(氨碳比)n(NH3)∶n(CO2)=x,如图是氨碳比(x)与CO2平衡转化率(α)的关系,α随着x增大而增大的原因是___ 。

(3)图中的B点对应的NH3的平衡转化率为__ 。
(2)在t℃时,某NaOH稀溶液中,c(H+)=10-amol/L,c(OH-)=10-bmol/L,已知a+b=12,则该温度下水的离子积常数KW=
Ⅱ.工业生成尿素的原理是以NH3和CO2为原料合成尿素,反应的化学方程式为2NH3(g)+ CO2(g)
 CO(NH2)2(1)+H2O(1),该反应的平衡常数和温度关系如下:
CO(NH2)2(1)+H2O(1),该反应的平衡常数和温度关系如下:| T/℃ | 165 | 175 | 185 | 195 |
| K | 111.9 | 74.1 | 50.6 | 34.8 |
(1)ΔH
(2)在一定温度和压强下,若原料气中的NH3和CO2的物质的量之比(氨碳比)n(NH3)∶n(CO2)=x,如图是氨碳比(x)与CO2平衡转化率(α)的关系,α随着x增大而增大的原因是

(3)图中的B点对应的NH3的平衡转化率为
您最近一年使用:0次



