名校
解题方法
1 . 碱式碳酸铜[Cu2(OH)2CO3]是一种用途广泛的化工原料。工业上可用电子工业中刻蚀线路板的酸性废液(主要成分有FeCl3、CuCl2、FeCl2)制备,其制备过程如下:
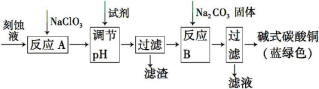
查阅资料知,通过调节溶液的酸碱性可使Cu2+,Fe2+,Fe3+生成沉淀的pH如下:
(1)氯酸钠的作用是______________________________________ 。
(2)调节反应A所得溶液的pH范围为_______________________ ,
可以选择的试剂是______ (填序号)。
a.氨水 b.硫酸铜 c.氢氧化铜 d.碱式碳酸铜
(3)反应B的温度要控制在60℃左右,且保持恒温,可采用的加热方法是________ ;若温度过高,所得蓝绿色沉淀中会有黑色固体出现,黑色固体可能是________ 。
(4)已知滤液中含有碳酸氢钠,写出生成碱式碳酸铜的离子方程式:______________________________________________ 。
(5)过滤得到的产品洗涤时,如何判断产品已经洗净____________________ 。

查阅资料知,通过调节溶液的酸碱性可使Cu2+,Fe2+,Fe3+生成沉淀的pH如下:
| 物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 4.7 | 7.5 | 1.4 |
| 沉淀完全pH | 6.7 | 14 | 3.7 |
(1)氯酸钠的作用是
(2)调节反应A所得溶液的pH范围为
可以选择的试剂是
a.氨水 b.硫酸铜 c.氢氧化铜 d.碱式碳酸铜
(3)反应B的温度要控制在60℃左右,且保持恒温,可采用的加热方法是
(4)已知滤液中含有碳酸氢钠,写出生成碱式碳酸铜的离子方程式:
(5)过滤得到的产品洗涤时,如何判断产品已经洗净
您最近一年使用:0次
2018-09-05更新
|
152次组卷
|
2卷引用:四川省成都市龙泉驿区第一中学2019届高三上学期入学考试化学试题
名校
解题方法
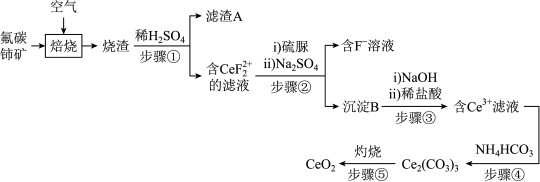
2 . 氧化铈(CeO2)是一种应用非常广泛的稀土氧化物。现以氟碳铈矿(含CeFCO3、BaO、SiO2等)为原料制备氧化铈,其工艺流程如图所示:
已知:①稀土离子易与 形成复盐沉淀,Ce3+和
形成复盐沉淀,Ce3+和 发生反应: Ce2(SO4)3+Na2SO4+nH2O=Ce2(SO4)3·Na2SO4·nH2O↓;
发生反应: Ce2(SO4)3+Na2SO4+nH2O=Ce2(SO4)3·Na2SO4·nH2O↓;
②硫脲: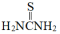 具有还原性,酸性条件下易被氧化为(SCN2H3)2;
具有还原性,酸性条件下易被氧化为(SCN2H3)2;
③Ce3+在空气中易被氧化为Ce4+,两者均能形成氢氧化物沉淀;
④Ce2(CO3)3为白色粉末,难溶于水。
回答下列问题:
(1)滤渣A的主要成分是___________ (填写化学式)。
(2)在另一种生产工艺中,在氟碳铈矿矿石粉中加入碳酸氢钠同时通入氧气焙烧,焙烧得到NaF和CeO2两种固体以及两种高温下的气态物质,请写出焙烧过程中相应的化学方程式___________ 。
(3)焙烧后加入稀硫酸浸出,为提高Ce的浸出率,需控制硫酸浓度不能太大的原因是___________ 。
(4)加入硫脲的目的是将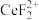 还原为Ce3+,反应的离子方程式为
还原为Ce3+,反应的离子方程式为___________ 。
(5)步骤③加入盐酸后,通常还需加入另一种化学试剂X,根据题中信息推测,加入X的作用为___________ 。
(6)下列关于步骤④的说法正确的是___________(填字母)。
(7)若常温下,Ka2(H2CO3)=5.0×10−11,Ksp[Ce2(CO3)3]=1.0×10−28,Ce3+恰好沉淀完全c(Ce3+)=1.0×10−5 mol∙L−1,此时测得溶液的pH=5,则溶液中c( )=
)=___________ mol∙L−1。
(8)取所得产品7.00g CeO2溶解后配成250mL溶液。取25.00mL该溶液用0.20 mol∙L−1硫酸亚铁铵[(NH4)2Fe(SO4)2]溶液滴定,滴定时发生反应Fe2++Ce4+=Fe3++Ce3+,达到滴定终点时消耗硫酸亚铁铵溶液18.50mL,则该产品的纯度为___________ 。(保留三位有效数字)。

已知:①稀土离子易与
 形成复盐沉淀,Ce3+和
形成复盐沉淀,Ce3+和 发生反应: Ce2(SO4)3+Na2SO4+nH2O=Ce2(SO4)3·Na2SO4·nH2O↓;
发生反应: Ce2(SO4)3+Na2SO4+nH2O=Ce2(SO4)3·Na2SO4·nH2O↓;②硫脲:
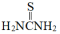 具有还原性,酸性条件下易被氧化为(SCN2H3)2;
具有还原性,酸性条件下易被氧化为(SCN2H3)2;③Ce3+在空气中易被氧化为Ce4+,两者均能形成氢氧化物沉淀;
④Ce2(CO3)3为白色粉末,难溶于水。
回答下列问题:
(1)滤渣A的主要成分是
(2)在另一种生产工艺中,在氟碳铈矿矿石粉中加入碳酸氢钠同时通入氧气焙烧,焙烧得到NaF和CeO2两种固体以及两种高温下的气态物质,请写出焙烧过程中相应的化学方程式
(3)焙烧后加入稀硫酸浸出,为提高Ce的浸出率,需控制硫酸浓度不能太大的原因是
(4)加入硫脲的目的是将
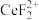 还原为Ce3+,反应的离子方程式为
还原为Ce3+,反应的离子方程式为(5)步骤③加入盐酸后,通常还需加入另一种化学试剂X,根据题中信息推测,加入X的作用为
(6)下列关于步骤④的说法正确的是___________(填字母)。
A.该步骤发生的反应是2Ce3++6 =Ce2(CO3)3↓+3CO2↑+3H2O =Ce2(CO3)3↓+3CO2↑+3H2O |
| B.可以用Na2CO3溶液代替NH4HCO3溶液,不影响产品纯度 |
| C.过滤时选择减压过滤能够大大提高过滤效率 |
| D.过滤后的滤液中仍含有较多Ce3+,需要将滤液循环以提高产率 |
 )=
)=(8)取所得产品7.00g CeO2溶解后配成250mL溶液。取25.00mL该溶液用0.20 mol∙L−1硫酸亚铁铵[(NH4)2Fe(SO4)2]溶液滴定,滴定时发生反应Fe2++Ce4+=Fe3++Ce3+,达到滴定终点时消耗硫酸亚铁铵溶液18.50mL,则该产品的纯度为
您最近一年使用:0次
2023-03-14更新
|
1130次组卷
|
2卷引用:四川省成都市第七中学2023届高三下学期二诊模拟考试理科综合化学试题
名校
解题方法
3 . 由下列实验操作及现象能得出相应结论的是
| 实验操作 | 现象 | 结论及解释 | |
| A | 向KBr、KI混合溶液中依次加入少量氯水和CCl4,振荡,静置 | 溶液分层,下层呈紫红色 | 氧化性:Cl2>Br2>I2 |
| B | 在火焰上灼烧搅拌过某无色溶液的玻璃棒 | 火焰出现黄色 | 溶液中含Na元素 |
| C | 用pH计测定pH:①NaHCO3溶液 ②CH3COONa溶液 | pH:①>②; | H2CO3酸性弱于CH3COOH |
| D | 向盛有少量Mg(OH)2沉淀的试管中 加入适量饱和NH4Cl溶液,振荡 | 白色沉淀溶解 |  结合OH-使Mg(OH)2沉淀溶解平衡向右移动 结合OH-使Mg(OH)2沉淀溶解平衡向右移动 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-06-21更新
|
290次组卷
|
4卷引用:四川省成都市新都区2022-2023学年高三上学期期末摸底测试理科综合化学试题
名校
解题方法
4 . 制备锂离子电池的正极材料的前体 的一种流程如下:
的一种流程如下:

资料:i.磷灰石的主要成分是
ii. 可溶于水,
可溶于水, 微溶于水
微溶于水
ii.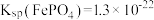
iv.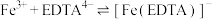
(1)制备
①用 溶液、
溶液、 溶液
溶液分步 浸取磷灰石生成HF、 和
和 ,主要反应是
,主要反应是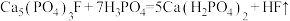 和
和_______ 。
②增大酸浸反应速率的措施有_______ (只写1条)。
③其他条件不变时,若仅用 溶液酸浸,浸取的速率低于用
溶液酸浸,浸取的速率低于用 、
、 分步浸取法,原因是
分步浸取法,原因是_______ 。
(2)制备
将 、
、 、
、 混合并调节溶液的pH制备
混合并调节溶液的pH制备 。
。
①酸性条件下,生成 的离子方程式是
的离子方程式是_______ 。
②含磷各微粒的物质的量分数与pH的关系如图。
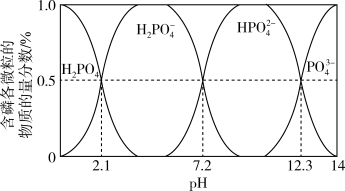
pH=1时,溶液中的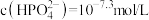 ,则
,则
_______  。再加入
。再加入 晶体、
晶体、 溶液使溶液中的
溶液使溶液中的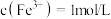 ,不考虑溶液体积的变化,通过计算说明此时能否产生
,不考虑溶液体积的变化,通过计算说明此时能否产生 沉淀
沉淀_______ 。
③ 的纯度及颗粒大小会影响其性能,沉淀速率过快容易团聚。
的纯度及颗粒大小会影响其性能,沉淀速率过快容易团聚。
ⅰ.研究表明,沉淀时可加入含 的溶液,
的溶液, 的作用是
的作用是_______ 。
ⅱ.其他条件不变时,工业上选择pH=2而不是更高的pH制备 ,可能的原因是
,可能的原因是_______ (答出2点)。
 的一种流程如下:
的一种流程如下:
资料:i.磷灰石的主要成分是

ii.
 可溶于水,
可溶于水, 微溶于水
微溶于水ii.
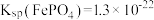
iv.
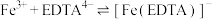
(1)制备

①用
 溶液、
溶液、 溶液
溶液 和
和 ,主要反应是
,主要反应是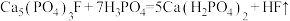 和
和②增大酸浸反应速率的措施有
③其他条件不变时,若仅用
 溶液酸浸,浸取的速率低于用
溶液酸浸,浸取的速率低于用 、
、 分步浸取法,原因是
分步浸取法,原因是(2)制备

将
 、
、 、
、 混合并调节溶液的pH制备
混合并调节溶液的pH制备 。
。①酸性条件下,生成
 的离子方程式是
的离子方程式是②含磷各微粒的物质的量分数与pH的关系如图。

pH=1时,溶液中的
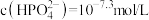 ,则
,则
 。再加入
。再加入 晶体、
晶体、 溶液使溶液中的
溶液使溶液中的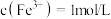 ,不考虑溶液体积的变化,通过计算说明此时能否产生
,不考虑溶液体积的变化,通过计算说明此时能否产生 沉淀
沉淀③
 的纯度及颗粒大小会影响其性能,沉淀速率过快容易团聚。
的纯度及颗粒大小会影响其性能,沉淀速率过快容易团聚。ⅰ.研究表明,沉淀时可加入含
 的溶液,
的溶液, 的作用是
的作用是ⅱ.其他条件不变时,工业上选择pH=2而不是更高的pH制备
 ,可能的原因是
,可能的原因是
您最近一年使用:0次
2022-04-10更新
|
922次组卷
|
7卷引用:四川省邻水实验学校2021-2022学年高二下学期第二次月考理综化学试题
四川省邻水实验学校2021-2022学年高二下学期第二次月考理综化学试题北京市西城区2022届高三一模化学试题(已下线)三轮冲刺卷2-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(北京专用)北京市第八中学2022-2023 学年高三上学期12 月月考化学试题北京市八一学校2022-2023学年高三上学期12月月考化学试题(已下线)北京市第四中学2023-2024学年高二上学期期中考试化学试题北京师范大学附属中学2023-2024学年高二上学期期末考试化学试卷
5 . 次磷酸钠(NaH2PO2)可用于化学镀银、镍、铬等,工业上以泥磷(主要含有P4和少量CaO、Fe2O3、Al2O3、CaCl2等)为原料制备NaH2PO2·H2O的流程如下图所示:
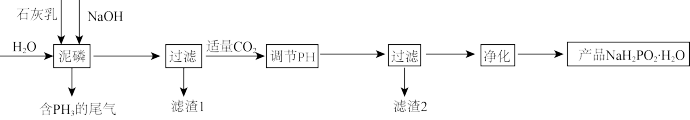
已知:(1)P4与碱反应生成相应的次磷酸盐和PH3;(2) 具有极强的还原性。
具有极强的还原性。
回答下列问题:
(1)已知次磷酸(H3PO2)为一元酸,则NaH2PO2是_______ (填“正盐”或“酸式盐”)。
(2)写出P4与NaOH溶液反应的化学方程式_______ 。
(3)尾气中的PH3可被NaClO氧化为NaH2PO2,氧化1mol PH3需要NaClO_______ g。
(4)滤渣1主要含有_______ ;通入CO2调节pH后会得到两种沉淀,分别是_______ ,写出生成其中一种沉淀的离子反应方程式_______ 。
(5)净化时加入Ag2SO4溶液等用以除去其中的Cl-,原理是_______ ,加入Ag2SO4过多会使产率降低,原因是_______ 。

已知:(1)P4与碱反应生成相应的次磷酸盐和PH3;(2)
 具有极强的还原性。
具有极强的还原性。回答下列问题:
(1)已知次磷酸(H3PO2)为一元酸,则NaH2PO2是
(2)写出P4与NaOH溶液反应的化学方程式
(3)尾气中的PH3可被NaClO氧化为NaH2PO2,氧化1mol PH3需要NaClO
(4)滤渣1主要含有
(5)净化时加入Ag2SO4溶液等用以除去其中的Cl-,原理是
您最近一年使用:0次
名校
解题方法
6 . 活性炭载钯(Pd/C)催化剂被广泛应用于医药和化工行业,某废钯催化剂(钯碳)的杂质主要含炭、有机物及少量Fe等。如图是利用钯碳制备氯化钯(PdCl2)和Pd的流程。

回答下列问题:
(1)“钯灰”中的主要成分有PdO,加入甲酸(HCOOH),可以将PdO还原成金属单质,请写出HCOOH还原PdO的化学方程式___________ 。
(2)“焚烧”的目的是____ ;实验室中可在___________ (填仪器名称)中模拟该过程。
(3)王水是将浓盐酸和浓硝酸混合而得到的强氧化性溶液,加热条件下钯在王水中发生反应生成H2[PdCl4]和一种有毒的无色气体A,该气体遇空气变红棕色,该反应中消耗的HCl与HNO3的物质的量之比为___________ 。
(4)加入浓氨水,调节溶液pH至9.0,并控制温度在70 ~75℃,Pd元素以 的形式存在:
的形式存在:
①若温度大于75℃,则不利于除铁,原因是___________
②已知:黄色晶体的成分为 ,在合并液中加盐酸时,发生反应的离子方程式为
,在合并液中加盐酸时,发生反应的离子方程式为___________ 。
(5)洗涤滤渣并将洗涤液与滤液合并,其意义是___________ 。
(6)Pd是优良的储氢金属,假设海绵状金属钯密度为,ρg·cm-3标准状况下其吸附的氢气是其体积的n倍,则此条件下海绵钯的储氢容量R=___________ mL·g-1(储氢容量R即1g钯吸附氢气的体积)。

回答下列问题:
(1)“钯灰”中的主要成分有PdO,加入甲酸(HCOOH),可以将PdO还原成金属单质,请写出HCOOH还原PdO的化学方程式
(2)“焚烧”的目的是
(3)王水是将浓盐酸和浓硝酸混合而得到的强氧化性溶液,加热条件下钯在王水中发生反应生成H2[PdCl4]和一种有毒的无色气体A,该气体遇空气变红棕色,该反应中消耗的HCl与HNO3的物质的量之比为
(4)加入浓氨水,调节溶液pH至9.0,并控制温度在70 ~75℃,Pd元素以
 的形式存在:
的形式存在:①若温度大于75℃,则不利于除铁,原因是
②已知:黄色晶体的成分为
 ,在合并液中加盐酸时,发生反应的离子方程式为
,在合并液中加盐酸时,发生反应的离子方程式为(5)洗涤滤渣并将洗涤液与滤液合并,其意义是
(6)Pd是优良的储氢金属,假设海绵状金属钯密度为,ρg·cm-3标准状况下其吸附的氢气是其体积的n倍,则此条件下海绵钯的储氢容量R=
您最近一年使用:0次
7 . 钒酸钇(YVO4)广泛应用于光纤通信领域,一种用废钒催化剂(含V2O3、K2O、SiO2、少量Fe2O3)制取YVO4的工艺流程如下:
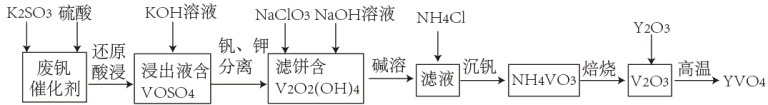
已知:V2O2(OH)4既能与强酸反应,又能与强碱反应。
25℃,浸取液中部分阳离子以氢氧化物形式沉淀时溶液的pH如下表所示:
回答下列问题:
(1)“还原酸浸”时,钒以VO2+浸出,“浸出液”中含有的金属离子是_______ 。V2O5被还原的离子方程式为_______ 。
(2)常温下,“钒、钾分离”时为了提高钒的沉淀率,应调节pH_______ 7(填“>”“<”或“=”)。
(3)结合“碱溶”和“沉钒”可知, 、
、 中
中_______ 的氧化性更强,“沉钒”时发生反应的化学方程式为_______ 。
(4)利用上述表格数据,计算Fe(OH)2的Ksp=_______ 。
(5)某工厂用该工艺流程生产YVO4,当用去1吨该废钒催化剂(V2O5的含量为26.0%)时,得到408kg,YVO4,则整个流程中V的损耗率为_______ 。

已知:V2O2(OH)4既能与强酸反应,又能与强碱反应。
25℃,浸取液中部分阳离子以氢氧化物形式沉淀时溶液的pH如下表所示:
| 阳离子 | VO2+ | Fe3+ | Fe2+ |
| 开始沉淀时(c=0.01mo/L)的pH | 3.0 | 2.2 | 7.5 |
| 沉淀完全时(c=1.0×10-5mol/L)的pH | 7.0 | 3.2 | 9.0 |
回答下列问题:
(1)“还原酸浸”时,钒以VO2+浸出,“浸出液”中含有的金属离子是
(2)常温下,“钒、钾分离”时为了提高钒的沉淀率,应调节pH
(3)结合“碱溶”和“沉钒”可知,
 、
、 中
中(4)利用上述表格数据,计算Fe(OH)2的Ksp=
(5)某工厂用该工艺流程生产YVO4,当用去1吨该废钒催化剂(V2O5的含量为26.0%)时,得到408kg,YVO4,则整个流程中V的损耗率为
您最近一年使用:0次
解题方法
8 . 三氧化二镍(Ni2O3)是重要的电子元件材料和蓄电池材料,工业上利用含镍废料(主要成分为镍、铝、氧化铁、碳等)提取Ni2O3,工艺流程如下:
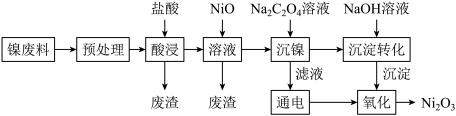
已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+。
②实际生产温度时的溶解度:NiC2O4>NiC2O4·H2O>NiC2O4·2H2O。
③相关金属离子生成氢氧化物沉淀的pH如下(开始沉淀的pH按金属离子的浓度为1mol·L-1计算):
(1)“预处理”操作选择用酒精清洗的目的是_______ 。
(2)“酸浸”时,①温度不宜过高,原因_______ 。
②常温下,盐酸的浓度为2.5mol·L-1,“液固比”与镍的浸出率的关系如图所示,实际生产采取的“液固比”为_______ ,主要的原因是_______ 。

(3)室温下,“浸出”所得溶液中Fe3+的浓度为0.2mol·L-1,当溶液的pH调到2时,c(Fe3+)=_______ 。加NiO调节pH的范围为_______ 。(已知:Ksp[Fe(OH)3]=4.0×10-38)
(4)加入Na2C2O4溶液“沉镍”得到的沉淀为_______ 。
(5)电解过程中产生的氯气在碱性条件下生成ClO-,再把二价镍氧化为三价镍,写出“氧化”反应的离子反应方程式_______ 。

已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+。
②实际生产温度时的溶解度:NiC2O4>NiC2O4·H2O>NiC2O4·2H2O。
③相关金属离子生成氢氧化物沉淀的pH如下(开始沉淀的pH按金属离子的浓度为1mol·L-1计算):
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Ni(OH)2 | Fe(OH)2 |
| 开始沉淀时pH | 1.8 | 3.0 | 7.1 | 5.8 |
| 完全沉淀时pH | 3.2 | 5.0 | 9.2 | 8.0 |
(2)“酸浸”时,①温度不宜过高,原因
②常温下,盐酸的浓度为2.5mol·L-1,“液固比”与镍的浸出率的关系如图所示,实际生产采取的“液固比”为

(3)室温下,“浸出”所得溶液中Fe3+的浓度为0.2mol·L-1,当溶液的pH调到2时,c(Fe3+)=
(4)加入Na2C2O4溶液“沉镍”得到的沉淀为
(5)电解过程中产生的氯气在碱性条件下生成ClO-,再把二价镍氧化为三价镍,写出“氧化”反应的离子反应方程式
您最近一年使用:0次
2021-06-10更新
|
940次组卷
|
3卷引用:四川省雅安市2021届高三下学期5月第三次诊断考试理综化学试题
名校
解题方法
9 . Zn是一种应用广泛的金属。用闪锌矿(主要成分为ZnS,还含有SiO2和少量FeS、CdS、PbS、砷化合物杂质等)为原料制备金属Zn和ZnSO4·7H2O的流程如图所示:
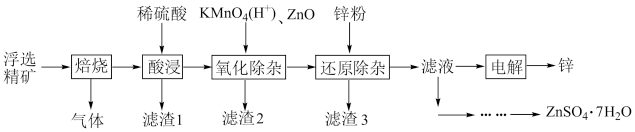
①相关金属离子[c(Mn+)=0.1 mol·L-1]形成氢氧化物沉淀的pH范围如下:
②FeAsO4难溶于水;ZnSO4·7H2O易溶于水,难溶于酒精。
回答下列问题:
(1)滤渣1的主要成分除SiO2外还有______ ,焙烧后产生的气体对环境造成的常见危害为______ 。
(2)氧化除杂工序中加入ZnO的作用是___________ 。
(3)制得的ZnSO4·7H2O需洗涤,洗涤晶体时应选用的试剂为____________ 。
(4)溶液中的Cd2+可用锌粉除去,还原除杂工序中反应的离子方程式为___________ 。不能省去“还原除杂”步骤,直接在“氧化除杂”步骤中除去Cd2+,理由是________ 。
(5)回收所得的Cd可用于制造镍镉碱性二次电池,电池工作时,正极NiO(OH)转化为Ni(OH)2,则充电时电池的阳极反应式为_____________ ;沉积锌后的电解液可返回______ 工序继续使用。
(6)酸浸液中砷元素以AsO 存在,在氧化除杂时加入酸性KMnO4溶液,KMnO4可与AsO33-发生反应生成FeAsO4,写出该反应的离子方程式为
存在,在氧化除杂时加入酸性KMnO4溶液,KMnO4可与AsO33-发生反应生成FeAsO4,写出该反应的离子方程式为___________ 。

①相关金属离子[c(Mn+)=0.1 mol·L-1]形成氢氧化物沉淀的pH范围如下:
| 金属离子 | Fe3+ | Fe2+ | Zn2+ | Cd2+ |
| 开始沉淀的pH | 1.5 | 6.3 | 6.2 | 7.4 |
| 沉淀完全的pH | 2.8 | 8.3 | 8.2 | 9.4 |
②FeAsO4难溶于水;ZnSO4·7H2O易溶于水,难溶于酒精。
回答下列问题:
(1)滤渣1的主要成分除SiO2外还有
(2)氧化除杂工序中加入ZnO的作用是
(3)制得的ZnSO4·7H2O需洗涤,洗涤晶体时应选用的试剂为
(4)溶液中的Cd2+可用锌粉除去,还原除杂工序中反应的离子方程式为
(5)回收所得的Cd可用于制造镍镉碱性二次电池,电池工作时,正极NiO(OH)转化为Ni(OH)2,则充电时电池的阳极反应式为
(6)酸浸液中砷元素以AsO
 存在,在氧化除杂时加入酸性KMnO4溶液,KMnO4可与AsO33-发生反应生成FeAsO4,写出该反应的离子方程式为
存在,在氧化除杂时加入酸性KMnO4溶液,KMnO4可与AsO33-发生反应生成FeAsO4,写出该反应的离子方程式为
您最近一年使用:0次
2020-02-10更新
|
765次组卷
|
3卷引用:2019年四川省内江市高三上学期第一次模拟考试化学试题
名校
解题方法
10 . 孔雀石主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物。某工厂以孔雀石为主要原料制备CuSO4·5H2O,主要步骤如下:
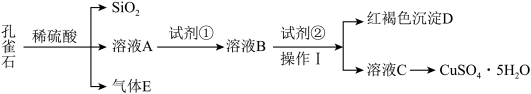
已知该条件下,通过调节溶液的酸碱性而使 Fe3+、Fe2+、Cu2+生成沉淀的 pH 分别如下:
请回答下列问题:
(1)为了提高孔雀石酸浸时的速率,除适当增加浓硫酸浓度外,还可以采取的措施有:___ (写一种)。
(2)试剂①是双氧水,把 Fe2+氧化成 Fe3+的目的是___ 。根据如图有关数据,你认为工业上氧化操作时应采取的条件是___ 。
(3)试剂②为CuO,其目的是调节溶液的 pH 保持在___ 范围。操作Ⅰ的名称是___ 。
(4)溶液 C 得到CuSO4·5H2O的主要步骤是___ 、___ 、过滤、洗涤、干燥。

已知该条件下,通过调节溶液的酸碱性而使 Fe3+、Fe2+、Cu2+生成沉淀的 pH 分别如下:
| 物质 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe(OH)3 | 2.2 | 3.2 |
| Fe(OH)2 | 7.6 | 9.6 |
| Cu(OH)2 | 4.7 | 6.4 |
(1)为了提高孔雀石酸浸时的速率,除适当增加浓硫酸浓度外,还可以采取的措施有:
(2)试剂①是双氧水,把 Fe2+氧化成 Fe3+的目的是

(3)试剂②为CuO,其目的是调节溶液的 pH 保持在
(4)溶液 C 得到CuSO4·5H2O的主要步骤是
您最近一年使用:0次
2019-03-20更新
|
176次组卷
|
2卷引用:四川省宜宾市叙州区第一中学校2019-2020学年高二下学期第一次在线月考化学试题



