名校
1 . 已知常温下水溶液中 、
、 、
、 、HB、
、HB、 的分布分数δ[如
的分布分数δ[如 ]随pH变化曲线如图1;溶液中
]随pH变化曲线如图1;溶液中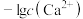 和
和 关系如图2.用
关系如图2.用
 溶液滴定20.00mL
溶液滴定20.00mL
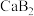 溶液,下列说法错误的是
溶液,下列说法错误的是

 、
、 、
、 、HB、
、HB、 的分布分数δ[如
的分布分数δ[如 ]随pH变化曲线如图1;溶液中
]随pH变化曲线如图1;溶液中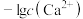 和
和 关系如图2.用
关系如图2.用
 溶液滴定20.00mL
溶液滴定20.00mL
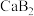 溶液,下列说法错误的是
溶液,下列说法错误的是
| A.曲线d表示δ(HB) |
B. 的水解平衡常数 的水解平衡常数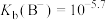 |
| C.滴定过程中溶液会变浑浊 |
D.滴定过程中始终存在: |
您最近一年使用:0次
2023-04-10更新
|
1860次组卷
|
12卷引用:四川省宜宾市叙州区第一中学校2023-2024学年高二上学期12月月考化学试题
四川省宜宾市叙州区第一中学校2023-2024学年高二上学期12月月考化学试题河北省石家庄市部分学校2023届高中毕业年级教学质量检测(二)(一模)化学试题河北省邢台市2022-2023学年高三下学期4月第一次模拟考试化学试题(已下线)专题15 水溶液中的离子平衡山东省东营市第一中学2023届高三下学期二模化学试题东北育才学校高中部2023届高三下学期适应性考试化学试题重庆市七校2023-2024学年高三上学期开学考试化学试题湖南省长郡中学2024届高三上学期月考卷(一)化学试题湖南省长沙市长郡中学2024届高三上学期9月月考化学试题江西省宜丰中学创新部2023-2024学年高二上学期第一次(10月)月考化学试题(已下线)化学(九省联考考后提升卷,河南卷)-2024年1月“九省联考”真题完全解读与考后提升(已下线)热点18 电解质溶液图像分析
2 . Ⅰ.(1)工业废水中常含有Cu2+等重金属离子,直接排放会造成污染,目前在工业废水处理过程中,依据沉淀转化的原理,常用FeS等难溶物质作为沉淀剂除去这些离子。已知室温下Ksp(FeS)=6.3×10-18,Ksp(CuS)=1.3×10-36。请用离子方程式说明上述除杂的原理__ 。
(2)在t℃时,某NaOH稀溶液中,c(H+)=10-amol/L,c(OH-)=10-bmol/L,已知a+b=12,则该温度下水的离子积常数KW=__ 。在该温度 下,将100mL0.1mol/L的稀硫酸与100mL0.4mol/L的NaOH溶液混合后,溶液的pH=___ 。
Ⅱ.工业生成尿素的原理是以NH3和CO2为原料合成尿素,反应的化学方程式为2NH3(g)+ CO2(g) CO(NH2)2(1)+H2O(1),该反应的平衡常数和温度关系如下:
CO(NH2)2(1)+H2O(1),该反应的平衡常数和温度关系如下:
(1)ΔH___ 0(填“>”、“<”或“=”)。
(2)在一定温度和压强下,若原料气中的NH3和CO2的物质的量之比(氨碳比)n(NH3)∶n(CO2)=x,如图是氨碳比(x)与CO2平衡转化率(α)的关系,α随着x增大而增大的原因是___ 。

(3)图中的B点对应的NH3的平衡转化率为__ 。
(2)在t℃时,某NaOH稀溶液中,c(H+)=10-amol/L,c(OH-)=10-bmol/L,已知a+b=12,则该温度下水的离子积常数KW=
Ⅱ.工业生成尿素的原理是以NH3和CO2为原料合成尿素,反应的化学方程式为2NH3(g)+ CO2(g)
 CO(NH2)2(1)+H2O(1),该反应的平衡常数和温度关系如下:
CO(NH2)2(1)+H2O(1),该反应的平衡常数和温度关系如下:| T/℃ | 165 | 175 | 185 | 195 |
| K | 111.9 | 74.1 | 50.6 | 34.8 |
(1)ΔH
(2)在一定温度和压强下,若原料气中的NH3和CO2的物质的量之比(氨碳比)n(NH3)∶n(CO2)=x,如图是氨碳比(x)与CO2平衡转化率(α)的关系,α随着x增大而增大的原因是

(3)图中的B点对应的NH3的平衡转化率为
您最近一年使用:0次



