解题方法
1 . 硫酸锰是一种重要的化工中间体。一种以高硫锰矿(主要成分为含锰化合物及FeS)与氧化锰矿(主要成分为 等锰的氧化物)为原料制备硫酸锰的工艺流程和金属离子在水溶液中沉淀的pH范围(25℃)如下:
等锰的氧化物)为原料制备硫酸锰的工艺流程和金属离子在水溶液中沉淀的pH范围(25℃)如下:

已知:①“混合焙烧”后烧渣含MnSO4、Fe2O3及少量FeO、Al2O3、MgO;②c(离子)≤10-5mol/L时,离子沉淀完全。
(1)“混合焙烧”时一般会将原料粉碎,这样做的主要目的是___________ 。
(2)若试剂a为MnO2,则氧化步骤发生反应的离子方程式为___________ ,若省略“氧化”步骤,造成的影响是___________ 。
(3)“中和除杂”时,应控制溶液的pH范围是___________ 。
(4)“氟化除杂”后,溶液中c(F-)浓度为0.04 ,则溶液中c(Mg2+)和c(Ca2+)的比值=
,则溶液中c(Mg2+)和c(Ca2+)的比值=______ 。[已知:Ksp(MgF2)=6.4×10-10;Ksp(CaF2)=3.6×10-12]。
 等锰的氧化物)为原料制备硫酸锰的工艺流程和金属离子在水溶液中沉淀的pH范围(25℃)如下:
等锰的氧化物)为原料制备硫酸锰的工艺流程和金属离子在水溶液中沉淀的pH范围(25℃)如下:
| 物质 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Al(OH)3 |
| 开始沉淀的pH | 1.9 | 7.6 | 7.3 | 3.0 |
| 完全沉淀的pH | 3.2 | 9.6 | 9.3 | 5.2 |
(1)“混合焙烧”时一般会将原料粉碎,这样做的主要目的是
(2)若试剂a为MnO2,则氧化步骤发生反应的离子方程式为
(3)“中和除杂”时,应控制溶液的pH范围是
(4)“氟化除杂”后,溶液中c(F-)浓度为0.04
 ,则溶液中c(Mg2+)和c(Ca2+)的比值=
,则溶液中c(Mg2+)和c(Ca2+)的比值=
您最近一年使用:0次
2 . 25℃时,金属离子初始浓度为 时,发生相应变化的pH如下表所示:
时,发生相应变化的pH如下表所示:
下列说法正确的是
 时,发生相应变化的pH如下表所示:
时,发生相应变化的pH如下表所示:| 开始沉淀 | 完全沉淀(离子浓度等于 ) ) | 开始溶解 | 完全溶解 | |
 | 7.0 | 9.0 | 13.5 | |
 | 1.9 | 3.2 | 14 | |
 | 6.3 | 8.0 | 10.5 | 12.6 |
A. 悬浊液中, 悬浊液中, |
B.加FeCl3可实现 向 向 有效转化 有效转化 |
C.若 初始浓度为 初始浓度为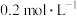 ,则 ,则 开始溶解的pH<10.5 开始溶解的pH<10.5 |
D.分离 、 、 :加碱至pH=13,搅拌后过滤,固体、滤液分别加酸至强酸性 :加碱至pH=13,搅拌后过滤,固体、滤液分别加酸至强酸性 |
您最近一年使用:0次
2023-06-29更新
|
237次组卷
|
4卷引用:山西省怀仁市第十一中学校2022-2023学年高二下学期7月期末化学试题
名校
解题方法
3 . 室温时,用 的标准
的标准 溶液滴定15.00mL浓度相等的
溶液滴定15.00mL浓度相等的 、
、 和
和 混合溶液,通过电位滴定法获得
混合溶液,通过电位滴定法获得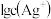 与
与 的关系曲线如图所示[忽略沉淀对离子的吸附作用。若溶液中离子浓度小于
的关系曲线如图所示[忽略沉淀对离子的吸附作用。若溶液中离子浓度小于 时,认为该离子沉淀完全。
时,认为该离子沉淀完全。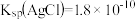 ,
,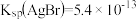 ,
,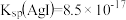 ]。下列说法错误的是
]。下列说法错误的是

 的标准
的标准 溶液滴定15.00mL浓度相等的
溶液滴定15.00mL浓度相等的 、
、 和
和 混合溶液,通过电位滴定法获得
混合溶液,通过电位滴定法获得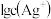 与
与 的关系曲线如图所示[忽略沉淀对离子的吸附作用。若溶液中离子浓度小于
的关系曲线如图所示[忽略沉淀对离子的吸附作用。若溶液中离子浓度小于 时,认为该离子沉淀完全。
时,认为该离子沉淀完全。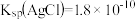 ,
,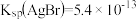 ,
,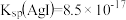 ]。下列说法错误的是
]。下列说法错误的是
| A.a点:有黄色沉淀生成 |
B.原溶液中 的浓度为 的浓度为 |
C.b点: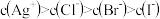 |
D.当 沉淀完全时,已经有部分 沉淀完全时,已经有部分 沉淀 沉淀 |
您最近一年使用:0次
4 . 以锌灰(含ZnO及少量PbO、CuO、Fe2O3、SiO2)和Fe2 (SO4)3为原料可以制备脱硫剂ZnFe2O4。该脱硫剂的制备硫化、再生过程可表示为
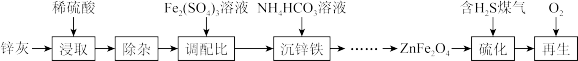
回答下列问题:
(1)“浸取”时为加快浸取速率,可以采取的措施有___________ (任写一条)。
(2)“除杂”包括加适量锌粉、过滤、加H2O2氧化等步骤。“加入H2O2氧化”的目的是___________ ,除Pb2+和Cu2+外,与锌粉反应的离子还有___________ (填离子符号)。
(3)“沉锌铁”时反应体系温度不能过高,可能的原因是___________ 。
(4)400 °C时,将一定比例H2、CO、CO2和H2S的混合气体以一定流速通过装有脱硫剂ZnFe2O4的硫化反应器。
①硫化过程中,ZnFe2O4与H2、H2S反应生成ZnS和FeS,其化学方程式为___________ 。
②硫化一段时间后,出口处检测到COS。研究表明ZnS参与了H2S与CO2生成COS的反应,但反应前后ZnS的质量不变, ZnS的作用是___________ ,生成COS的总反应化学方程式为___________ 。
(5)将硫化后的固体在V(N2) : V(O2) =95 : 5的混合气体中加热再生,固体质量随温度变化的曲线如图所示。在280~400 °C范围内,固体质量增加的主要原因可能是___________ 。


回答下列问题:
(1)“浸取”时为加快浸取速率,可以采取的措施有
(2)“除杂”包括加适量锌粉、过滤、加H2O2氧化等步骤。“加入H2O2氧化”的目的是
(3)“沉锌铁”时反应体系温度不能过高,可能的原因是
(4)400 °C时,将一定比例H2、CO、CO2和H2S的混合气体以一定流速通过装有脱硫剂ZnFe2O4的硫化反应器。
①硫化过程中,ZnFe2O4与H2、H2S反应生成ZnS和FeS,其化学方程式为
②硫化一段时间后,出口处检测到COS。研究表明ZnS参与了H2S与CO2生成COS的反应,但反应前后ZnS的质量不变, ZnS的作用是
(5)将硫化后的固体在V(N2) : V(O2) =95 : 5的混合气体中加热再生,固体质量随温度变化的曲线如图所示。在280~400 °C范围内,固体质量增加的主要原因可能是

您最近一年使用:0次
5 . 六氟锑酸钠( NaSbF6)广泛用于有机合成、光化学反应中的催化剂、蚀刻剂等。一种由锑矿粉(主要含Sb2O3、Fe2O3和少量Sb2O5、Sb2S3、CuS等)合成六氟锑酸钠的工艺流程如图所示:

请回答下列问题:
(1)“碱浸、还原”时,若Sb2O5与Na2S2O3反应计量关系为2:1,则氧化产物为_______ ,Sb2S3发生反应的离子方程式为_______
(2)“除杂”时,当溶液中出现蓝色沉淀,停止加入CuSO4溶液,若此时溶液中-lgc(S2- )与pH的关系如图。

已知Ksp[Cu(OH)2]=2.0×10-20,则Ksp(CuS) =_______
(3)“转化”时控温约50°C的原因_______ ;“转化”后,检验NaSbO3·3H2O是否洗涤干净应选用的试剂为_______ 。
(4)“氟化”反应的离子方程式为_______ 。
(5)“系列操作”为蒸发浓缩、冷却结晶、过滤、洗涤、干燥,则下列仪器中需使用的有_______ (填字母标号) ,不需使用的为_______ (填名称)。
A. B.
B. C.
C. D.
D. E.
E.

请回答下列问题:
(1)“碱浸、还原”时,若Sb2O5与Na2S2O3反应计量关系为2:1,则氧化产物为
(2)“除杂”时,当溶液中出现蓝色沉淀,停止加入CuSO4溶液,若此时溶液中-lgc(S2- )与pH的关系如图。

已知Ksp[Cu(OH)2]=2.0×10-20,则Ksp(CuS) =
(3)“转化”时控温约50°C的原因
(4)“氟化”反应的离子方程式为
(5)“系列操作”为蒸发浓缩、冷却结晶、过滤、洗涤、干燥,则下列仪器中需使用的有
A.
 B.
B. C.
C. D.
D. E.
E.
您最近一年使用:0次
名校
6 . 磁选后的炼铁高钛炉渣,主要成分有TiO2、SiO2、Al2O3、MgO、CaO以及少量的Fe2O3。为节约和充分利用资源,通过如下工艺流程回收钛、铝、镁等。“焙烧”中,TiO2、SiO2几乎不发生反应,MgO、CaO、Fe2O3转化为相应的硫酸盐,Al2O3转化为NH4A1(SO4)2。
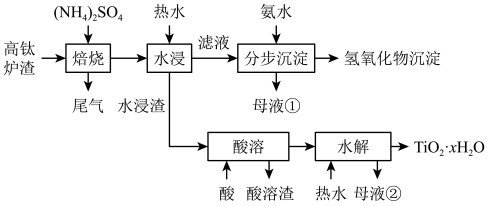
该工艺条件下,有关金属离子开始沉淀和沉淀完全的pH见下表
回答下列问题:
(1)“水浸”后“滤液”的pH约为2.0,在“分步沉淀”时用氨水逐步调节pH至11.6,依次析出的金属离子是___________ ,该“ 母液①”中Mg2+浓度为___________ mol·L-1。
(2)“酸溶”后,将溶液适当稀释并加热,TiO2+水解析出TiO2·xH2O沉淀,该反应的离子方程式是___________ ,将溶液稀 释的原因是___________ 。
(3)分离出的Mg(OH)2沉淀可经如下处理得到金属镁:
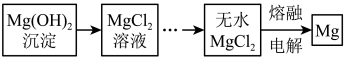
从MgCl2溶液中获取无水MgCl2通常需要通入HCl气体,HCl气体的作用是___________ ; 如果用惰性电极直接电解MgCl2溶液则得不到金属镁,电解MgCl2溶液的总反应方程式为:___________ 。
(4)用电解氧化法可以在铝制品表面形成致密、耐腐蚀的氧化膜,电解质溶液一般为H2SO4-H2C2O4混合溶液。阳极的电极反应式为___________ 。
(5)CaSO4是锅炉水垢的成分之一,试从沉淀溶解平衡的角度解释盐酸能溶解CaCO3而不能溶解CaSO4的原因___________ 。

该工艺条件下,有关金属离子开始沉淀和沉淀完全的pH见下表
| 金属离子 | Fe3+ | Al3+ | Mg2+ | Ca2+ |
| 开始沉淀的pH | 2.2 | 3.7 | 9.5 | 12.4 |
| 沉淀完全(c=1.0 ×10-5 mol ·L-1)的pH | 3.2 | 4.7 | 11.1 | 13.8 |
(1)“水浸”后“滤液”的pH约为2.0,在“分步沉淀”时用氨水逐步调节pH至11.6,依次析出的金属离子是
(2)“酸溶”后,将溶液适当稀释并加热,TiO2+水解析出TiO2·xH2O沉淀,该反应的离子方程式是
(3)分离出的Mg(OH)2沉淀可经如下处理得到金属镁:

从MgCl2溶液中获取无水MgCl2通常需要通入HCl气体,HCl气体的作用是
(4)用电解氧化法可以在铝制品表面形成致密、耐腐蚀的氧化膜,电解质溶液一般为H2SO4-H2C2O4混合溶液。阳极的电极反应式为
(5)CaSO4是锅炉水垢的成分之一,试从沉淀溶解平衡的角度解释盐酸能溶解CaCO3而不能溶解CaSO4的原因
您最近一年使用:0次
2022-01-24更新
|
225次组卷
|
2卷引用:山西省太原市2021-2022学年高二上学期期末考试化学试题
名校
解题方法
7 . 工业上常采用堆浸-反萃取-电积法从低品位锌矿(主要成分为ZnS,含有FeS2、CuS、NiS、SiO2等杂质)中获得锌,其流程如图1所示。
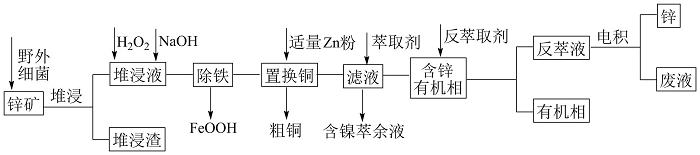
已知:①“堆浸”时金属硫化物均转化为硫酸盐;②pH过高时,氢氧化氧铁沉淀为胶状。
回答下列问题:
(1)“堆浸”时为了提高反应速率,可以采取的措施为___________ (填标号)。
a.大幅升温 b.将锌矿粉碎 c.将锌矿充分暴露
(2)“堆浸”时FeS2发生反应的化学方程式为___________ 。
(3)“除铁”时发生反应的总离子方程式为___________ 。“除铁”时,pH对不同金属离子沉淀率的影响如图2所示。“除铁”时最合理的pH约为___________ 。事实上Zn2+、Cu2+、Ni2+在pH≤6时难以沉淀,但是有铁离子存在时,pH升高,Zn2+、Cu2+、Ni2+的沉淀率均升高,原因可能为___________ 。

(4)“置换镍”时用锌粉直接置换速率极小,目前采用“锑盐净化法”置换,即置换时在酸性含Ni2+溶液中同时加入锌粉和Sb2O3,可得到合金NiSb,该反应的离子方程式为___________ 。已知Ni的熔点为1455℃,Sb的熔点为630.5℃,则该合金的熔点范围为___________ (填“高于1455℃”“在630.5℃和1455℃之间”或“低于630.5℃”)。
(5)电积时反萃取pH应控制在一定范围内,pH不能太高也不能太低,原因为___________ 。

已知:①“堆浸”时金属硫化物均转化为硫酸盐;②pH过高时,氢氧化氧铁沉淀为胶状。
回答下列问题:
(1)“堆浸”时为了提高反应速率,可以采取的措施为
a.大幅升温 b.将锌矿粉碎 c.将锌矿充分暴露
(2)“堆浸”时FeS2发生反应的化学方程式为
(3)“除铁”时发生反应的总离子方程式为

(4)“置换镍”时用锌粉直接置换速率极小,目前采用“锑盐净化法”置换,即置换时在酸性含Ni2+溶液中同时加入锌粉和Sb2O3,可得到合金NiSb,该反应的离子方程式为
(5)电积时反萃取pH应控制在一定范围内,pH不能太高也不能太低,原因为
您最近一年使用:0次
2021-11-12更新
|
222次组卷
|
2卷引用:山西省长治市第二中学2021-2022学年高三上学期第三次练考化学试题
8 . 海水中含有丰富的镁资源。某同学设计了从模拟海水中制备 的实验方案:
的实验方案:
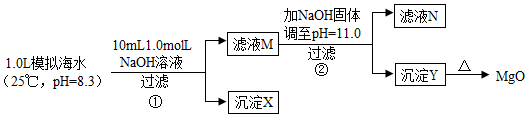
注:溶液中某种离子的浓度小于 ,可认为该离子不存在。
,可认为该离子不存在。
实验过程中,假设溶液体积不变。已知: ,
,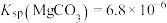 ,
,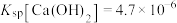 ,
,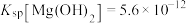 。
。
下列说法正确的是
 的实验方案:
的实验方案:
模拟海水中的离子浓度/( ) ) |  |  |  |  |  |
| 0.439 | 0.050 | 0.011 | 0.560 | 0.001 |
 ,可认为该离子不存在。
,可认为该离子不存在。实验过程中,假设溶液体积不变。已知:
 ,
,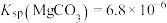 ,
,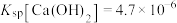 ,
,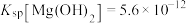 。
。下列说法正确的是
A.沉淀X为 |
B.滤液M中存在 ,不存在 ,不存在 |
C.滤液N中存在 和 和 |
D.步骤②中若改为加入 固体,沉淀Y为 固体,沉淀Y为 和 和 的混合物 的混合物 |
您最近一年使用:0次
2020-10-13更新
|
456次组卷
|
13卷引用:山西省晋中市平遥县和诚中学2020届高三上学期12月月考化学试题
山西省晋中市平遥县和诚中学2020届高三上学期12月月考化学试题(已下线)2012届湖北省天门中学高三上学期期中考试化学试卷(已下线)2013届新课标高三配套月考(四)化学试卷(B卷)陕西省西安市第一中学2015-2016学年高二上12月月考化学试卷天津市静海县第一中学2018届高三上学期期末检测化学试题【全国百强校】湖北省武汉市华中师范大学第一附属中学2018-2019学年高二上学期期末考试化学试题苏教版选修四化学反应原理专题3第四单元 难溶电解质的沉淀溶解平衡 同步检测试卷夯基提能2020届高三化学选择题对题专练——与量有关的离子方程式的书写(已下线)3.4+难溶电解质的溶解平衡-2020-2021学年高二化学同步课堂帮帮帮(人教版选修4)人教版(2019)高二化学选择性必修1第三章 水溶液中的离子反应与平衡 易错疑难集训(三)选择性必修1(SJ)专题3易错疑难集训(二)(已下线)3.4.2 沉淀溶解平衡的应用(素养提优B练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)(已下线)专题3 溶液中的离子反应 综合评价(1)-【上好课】2021-2022学年高二化学同步备课系列(苏教版2019选择性必修1)
11-12高二下·浙江温州·期末
名校
解题方法
9 . 为了除去氯化镁酸性溶液中的铁离子,可在加热搅拌的条件下加入一种试剂,过滤后,再向滤液中加入适量的盐酸,这种试剂是( )
| A.一水合氨 | B.烧碱 | C.碳酸镁 | D.碳酸钠 |
您最近一年使用:0次
2020-07-03更新
|
255次组卷
|
13卷引用:山西省稷山中学2021-2022学年高二上学期第二次月考化学试题
山西省稷山中学2021-2022学年高二上学期第二次月考化学试题(已下线)2011-2012学年浙江省温州市十校联合体高二下学期期末考试化学试卷(已下线)2012-2013学年江苏省宿迁市泗洪县洪翔中学高二下学期期中考化学卷(已下线)2012-2013学年四川省雅安市高二下学期期末检测化学试卷(已下线)2014届福建省福州市高三上学期期末质量检测化学试卷2015届福建省三明市一中高三上学期第二次月考化学试卷黑龙江省大庆第一中学2017-2018学年高二上学期期末(第四次月考)考试化学试题黑龙江省哈尔滨师范大学青冈实验中学校2018-2019学年高二上学期10月考试化学试题陕西省吴起高级中学2019-2020学年高二上学期期中考试化学(能力卷)试题2020届高三化学二轮冲刺新题专练——过滤(抽滤)、蒸发、结晶等除杂分离法北京市中国人民大学附属中学 2019-2020 学年度高二下学期期末练习化学试题(已下线)3.3.2 影响盐类水解的因素(重点练)-2020-2021学年高二化学十分钟同步课堂专练(苏教版选修4)云南省昆明师范专科学校附属中学2021-2022学年高二上学期期末考试化学试题
10 . 已知在25 ℃时,FeS、CuS的溶度积常数(Ksp)分别为6.3×10-18、1.3×10-36,常温时下列有关说法正确的是
| A.向H2S的饱和溶液中通入少量SO2气体,溶液的酸性增强 |
| B.将足量的CuSO4溶解在0.1 mol/L的H2S溶液中,溶液中Cu2+的最大浓度为1.3×10-35 mol/L |
| C.除去工业废水中的Cu2+可以选用FeS作沉淀剂 |
| D.因为H2SO4是强酸,所以反应CuSO4+H2S=CuS↓+H2SO4不能发生 |
您最近一年使用:0次
2019-12-18更新
|
268次组卷
|
10卷引用:2011-2012学年山西省大同一中高二上学期期中考试化学试卷
(已下线)2011-2012学年山西省大同一中高二上学期期中考试化学试卷2016-2017学年山西省怀仁一中高二上月考四化学卷(已下线)2011-2012学年辽宁省沈阳四校协作体高二上学期期中考试化学试卷2015-2016学年江西省上高二中高二上12月月考化学试卷2015-2016学年内蒙古赤峰市宁城县高二上学期期末考试化学试卷宁夏育才中学孔德校区2017-2018学年高二12月月考化学试题【全国百强校】河南省南阳市第一中学2018-2019学年高二下学期第四次月考化学试题湖南省邵东县第一中学2019-2020学年高二上学期第三次月考化学试题内蒙古北京八中乌兰察布分校2019-2020学年高二下学期期末考试化学试题吉林省抚松县第一中学2021-2022学年高二上学期第三次月考化学试题



