名校
解题方法
1 . 从铜氨废液含{[Cu(NH3)3·CO]+、[Cu(NH3)2]2+、[Cu(NH3)4]2+、NH3、CH3COO-、 等}中回收铜的工艺流程如图:
等}中回收铜的工艺流程如图:

回答下列问题:
(1)步骤(I)中被氧化的元素是_____ ,氧化剂是_______ 。
(2)步骤(III)“沉铜”时,利用Na2S溶液而不选用NaOH溶液“沉铜”的优点是________ 。
(3)步骤(IV)反应中还原剂与氧化剂的物质的量之比为_______ 。
(4)碱式氯化铜在400℃时能完全分解为CuO、H2O和HCl。为测定碱式氯化铜的组成进行如下实验:准确称取42.9g碱式氯化铜,加热到400℃使其完全分解,剩余固体32.0g,将生成的气体通过浓硫酸的洗气瓶,浓硫酸增重3.6g。碱式氯化铜的化学式为_________ 。
(5)“解吸”发生的与Cu(Ⅱ)相关的离子方程式为_______ 。
(6)向“调pH(Ⅵ)”后过滤的滤液滴加AlCl3溶液,可以观察到的现象为_______ 。
(7)CuSO4溶液经过________ 、过滤、洗涤、干燥得到CuSO4·5H2O。
 等}中回收铜的工艺流程如图:
等}中回收铜的工艺流程如图:
回答下列问题:
(1)步骤(I)中被氧化的元素是
(2)步骤(III)“沉铜”时,利用Na2S溶液而不选用NaOH溶液“沉铜”的优点是
(3)步骤(IV)反应中还原剂与氧化剂的物质的量之比为
(4)碱式氯化铜在400℃时能完全分解为CuO、H2O和HCl。为测定碱式氯化铜的组成进行如下实验:准确称取42.9g碱式氯化铜,加热到400℃使其完全分解,剩余固体32.0g,将生成的气体通过浓硫酸的洗气瓶,浓硫酸增重3.6g。碱式氯化铜的化学式为
(5)“解吸”发生的与Cu(Ⅱ)相关的离子方程式为
(6)向“调pH(Ⅵ)”后过滤的滤液滴加AlCl3溶液,可以观察到的现象为
(7)CuSO4溶液经过
您最近一年使用:0次
名校
2 . 草酸钴可用于指示剂和催化剂的制备。用水钴矿(主要成分为 ,含少量
,含少量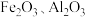 、
、 等)制取
等)制取 工艺流程如下:
工艺流程如下:

已知:①浸出液含有的阳离子主要有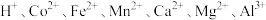 等;
等;
②部分阳离子以氢氧化物形式沉淀时溶液的 见表:
见表:
(1) 中
中 的化合价是
的化合价是_______ 。
(2)写出浸出过程中 与
与 发生反应的离子方程式:
发生反应的离子方程式:_______ 。
(3)浸出液中加入 的目的是
的目的是_______ 。
(4)加 能使浸出液中某些金属离子转化成氢氧化物沉淀,沉淀除
能使浸出液中某些金属离子转化成氢氧化物沉淀,沉淀除 外,还有的成分是
外,还有的成分是_______ (填化学式),试用离子方程式和必要的文字简述其原理:_______ 。
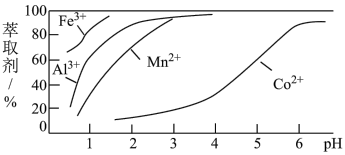
(5)萃取剂对金属离子的萃取率与 的关系如图,萃取剂的作用是
的关系如图,萃取剂的作用是_______ ;其使用的适宜 范围是
范围是_______ 。
A.接近2.0B.接近3.0C.接近5.0
(6)用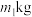 水钴矿(含
水钴矿(含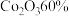 )制备
)制备 ,最终得到产品
,最终得到产品 ,产率(实际产量/理论产量
,产率(实际产量/理论产量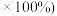 为
为_______ 。(已知: ,仅列数字计算式)。
,仅列数字计算式)。
 ,含少量
,含少量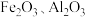 、
、 等)制取
等)制取 工艺流程如下:
工艺流程如下:
已知:①浸出液含有的阳离子主要有
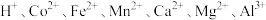 等;
等;②部分阳离子以氢氧化物形式沉淀时溶液的
 见表:
见表:| 沉淀物 |  |  |  |  |  |
完全沉淀的 | 3.7 | 5.2 | 9.2 | 9.6 | 9.8 |
(1)
 中
中 的化合价是
的化合价是(2)写出浸出过程中
 与
与 发生反应的离子方程式:
发生反应的离子方程式:(3)浸出液中加入
 的目的是
的目的是(4)加
 能使浸出液中某些金属离子转化成氢氧化物沉淀,沉淀除
能使浸出液中某些金属离子转化成氢氧化物沉淀,沉淀除 外,还有的成分是
外,还有的成分是(5)萃取剂对金属离子的萃取率与
 的关系如图,萃取剂的作用是
的关系如图,萃取剂的作用是 范围是
范围是
A.接近2.0B.接近3.0C.接近5.0
(6)用
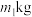 水钴矿(含
水钴矿(含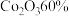 )制备
)制备 ,最终得到产品
,最终得到产品 ,产率(实际产量/理论产量
,产率(实际产量/理论产量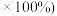 为
为 ,仅列数字计算式)。
,仅列数字计算式)。
您最近一年使用:0次
2023-12-02更新
|
126次组卷
|
2卷引用:宁夏回族自治区石嘴山市平罗中学2023-2024学年高三上学期第四次月考理科综合试题
解题方法
3 . 锂被誉为“金属味精”,以LiCoO2为正极材料的锂离子电池已被广泛用作便携式电源。工业上常以β-锂辉矿(主要成分为LiAlSi2O6,还含有FeO、MgO、CaO 等杂质)为原料来制取金属锂。其中一种工艺流程如下:

已知:①部分金属氢氧化物开始沉淀和完全沉淀时的pH:
②Li2CO3在不同温度下的溶解度如下表:
请回答下列问题:
(1)β-锂辉矿在处理前要粉碎,其主要目的是___________ ;用氧化物形式表示LiAlSi2O6的组成:___________ 。
(2)写出反应I中发生氧化还原反应的化学方程式:___________ 。
(3)调节pH=5的作用是除去___________ 。
(4)反应IV生成Li2CO3沉淀结束后,实验室中通常得到纯净的Li2CO3沉淀的操作名称蒸发浓缩,冷却结晶、___________ 、___________ 、干燥,为了提高所得Li2CO3沉淀的产率要使用___________ 洗涤(选填“热水”或“冷水”)。
(5)反应II加入碳酸钙,CaCO3是一种难溶物质,其Ksp=2.8×10-9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若混合前Na2CO3溶液的浓度为2.8 ×10—4mol/L,则生成沉淀所需原CaCl2溶液的最小浓度为___________ mol/L。

已知:①部分金属氢氧化物开始沉淀和完全沉淀时的pH:
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 3.7 | 9.6 |
| 完全沉淀pH | 3.7 | 4.7 | 11 |
| 温度/ °C | 0 | 10 | 20 | 50 | 75 | 100 |
| Li2CO3的溶解度/g | 1.539 | 1.406 | 1.329 | 1.181 | 0.866 | 0.728 |
(1)β-锂辉矿在处理前要粉碎,其主要目的是
(2)写出反应I中发生氧化还原反应的化学方程式:
(3)调节pH=5的作用是除去
(4)反应IV生成Li2CO3沉淀结束后,实验室中通常得到纯净的Li2CO3沉淀的操作名称蒸发浓缩,冷却结晶、
(5)反应II加入碳酸钙,CaCO3是一种难溶物质,其Ksp=2.8×10-9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若混合前Na2CO3溶液的浓度为2.8 ×10—4mol/L,则生成沉淀所需原CaCl2溶液的最小浓度为
您最近一年使用:0次
2022-05-17更新
|
1197次组卷
|
2卷引用:宁夏回族自治区中卫市2022届高三下学期第三次模拟考试理科综合化学试题
名校
解题方法
4 . 某矿石中含有硅、铁、铝的氧化物,为综合开发资源提高矿石的利用率,化工厂采取如图工艺制备铁红和AlCl3·6H2O。
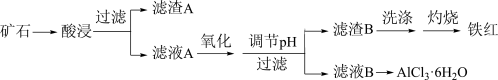
该工艺条件下,有关金属离子开始沉淀和完全沉淀的pH如表:
请回答下列问题:
(1)提高酸浸效率的措施_______ (答出一种即可),最适合选择_______ 进行酸浸。
(2)“氧化”步骤一般采用双氧水,且分多次添加的方式。其涉及的离子方程式:_______ ,分多次添加双氧水的目的是_______ 。
(3)调节pH的范围为_______ 。
(4)“洗涤”滤渣B的操作是_______ 。
(5)由AlCl3溶液制备AlCl3·6H2O的操作步骤为_______ ,蒸发浓缩、冷却结晶、_______ 、干燥。
(6)写出滤渣A与氢氟酸反应的化学反应方程式_______ 。
(7)若矿石m1kg,最后获得m2kgAlCl3·6H2O,则矿石中铝元素的含量为_______ ×100%。(用最简分数表示)

该工艺条件下,有关金属离子开始沉淀和完全沉淀的pH如表:
| 金属离子 | Fe3+ | Al3+ | Fe2+ |
| 开始沉淀的pH | 2.2 | 3.7 | 9.5 |
| 沉淀完全的pH(10—5mol/L) | 3.1 | 4.7 | 11.1 |
请回答下列问题:
(1)提高酸浸效率的措施
(2)“氧化”步骤一般采用双氧水,且分多次添加的方式。其涉及的离子方程式:
(3)调节pH的范围为
(4)“洗涤”滤渣B的操作是
(5)由AlCl3溶液制备AlCl3·6H2O的操作步骤为
(6)写出滤渣A与氢氟酸反应的化学反应方程式
(7)若矿石m1kg,最后获得m2kgAlCl3·6H2O,则矿石中铝元素的含量为
您最近一年使用:0次
5 . 已知在25 ℃时,FeS、CuS的溶度积常数(Ksp)分别为6.3×10-18、1.3×10-36,常温时下列有关说法正确的是
| A.向H2S的饱和溶液中通入少量SO2气体,溶液的酸性增强 |
| B.将足量的CuSO4溶解在0.1 mol/L的H2S溶液中,溶液中Cu2+的最大浓度为1.3×10-35 mol/L |
| C.除去工业废水中的Cu2+可以选用FeS作沉淀剂 |
| D.因为H2SO4是强酸,所以反应CuSO4+H2S=CuS↓+H2SO4不能发生 |
您最近一年使用:0次
2019-12-18更新
|
268次组卷
|
10卷引用:宁夏育才中学孔德校区2017-2018学年高二12月月考化学试题
宁夏育才中学孔德校区2017-2018学年高二12月月考化学试题(已下线)2011-2012学年辽宁省沈阳四校协作体高二上学期期中考试化学试卷(已下线)2011-2012学年山西省大同一中高二上学期期中考试化学试卷2015-2016学年江西省上高二中高二上12月月考化学试卷2015-2016学年内蒙古赤峰市宁城县高二上学期期末考试化学试卷2016-2017学年山西省怀仁一中高二上月考四化学卷【全国百强校】河南省南阳市第一中学2018-2019学年高二下学期第四次月考化学试题湖南省邵东县第一中学2019-2020学年高二上学期第三次月考化学试题内蒙古北京八中乌兰察布分校2019-2020学年高二下学期期末考试化学试题吉林省抚松县第一中学2021-2022学年高二上学期第三次月考化学试题
6 . 下列说法正确的是
| A.难溶电解质的溶度积越小,溶解度越大 | B.难溶电解质的溶解平衡是一种动态平衡 |
| C.可以通过沉淀反应使杂质离子完全沉淀 | D.一定浓度的NH4Cl溶液不能溶解Mg(OH)2 |
您最近一年使用:0次
名校
解题方法
7 . 某酸性废液含有H+、Fe3+、Ni2+、、NO3-、F-和Cr2O72-等。下图是该废液的综合利用工艺流程:(假设:F-与金属离子的综合反应不影响其他反应和计算)

已知:
① 金属离子开始沉淀和沉淀完全时的pH:
② Ni2+与足量氨水的反应为:Ni2++6NH3 [Ni(NH3)6]2+
[Ni(NH3)6]2+
(l)滤液1 的主要成分为:_________ 。
(2)请写出“转化”时NaHSO3与Cr2O72-发生反应的离子方程式_________ 。
(3)试剂X可以是足量氨水,还可以是:_________ 。
A.NaOH B. Ni(OH)2C. NiO D. Fe2O3
(4)写出Cr(OH)3在水中的电离方程式_________ 。
(5)已知[Ni(NH3)6]2+为难电离的络合离子,则“沉镍”的离子方程式为:_________ 。
(6)请写出Cr3+与酸性高锰酸钾发生反应的离子方程式_________ 。
(7)经检测,最后的残液中c(Ca2+)=1.0×10-5mol/L,则残液中F-浓度为______ mg/L,______ (填“符合”或“不符合”)排放标准[已知Ksp(CaF2)=4×l0-11,国家排放标准要求氟离子浓度小于10 mg/L]。

已知:
① 金属离子开始沉淀和沉淀完全时的pH:
| Fe3+ | Ni2+ | Cr3+ | |
| 开始沉淀 | 1.5 | 6.7 | 4.0 |
| 沉淀完全 | 3.4 | 9.5 | 6.9 |
 [Ni(NH3)6]2+
[Ni(NH3)6]2+(l)滤液1 的主要成分为:
(2)请写出“转化”时NaHSO3与Cr2O72-发生反应的离子方程式
(3)试剂X可以是足量氨水,还可以是:
A.NaOH B. Ni(OH)2C. NiO D. Fe2O3
(4)写出Cr(OH)3在水中的电离方程式
(5)已知[Ni(NH3)6]2+为难电离的络合离子,则“沉镍”的离子方程式为:
(6)请写出Cr3+与酸性高锰酸钾发生反应的离子方程式
(7)经检测,最后的残液中c(Ca2+)=1.0×10-5mol/L,则残液中F-浓度为
您最近一年使用:0次
解题方法
8 . 25℃时,电离常数Ka(HF)=3.6×10-4mol/L,溶度积Ksp(CaF2)=1.46×10-10,Ksp(AgCl)=4×10-10,Ksp(AgI)=1.0×10-16。下列说法正确的是
| A.AgCl不能转化为AgI |
| B.25℃时,0.1mol/L HF溶液pH=l |
| C.向1L0.1 mol/LHF溶液中加入1L 0.1 mol/LCaCl2溶液,没有沉淀产生 |
| D.25℃时,使AgCl转化为AgI,则加入KI溶液的浓度不低于5×10-12mol/L |
您最近一年使用:0次
2016-07-04更新
|
314次组卷
|
3卷引用:2016届宁夏石嘴山三中高三下二模理综化学试卷



