1 . 常温下,向 和
和 的混合液中滴加
的混合液中滴加 溶液,
溶液, 与
与 的关系如图所示。知:
的关系如图所示。知: 代表
代表 或
或 ;
; ;当被沉淀的离子的物质的量浓度小于
;当被沉淀的离子的物质的量浓度小于 时,认为该离子已沉淀完全。下列叙述错误的是
时,认为该离子已沉淀完全。下列叙述错误的是
 和
和 的混合液中滴加
的混合液中滴加 溶液,
溶液, 与
与 的关系如图所示。知:
的关系如图所示。知: 代表
代表 或
或 ;
; ;当被沉淀的离子的物质的量浓度小于
;当被沉淀的离子的物质的量浓度小于 时,认为该离子已沉淀完全。下列叙述错误的是
时,认为该离子已沉淀完全。下列叙述错误的是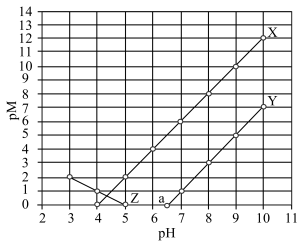
A.X、Z分别代表 与 与 的关系 的关系 |
B.常温下,弱酸 的电离常数 的电离常数 |
C.图中 点对应溶液的 点对应溶液的 为6.5,此时溶液中 为6.5,此时溶液中 |
D.向浓度均为 的 的 和 和 的混合溶液中逐滴加入 的混合溶液中逐滴加入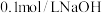 溶液,能通过沉淀的方式将两种离子分离 溶液,能通过沉淀的方式将两种离子分离 |
您最近一年使用:0次
名校
2 . 由软锰矿(主要成分是MnO2,还含有Al2O3、MgO、SiO2等杂质)制备高纯碳酸锰、硫酸锰的一种工艺流程如图所示。
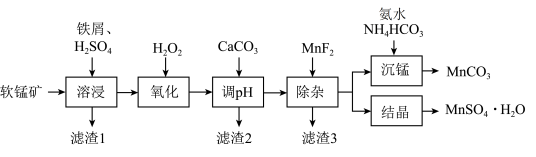
已知:①25℃时,Ksp(MnCO3)=1.8 10-11,Ksp(CaF2)=1.5
10-11,Ksp(CaF2)=1.5 10-10,Ksp(MgF2)=7.4
10-10,Ksp(MgF2)=7.4 10-11。
10-11。
②一定条件下,一些金属氢氧化物沉淀时的pH如表所示。
回答下列问题:
(1)除去铁屑表面油污,可采用的方法是___________ 。
(2)已知“溶浸”时,Fe不能还原MnO2,但Fe2+能还原MnO2得到Mn2+。Fe2+还原MnO2的离子方程式是___________ 。
(3)“氧化”时,过氧化氢的实际消耗量远大于理论消耗量,其原因可能是___________ 。
(4)用CaCO3 “调pH”虽然成本较低,但会引入Ca2+等杂质,若使用___________ (填化学式) “调pH”可避免此问题;调节pH步骤中,应控制的pH范围是___________ 。
(5)滤渣3的主要成分是___________ (填化学式)。
(6)“沉锰”时发生反应的离子方程式为___________ 。
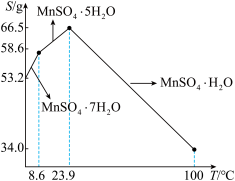
(7)硫酸锰在不同温度下的溶解度和该温度范围内析出晶体的组成如图所示。“结晶”是从“除杂”后过滤所得的滤液中获得MnSO4·H2O。其操作是___________ ,___________ ,洗涤,真空干燥。

已知:①25℃时,Ksp(MnCO3)=1.8
 10-11,Ksp(CaF2)=1.5
10-11,Ksp(CaF2)=1.5 10-10,Ksp(MgF2)=7.4
10-10,Ksp(MgF2)=7.4 10-11。
10-11。②一定条件下,一些金属氢氧化物沉淀时的pH如表所示。
| 金属氢氧化物 | Fe(OH)2 | Fe(OH)3 | Mn(OH)2 | Al(OH)3 |
| 开始沉淀的pH | 6.8 | 2.3 | 8.1 | 3.4 |
| 完全沉淀的pH | 8.3 | 3.2 | 10 | 4.7 |
(1)除去铁屑表面油污,可采用的方法是
(2)已知“溶浸”时,Fe不能还原MnO2,但Fe2+能还原MnO2得到Mn2+。Fe2+还原MnO2的离子方程式是
(3)“氧化”时,过氧化氢的实际消耗量远大于理论消耗量,其原因可能是
(4)用CaCO3 “调pH”虽然成本较低,但会引入Ca2+等杂质,若使用
(5)滤渣3的主要成分是
(6)“沉锰”时发生反应的离子方程式为
(7)硫酸锰在不同温度下的溶解度和该温度范围内析出晶体的组成如图所示。“结晶”是从“除杂”后过滤所得的滤液中获得MnSO4·H2O。其操作是

您最近一年使用:0次
2023-11-05更新
|
305次组卷
|
2卷引用:四川省成都市实验外国语学校2023-2024学年高三上学期10月检测理综化学试题
解题方法
3 . 碳酸锶是重要的无机化工产品。利用锶渣(主要成分SrSO4,含少量CaCO3、Fe2O3、Al2O3、MgCO3杂质)制备超细碳酸锶的工艺如图:
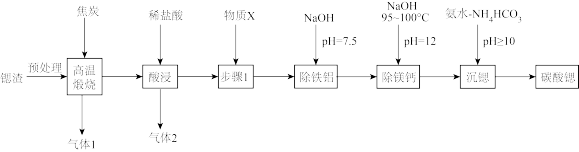
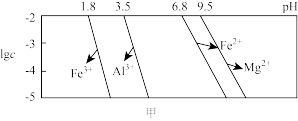
已知:25℃时溶液中金属离子物质的量浓度c与pH的关系如图甲所示:
回答下列问题:
(1)原料预处理的目的是加快煅烧反应速率,提高原料利用率。预处理方式可以是____ 。
(2)“高温煅烧”得到的主要产物为锶的硫化物和一种可燃性气体。则“高温煅烧”的主要反应化学方程式为____ 。
(3)气体2为____ 。步骤1的目的为____ ,不设置步骤1带来的后果是____ 。
(4)“除铁铝”过程维持温度在75℃的好处是____ 。“除铁铝”后溶液温度降至室温(25℃),溶液中c(Fe3+)为____ mol/L。(100.9=7.9)
(5)①写出“沉锶”的离子反应方程式:____ 。
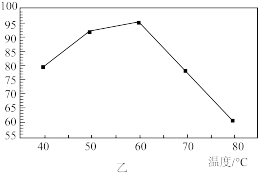
②反应温度对锶转化率的影响如图乙,温度高于60℃时,锶转化率降低的原因为____ 。

已知:25℃时溶液中金属离子物质的量浓度c与pH的关系如图甲所示:

回答下列问题:
(1)原料预处理的目的是加快煅烧反应速率,提高原料利用率。预处理方式可以是
(2)“高温煅烧”得到的主要产物为锶的硫化物和一种可燃性气体。则“高温煅烧”的主要反应化学方程式为
(3)气体2为
(4)“除铁铝”过程维持温度在75℃的好处是
(5)①写出“沉锶”的离子反应方程式:
②反应温度对锶转化率的影响如图乙,温度高于60℃时,锶转化率降低的原因为

您最近一年使用:0次
名校
解题方法
4 . 钼(Mo)是重要的过渡金属元素,具有广泛用途。由钼精矿(主要成分是MoS2)湿法回收钼酸铵[(NH4)2MoO4]部分工艺流程如下:

(1)“氧化焙烧”时通常采用粉碎矿石、逆流焙烧或增大空气量等措施,除了增大氧化焙烧速率,其作用还有_______ 。MoS2焙烧时得到+6价钼的氧化物,焙烧时的化学方程式为_______ 。
(2)向“滤液1”中加入硝酸,调节pH为5~7,加热到65~70℃过滤除硅。则滤渣2的成分为_______ 。
(3)为了提高原料的利用率,工艺流程中“滤渣1”应循环到_______ 操作。
(4)向“滤液2”先加入有机溶剂“萃取”,再加氨水“反萃取”,进行“萃取”和“反萃取”操作的目的是_______ 。
(5)“酸沉”中析出钼酸铵晶体时,加入HNO3调节pH为1.5~3,其原因是_______ 。
(6)Na2MoO4·2H2O是一种无公害型冷却水系统的金属缓蚀剂,常用钼酸铵和氢氧化钠反应来制取。写出制备Na2MoO4·2H2O的化学方程式_______ 。

(1)“氧化焙烧”时通常采用粉碎矿石、逆流焙烧或增大空气量等措施,除了增大氧化焙烧速率,其作用还有
(2)向“滤液1”中加入硝酸,调节pH为5~7,加热到65~70℃过滤除硅。则滤渣2的成分为
(3)为了提高原料的利用率,工艺流程中“滤渣1”应循环到
(4)向“滤液2”先加入有机溶剂“萃取”,再加氨水“反萃取”,进行“萃取”和“反萃取”操作的目的是
(5)“酸沉”中析出钼酸铵晶体时,加入HNO3调节pH为1.5~3,其原因是
(6)Na2MoO4·2H2O是一种无公害型冷却水系统的金属缓蚀剂,常用钼酸铵和氢氧化钠反应来制取。写出制备Na2MoO4·2H2O的化学方程式
您最近一年使用:0次
名校
解题方法
5 . 活性炭载钯(Pd/C)催化剂被广泛应用于医药和化工行业,某废钯催化剂(钯碳)的杂质主要含炭、有机物及少量Fe等。如图是利用钯碳制备氯化钯(PdCl2)和Pd的流程。

回答下列问题:
(1)“钯灰”中的主要成分有PdO,加入甲酸(HCOOH),可以将PdO还原成金属单质,请写出HCOOH还原PdO的化学方程式___________ 。
(2)“焚烧”的目的是____ ;实验室中可在___________ (填仪器名称)中模拟该过程。
(3)王水是将浓盐酸和浓硝酸混合而得到的强氧化性溶液,加热条件下钯在王水中发生反应生成H2[PdCl4]和一种有毒的无色气体A,该气体遇空气变红棕色,该反应中消耗的HCl与HNO3的物质的量之比为___________ 。
(4)加入浓氨水,调节溶液pH至9.0,并控制温度在70 ~75℃,Pd元素以 的形式存在:
的形式存在:
①若温度大于75℃,则不利于除铁,原因是___________
②已知:黄色晶体的成分为 ,在合并液中加盐酸时,发生反应的离子方程式为
,在合并液中加盐酸时,发生反应的离子方程式为___________ 。
(5)洗涤滤渣并将洗涤液与滤液合并,其意义是___________ 。
(6)Pd是优良的储氢金属,假设海绵状金属钯密度为,ρg·cm-3标准状况下其吸附的氢气是其体积的n倍,则此条件下海绵钯的储氢容量R=___________ mL·g-1(储氢容量R即1g钯吸附氢气的体积)。

回答下列问题:
(1)“钯灰”中的主要成分有PdO,加入甲酸(HCOOH),可以将PdO还原成金属单质,请写出HCOOH还原PdO的化学方程式
(2)“焚烧”的目的是
(3)王水是将浓盐酸和浓硝酸混合而得到的强氧化性溶液,加热条件下钯在王水中发生反应生成H2[PdCl4]和一种有毒的无色气体A,该气体遇空气变红棕色,该反应中消耗的HCl与HNO3的物质的量之比为
(4)加入浓氨水,调节溶液pH至9.0,并控制温度在70 ~75℃,Pd元素以
 的形式存在:
的形式存在:①若温度大于75℃,则不利于除铁,原因是
②已知:黄色晶体的成分为
 ,在合并液中加盐酸时,发生反应的离子方程式为
,在合并液中加盐酸时,发生反应的离子方程式为(5)洗涤滤渣并将洗涤液与滤液合并,其意义是
(6)Pd是优良的储氢金属,假设海绵状金属钯密度为,ρg·cm-3标准状况下其吸附的氢气是其体积的n倍,则此条件下海绵钯的储氢容量R=
您最近一年使用:0次
6 . 25℃时, ,
, 。已知
。已知 沉呈显砖红色。下列说法正确的是
沉呈显砖红色。下列说法正确的是
 ,
, 。已知
。已知 沉呈显砖红色。下列说法正确的是
沉呈显砖红色。下列说法正确的是A.向含大量 和 和 的悬浊液中加入少量水, 的悬浊液中加入少量水,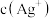 减小 减小 |
B.向同浓度 和 和 的混合溶液中缓慢滴加 的混合溶液中缓慢滴加 溶液, 溶液, 先析出 先析出 |
C.向 悬浊液中滴入饱和 悬浊液中滴入饱和 溶液,白色沉淀刚出现时,溶液中 溶液,白色沉淀刚出现时,溶液中 |
D.用 标准溶液滴定 标准溶液滴定 溶液时,可用 溶液时,可用 溶液作指示剂 溶液作指示剂 |
您最近一年使用:0次
2021-01-28更新
|
970次组卷
|
7卷引用:四川省成都市2020-2021学年高二上学期期末调考化学试题
四川省成都市2020-2021学年高二上学期期末调考化学试题(已下线)解密10 水溶液中离子反应(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)解密10 水溶液中离子反应(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)考点26 难溶电解质的溶解平衡-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)课时45 难溶电解质的溶解平衡-2022年高考化学一轮复习小题多维练(全国通用)(已下线)考点29 沉淀溶解平衡-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)2023年1月浙江省普通高校招生选考变式题(选择题11-16)
解题方法
7 . 酸性锌锰干电池是一种一次性电池,外壳为金属锌,中间是碳棒,其周围是由碳粉、MnO2、ZnCl2和NH4Cl等组成的糊状填充物。该电池放电过程产生MnOOH。回收处理该废电池可得到多种化工原料。有关数据如下表所示:
物质的溶解度/(g/100 g水)
物质的溶度积(Ksp)
回答下列问题:
(1)该电池的正极反应式为______ ,电池反应的离子方程式为________ 。
(2)维持电流强度为0.5 A,电池工作5分钟,理论上消耗锌_______ g。(已知F=96 500 C·mol-1)
(3)废电池糊状填充物加水处理后,过滤,滤液中主要有ZnCl2和NH4Cl,二者可通过_____ 分离回收;滤渣的主要成分是MnO2、_____ 和_____ ,欲从中得到较纯的MnO2,最简便的方法为_____ ,其原理是______ 。
(4)用废电池的锌皮制备ZnSO4·7H2O的过程中,需除去锌皮中的少量杂质铁,其方法是加稀H2SO4和H2O2溶解,铁变为_____ ,加碱调节至pH为____ 时,铁刚好沉淀完全(离子浓度小于1×10-5mol·L-1时,即可认为该离子沉淀完全);继续加碱至pH为_____ 时,锌开始沉淀(假定Zn2+浓度为0.1 mol·L-1)。若上述过程不加H2O2后果是_____ ,原因是_____ 。
物质的溶解度/(g/100 g水)
温度/ ℃ 化合物 | 0 | 20 | 40 | 60 | 80 | 100 |
NH4Cl | 29.3 | 37.2 | 45.8 | 55.3 | 65.6 | 77.3 |
ZnCl2 | 343 | 395 | 452 | 488 | 541 | 614 |
物质的溶度积(Ksp)
| 化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
| Ksp近似值 | 10-17 | 10-17 | 10-39 |
回答下列问题:
(1)该电池的正极反应式为
(2)维持电流强度为0.5 A,电池工作5分钟,理论上消耗锌
(3)废电池糊状填充物加水处理后,过滤,滤液中主要有ZnCl2和NH4Cl,二者可通过
(4)用废电池的锌皮制备ZnSO4·7H2O的过程中,需除去锌皮中的少量杂质铁,其方法是加稀H2SO4和H2O2溶解,铁变为
您最近一年使用:0次
解题方法
8 . 以某含镍废料(主要成分为NiO,还含有少量FeO、Fe2O3、CoO、SiO2)为原料制备NixOy和碳酸钴的工艺流程如下:
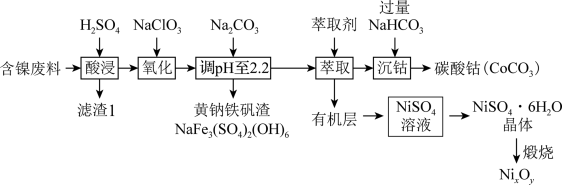
(1)“酸溶”时需将含镍废料粉碎,目的是_________________________________ ;“滤渣Ⅰ”主要成分为____________________ (填化学式)。
(2)“氧化”中添加NaClO3的作用是_______________________ ,为证明添加NaClO3已足量,可用_______________ (写化学式)溶液进行检验。
(3)“调pH”过程中生成黄钠铁钒沉淀,其离子方程式为__________________ 。
(4)“沉钴”过程的离子方程式________________________ 。若“沉钴”开始时c(Co2+)=0.10 mol/L,则控制pH≤_____________ 时不会产生Co(OH)2沉淀。(已知Ksp[Co(OH)2]=4.0×10-15,lg2=0.3)
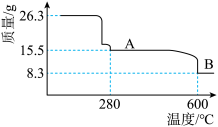
(5)从NiSO4溶液获得NiSO4·6H2O晶体的操作依次是:加热浓缩溶液至有晶膜出现,______________ ,过滤,洗涤,干燥。“煅烧”时剩余固体质量与温度变化曲线如图,该曲线中B段所表示氧化物的化学式为__________________ 。

(1)“酸溶”时需将含镍废料粉碎,目的是
(2)“氧化”中添加NaClO3的作用是
(3)“调pH”过程中生成黄钠铁钒沉淀,其离子方程式为
(4)“沉钴”过程的离子方程式
(5)从NiSO4溶液获得NiSO4·6H2O晶体的操作依次是:加热浓缩溶液至有晶膜出现,

您最近一年使用:0次
2019-12-28更新
|
1038次组卷
|
4卷引用:四川省成都市2020届高三第一次诊断性检测理综化学试题
四川省成都市2020届高三第一次诊断性检测理综化学试题2019年四川省成都市高三第一次诊断考试化学试题2020届高三《新题速递·化学》1月第02期(考点11-13)(已下线)03 无机化工流程题(3) (解析)-备战2023年高考化学大题逐空突破系列(全国通用)
9 . 已知298K时,Fe(OH)2和Cu(OH)2的饱和溶液中,金属阳离子[-lgc(M2+)]与溶液pH的变化关系如a、b所示,已知:该温度下Ksp[Cu(OH)2]<Ksp[Fe(OH)2]下列说法中正确的是
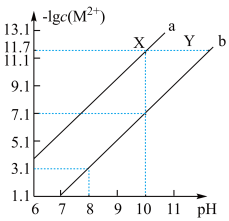

| A.a线表示Fe(OH)2饱和溶液中的变化关系 |
| B.当Fe(OH)2和Cu(OH)2沉淀共存时,溶液中c(Fe2+):c(Cu2+)=104.6:1 |
| C.除去CuSO4溶液中少量的Fe2+,可加入适量CuO |
| D.向X点对应的饱和溶液中加入少量NaOH,可转化为Y点对应的溶液 |
您最近一年使用:0次
2019-03-16更新
|
1109次组卷
|
2卷引用:【全国百强校】四川省成都七中2019届高三下学期二诊模拟考试化学试题
名校
解题方法
10 . 一定温度下,用Na2S沉淀Cu2+、Mn2+、Fe2+、Zn2+四种金属离子(M2+),形成沉淀所需S2-最低浓度的对数值lgc(S2-)与lgc(M2+)关系如图所示。下列说法不正确的是
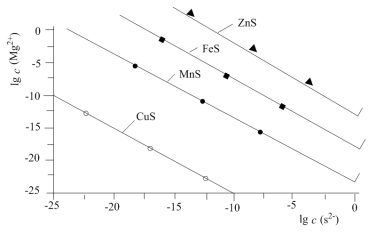

| A.若向沉淀剂Na2S溶液通入HCl气体至中性,存在关系: c(HS-)+2c(H2S)=c(Cl-) |
| B.该温度下,Ksp(MnS)大于1.0×10-35 |
| C.若将MnS、FeS的饱和溶液等体积混合,再加入足量的浓 Na2S溶液,发生的反应为MnS沉淀少于FeS |
| D.向l00mL浓度均为10-5mol·L-1Zn2+、Fe2+、Mn2+的混合溶液中逐滴加入10-4mol·L-1Na2S溶液,ZnS先沉淀 |
您最近一年使用:0次
2019-01-19更新
|
478次组卷
|
2卷引用:【全国百强校】四川省成都市第七中学2019届高三上学期11月份检测化学试题



