解题方法
1 . 硝酸铜晶体[Cu(NO3)2•6H2O],是一种重要的化工原料,常用于农药、镀铜、搪瓷等工业。以辉铜矿(主要成分为Cu2S,含少量Fe2O3,、SiO2等杂质)为原料制备硝酸铜晶体的某工艺如图所示:

回答下列问题:
(1)“浸取”时,为了提高浸取率可采取的措施有____ (任写一点),浸取时在生成S的反应中还原剂与氧化剂的物质的量之比为____ 。
(2)滤渣2的主要成分是____ ,滤渣2与稀硝酸反应时,需向装置内通入适量空气,这样做的目的是____ 。
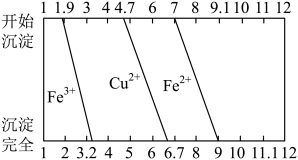
(3)调节溶液pH时选用的物质a可以是_____ ,几种金属离子沉淀的pH范围如图所示,“调pH”时应将溶液pH调至____ 。
(4)操作X主要包括____ 、____ 、过滤、洗涤、干燥。
(5)用碱性锌锰干电池为电源电解硝酸铜溶液可制得铜单质。请写出电解过程中阳极的电极反应式____ 。

回答下列问题:
(1)“浸取”时,为了提高浸取率可采取的措施有
(2)滤渣2的主要成分是
(3)调节溶液pH时选用的物质a可以是

(4)操作X主要包括
(5)用碱性锌锰干电池为电源电解硝酸铜溶液可制得铜单质。请写出电解过程中阳极的电极反应式
您最近半年使用:0次
名校
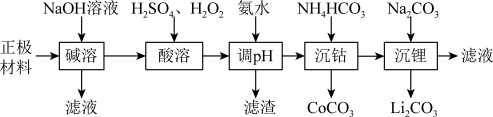
2 . 锂被誉为“高能金属”,废旧锂离子电池的正极材料主要含有LiCoO2及少量Al、Fe等,处理该废料的一种工艺流程如图所示:
已知:①LiCoO2难溶于水:
②相关金属离子形成氢氧化物沉淀的pH值如下表所示:
③碳酸锂的溶解度(S)如下表所示:
回答下列问题:
(1)写出“碱溶”时发生主要反应的离子方程式:_______ 。
(2)为提高“酸溶”的浸出速率,可采取的措施有_______ (任写一种)。
(3)“酸溶”时,LiCoO2发生的主要反应的离子方程式为_______ ;若用浓盐酸代替H2SO4和H2O2的混合液,缺点是_______ 。
(4)用氨水调节pH的范围为_______ 。
(5)沉锂过程的操作方法:加入略过量的碳酸钠后,搅拌、_______ 、_______ 、洗涤、干燥。

已知:①LiCoO2难溶于水:
②相关金属离子形成氢氧化物沉淀的pH值如下表所示:
| Al3+ | Fe3+ | Fe2+ | Co2+ | |
| 开始沉淀的pH | 4.0 | 2.7 | 7.6 | 7.0 |
| 沉淀完全的pH | 5.2 | 3.7 | 9.6 | 9.0 |
③碳酸锂的溶解度(S)如下表所示:
| T℃ | 20 | 80 | 100 |
| S(Li2CO3)/g | 1.33 | 0.85 | 0.72 |
回答下列问题:
(1)写出“碱溶”时发生主要反应的离子方程式:
(2)为提高“酸溶”的浸出速率,可采取的措施有
(3)“酸溶”时,LiCoO2发生的主要反应的离子方程式为
(4)用氨水调节pH的范围为
(5)沉锂过程的操作方法:加入略过量的碳酸钠后,搅拌、
您最近半年使用:0次
2022-02-16更新
|
123次组卷
|
2卷引用:四川省江油中学2021届高三上学期入学考试理综化学试题
名校
解题方法
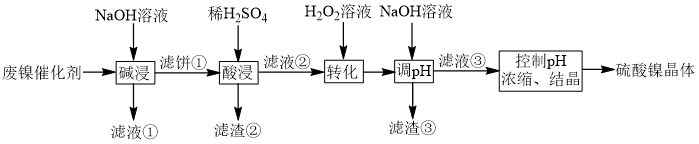
3 . 镍催化剂的主要成分为Ni,还含有一定量Al、Fe及氧化铁、少量其他不溶性物质,回收废镍催化剂制备硫酸镍晶体(NiSO4·7H2O)的工艺流程如下:
已知:溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
回答下列问题:
(1)提高“碱浸”速率的措施是_____ (任写一点即可)。
(2)“碱浸”发生反应的离子方程式是___________ 。 “滤液②”可能含有的金属离子是_____ 。
(3)“转化”步骤中加入H2O2 的目的是_____ ,反应的离子方程式是_____ 。
(4)“调pH”时, 最适宜的pH范围是_____ 。
(5)“控制pH浓缩结晶”步骤后得到硫酸镍晶体的操作是:_____ 。

已知:溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
| 金属离子 | Fe3+ | Fe2+ | Ni2+ |
| 开始沉淀的pH(c= 0.01mol·L-1) | 2.2 | 7.5 | 7.2 |
| 沉淀完全的pH(c=1.0×10-5mol·L-1) | 3.2 | 9.0 | 8.7 |
回答下列问题:
(1)提高“碱浸”速率的措施是
(2)“碱浸”发生反应的离子方程式是
(3)“转化”步骤中加入H2O2 的目的是
(4)“调pH”时, 最适宜的pH范围是
(5)“控制pH浓缩结晶”步骤后得到硫酸镍晶体的操作是:
您最近半年使用:0次
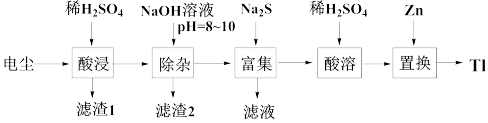
4 . 铊(Tl)在工业中的用途非常广泛。从某铅锌厂的电尘(主要成分为PbO、ZnO,还含有少量Fe2O3、Tl2O)中回收铊的工艺流程如图。
已知:①Zn(OH)2为两性氢氧化物,溶液pH>10开始溶解。
②相关物质开始沉淀和沉淀完全时的pH如表所示:
(1)为提高“酸浸”效率,可采取的措施有___ (写出两种)。
(2)“滤渣1”的主要成分是__ (填化学式),由于沉淀颗粒很细,通常在“酸浸”时加入聚合硫酸铝铁{化学式:[FeaAlb(OH)c(SO4)d]n},其目的是___ 。
(3)检验“酸浸”后溶液中含有Fe3+的试剂是__ 。
(4)“除杂”是为了除去溶液中的___ (填离子符号),调pH=8~10的原因是__ 。
(5)“置换”中发生反应的离子方程式是___ 。

已知:①Zn(OH)2为两性氢氧化物,溶液pH>10开始溶解。
②相关物质开始沉淀和沉淀完全时的pH如表所示:
| 物质 | Fe(OH)3 | Zn(OH)2 |
| 开始沉淀的pH | 2.7 | 6.4 |
| 沉淀完全的pH | 3.7 | 8.0 |
(2)“滤渣1”的主要成分是
(3)检验“酸浸”后溶液中含有Fe3+的试剂是
(4)“除杂”是为了除去溶液中的
(5)“置换”中发生反应的离子方程式是
您最近半年使用:0次
2021-11-25更新
|
558次组卷
|
4卷引用:四川省宜宾市2021-2022学年高三上学期第一次诊断检测理综化学试题
四川省宜宾市2021-2022学年高三上学期第一次诊断检测理综化学试题(已下线)备战2022年高考化学精准检测卷【全国卷】17(已下线)一轮巩固卷4-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(全国卷专用)广东省韶关市武江区广东北江实验中学2021-2022学年高三下学期适应性考试(四)化学试题
5 . 利用水钴矿(主要成分为Co2O3,含少量Fe2O3、FeO、Al2O3、MnO、MgO、CaO、SiO2等)可以制取多种化工试剂,以下为草酸钴晶体和氯化钴晶体的制备流程,回答下列问题:
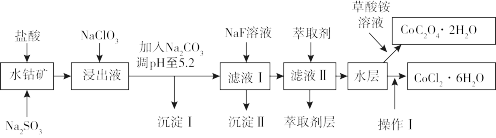
已知:①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+、Mg2+、Ca2+等。
②沉淀Ⅰ中只含有两种沉淀。
③流程中部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
(1)浸出过程中氧化剂与还原剂物质的量之比为___ 。
(2)NaClO3在浸出液中发生反应的离子方程式为___ 。
(3)加入Na2CO3调pH至5.2,目的是___ ;萃取剂层含锰元素,则沉淀Ⅱ的主要成分为___ 。
(4)操作Ⅰ包括:将水层加入浓盐酸调整pH为2~3,___ 、___ 、过滤、洗涤、减压烘干等过程。
(5)将5.49g草酸钴晶体(CoC2O4·2H2O)置于空气中加热,受热过程中不同温度范围内分别得到一种固体物质,其质量如表。
经测定,整个受热过程,只产生水蒸气和CO2气体,则290~320℃温度范围,剩余的固体物质化学式为___ 。[已知:CoC2O4·2H2O的摩尔质量为183g·mol-1]

已知:①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+、Mg2+、Ca2+等。
②沉淀Ⅰ中只含有两种沉淀。
③流程中部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
| 沉淀物 | 开始沉淀 | 完全沉淀 |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.6 |
| Co(OH)2 | 7.6 | 9.2 |
| Al(OH)3 | 4.0 | 5.2 |
| Mn(OH)2 | 7.7 | 9.8 |
(2)NaClO3在浸出液中发生反应的离子方程式为
(3)加入Na2CO3调pH至5.2,目的是
(4)操作Ⅰ包括:将水层加入浓盐酸调整pH为2~3,
(5)将5.49g草酸钴晶体(CoC2O4·2H2O)置于空气中加热,受热过程中不同温度范围内分别得到一种固体物质,其质量如表。
| 温度范围/℃ | 150~210 | 290~320 |
| 固体质量/g | 4.41 | 2.41 |
您最近半年使用:0次
2021-08-14更新
|
259次组卷
|
2卷引用:四川省蓬安中学校2020届高三10月月考化学试题
6 . 金属氢氧化物在酸中溶解度不同,因此可以利用这一性质,控制溶液的pH,达到分离金属离子的目的。难溶金属的氢氧化物在不同pH下的溶解度(S/mol·L-1)如图所示。
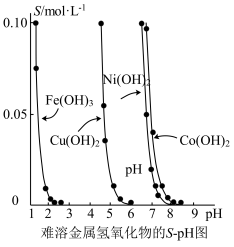
(1)pH=3时溶液中铜元素的主要存在形式是___________ 。
(2)若要除去CuCl2溶液中的少量Fe3+,应该控制溶液的pH___________(填序号)。
(3)在Ni(NO3)2溶液中含有少量的Co2+杂质,___________ (填“能”或“不能”)通过调节溶液pH的方法来除去,理由是___________ 。
(4)已知一些难溶电解质的溶度积常数如下表:
为除去某工业废水中含有的Cu2+、Pb2+、Hg2+杂质,最适宜向此工业废水中加入过量的___________ (填序号)。
A.NaOH B.FeS C.Na2S
(5)向FeS的悬浊液加入Cu2+产生黑色的沉淀,反应的离子方程式为:___________ 该反应的平衡常数是:___________

(1)pH=3时溶液中铜元素的主要存在形式是
(2)若要除去CuCl2溶液中的少量Fe3+,应该控制溶液的pH___________(填序号)。
| A.<1 | B.4左右 | C.>6 | D.>8 |
(4)已知一些难溶电解质的溶度积常数如下表:
| 物质 | FeS | MnS | CuS |
| Ksp | 6.5×10-18 | 2.5×10-13 | 1.3×10-35 |
| 物质 | PbS | HgS | ZnS |
| Ksp | 3.4×10-28 | 6.4×10-33 | 1.6×10-24 |
A.NaOH B.FeS C.Na2S
(5)向FeS的悬浊液加入Cu2+产生黑色的沉淀,反应的离子方程式为:
您最近半年使用:0次
2021-08-14更新
|
1546次组卷
|
5卷引用:四川省蓬安中学校2019-2020学年高二下学期第一次阶段性考试化学试题
四川省蓬安中学校2019-2020学年高二下学期第一次阶段性考试化学试题(已下线)第3章 水溶液中的离子反应与平衡(能力提升卷)-【高效检测】2021-2022学年高二化学章末测试卷(人教版2019选择性必修1)(已下线)第三章第四节 难溶电解的溶解平衡(备作业)-【上好课】2021-2022学年高二化学选修4同步备课系列(人教版)(已下线)3.4.2 沉淀溶解平衡原理的应用-2021-2022学年高二化学课后培优练(苏教版2019选择性必修1)江苏省徐州市第七中学2021-2022学年高二下学期期中考试化学试题
7 . 下列方程式与所给事实不相符的是
A.NH4Cl溶液呈酸性:NH +H2O +H2O NH3·H2O+H+ NH3·H2O+H+ |
B.用KI溶液将AgCl转化为AgI:I-(aq)+AgCl(s)  AgI(s)+Cl-(aq) AgI(s)+Cl-(aq) |
C.加热氯化铜溶液,溶液变为黄绿色:Cu2++2H2O Cu(OH)2+2H+ Cu(OH)2+2H+ |
| D.用氯化铁溶液腐蚀覆铜板上的铜:2Fe3++Cu=Cu2++2Fe2+ |
您最近半年使用:0次
8 . 常温下, 和
和 的沉淀溶解关系如图所示,其中
的沉淀溶解关系如图所示,其中 、
、 ,M为
,M为 或
或 ,
, 表示
表示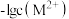 。下列说法正确的是
。下列说法正确的是
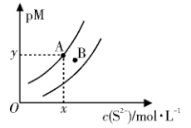
 和
和 的沉淀溶解关系如图所示,其中
的沉淀溶解关系如图所示,其中 、
、 ,M为
,M为 或
或 ,
, 表示
表示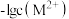 。下列说法正确的是
。下列说法正确的是
A.常温下,B点为 的不饱和溶液 的不饱和溶液 |
B.若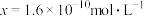 ,则 ,则 |
| C.若对A点浊液加热,A点沿曲线向上移动 |
D.在 和 和 同时沉淀的浊液中, 同时沉淀的浊液中, |
您最近半年使用:0次
2021-07-06更新
|
756次组卷
|
10卷引用:四川省乐山市2020-2021学年高二下学期期末考试化学试题
四川省乐山市2020-2021学年高二下学期期末考试化学试题(已下线)必考点08 沉淀溶解平衡-【对点变式题】2021-2022学年高二化学上学期期中期末必考题精准练(人教版选择性必修1)四川省成都外国语学校2021-2022学年高二下学期入学考试化学试题四川省遂宁中学校2021-2022学年高二下学期期中考试化学试题四川省南充市南部县第二中学2021-2022学年高二下学期5月月考化学试题江西省抚州市2021-2022学年高二上学期期末学生学业质量监测化学试题山东师范大学附属中学2022-2023学年高二上学期期中水平测试化学试题广东省广州市华南师范大学附属中学2022-2023学年高二上学期12月月考化学试题广东省东莞市东莞中学松山湖学校2023-2024学年高二上学期期中考试化学试题 江西省南昌市第十中学2023-2024学年高二上学期第二次月考化学试题
解题方法
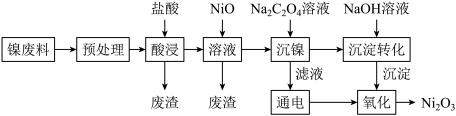
9 . 三氧化二镍(Ni2O3)是重要的电子元件材料和蓄电池材料,工业上利用含镍废料(主要成分为镍、铝、氧化铁、碳等)提取Ni2O3,工艺流程如下:
已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+。
②实际生产温度时的溶解度:NiC2O4>NiC2O4·H2O>NiC2O4·2H2O。
③相关金属离子生成氢氧化物沉淀的pH如下(开始沉淀的pH按金属离子的浓度为1mol·L-1计算):
(1)“预处理”操作选择用酒精清洗的目的是_______ 。
(2)“酸浸”时,①温度不宜过高,原因_______ 。
②常温下,盐酸的浓度为2.5mol·L-1,“液固比”与镍的浸出率的关系如图所示,实际生产采取的“液固比”为_______ ,主要的原因是_______ 。

(3)室温下,“浸出”所得溶液中Fe3+的浓度为0.2mol·L-1,当溶液的pH调到2时,c(Fe3+)=_______ 。加NiO调节pH的范围为_______ 。(已知:Ksp[Fe(OH)3]=4.0×10-38)
(4)加入Na2C2O4溶液“沉镍”得到的沉淀为_______ 。
(5)电解过程中产生的氯气在碱性条件下生成ClO-,再把二价镍氧化为三价镍,写出“氧化”反应的离子反应方程式_______ 。

已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+。
②实际生产温度时的溶解度:NiC2O4>NiC2O4·H2O>NiC2O4·2H2O。
③相关金属离子生成氢氧化物沉淀的pH如下(开始沉淀的pH按金属离子的浓度为1mol·L-1计算):
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Ni(OH)2 | Fe(OH)2 |
| 开始沉淀时pH | 1.8 | 3.0 | 7.1 | 5.8 |
| 完全沉淀时pH | 3.2 | 5.0 | 9.2 | 8.0 |
(2)“酸浸”时,①温度不宜过高,原因
②常温下,盐酸的浓度为2.5mol·L-1,“液固比”与镍的浸出率的关系如图所示,实际生产采取的“液固比”为

(3)室温下,“浸出”所得溶液中Fe3+的浓度为0.2mol·L-1,当溶液的pH调到2时,c(Fe3+)=
(4)加入Na2C2O4溶液“沉镍”得到的沉淀为
(5)电解过程中产生的氯气在碱性条件下生成ClO-,再把二价镍氧化为三价镍,写出“氧化”反应的离子反应方程式
您最近半年使用:0次
2021-06-10更新
|
938次组卷
|
3卷引用:四川省雅安市2021届高三下学期5月第三次诊断考试理综化学试题
名校
解题方法
10 . 活性炭载钯(Pd/C)催化剂被广泛应用于医药和化工行业,某废钯催化剂(钯碳)的杂质主要含炭、有机物及少量Fe等。如图是利用钯碳制备氯化钯(PdCl2)和Pd的流程。

回答下列问题:
(1)“钯灰”中的主要成分有PdO,加入甲酸(HCOOH),可以将PdO还原成金属单质,请写出HCOOH还原PdO的化学方程式___________ 。
(2)“焚烧”的目的是____ ;实验室中可在___________ (填仪器名称)中模拟该过程。
(3)王水是将浓盐酸和浓硝酸混合而得到的强氧化性溶液,加热条件下钯在王水中发生反应生成H2[PdCl4]和一种有毒的无色气体A,该气体遇空气变红棕色,该反应中消耗的HCl与HNO3的物质的量之比为___________ 。
(4)加入浓氨水,调节溶液pH至9.0,并控制温度在70 ~75℃,Pd元素以 的形式存在:
的形式存在:
①若温度大于75℃,则不利于除铁,原因是___________
②已知:黄色晶体的成分为 ,在合并液中加盐酸时,发生反应的离子方程式为
,在合并液中加盐酸时,发生反应的离子方程式为___________ 。
(5)洗涤滤渣并将洗涤液与滤液合并,其意义是___________ 。
(6)Pd是优良的储氢金属,假设海绵状金属钯密度为,ρg·cm-3标准状况下其吸附的氢气是其体积的n倍,则此条件下海绵钯的储氢容量R=___________ mL·g-1(储氢容量R即1g钯吸附氢气的体积)。

回答下列问题:
(1)“钯灰”中的主要成分有PdO,加入甲酸(HCOOH),可以将PdO还原成金属单质,请写出HCOOH还原PdO的化学方程式
(2)“焚烧”的目的是
(3)王水是将浓盐酸和浓硝酸混合而得到的强氧化性溶液,加热条件下钯在王水中发生反应生成H2[PdCl4]和一种有毒的无色气体A,该气体遇空气变红棕色,该反应中消耗的HCl与HNO3的物质的量之比为
(4)加入浓氨水,调节溶液pH至9.0,并控制温度在70 ~75℃,Pd元素以
 的形式存在:
的形式存在:①若温度大于75℃,则不利于除铁,原因是
②已知:黄色晶体的成分为
 ,在合并液中加盐酸时,发生反应的离子方程式为
,在合并液中加盐酸时,发生反应的离子方程式为(5)洗涤滤渣并将洗涤液与滤液合并,其意义是
(6)Pd是优良的储氢金属,假设海绵状金属钯密度为,ρg·cm-3标准状况下其吸附的氢气是其体积的n倍,则此条件下海绵钯的储氢容量R=
您最近半年使用:0次



