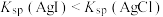名校
解题方法
1 . 下列实验目的对应的方案设计、现象和结论都正确的是
选项 | 实验目的 | 方案设计 | 现象和结论 |
A | 比较 | 向 | 白色沉淀转化为红褐色沉淀,证明 |
B | 探究压强对平衡移动的影响 | 密闭容器中盛 | 气体颜色加深,说明平衡向生成 |
C | 比较 | 向等体积饱和 | 得到沉淀 |
D | 比较 | 用 |
|
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2 . 下列实验方案能达到实验目的的是
| 实验目的 | 实验操作 | |
| A | 检验酸雨中含有 | 取样,向样品中滴入 溶液,有白色沉淀生成 溶液,有白色沉淀生成 |
| B | 检验钢铁发生吸氧腐蚀 | 取钢铁电极附近溶液,向其中滴加 溶液,产生蓝色 溶液,产生蓝色 沉淀 沉淀 |
| C | 证明酸性: | 室温下,用 计分别测等浓度的 计分别测等浓度的 溶液和 溶液和 溶液的 溶液的 ,测得 ,测得 溶液的 溶液的 大 大 |
| D | 验证: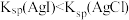 | 向 溶液中滴加2滴 溶液中滴加2滴 溶液,产生白色沉淀,再滴加2滴 溶液,产生白色沉淀,再滴加2滴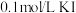 溶液,沉淀变成黄色 溶液,沉淀变成黄色 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
3 . 下列设计的实验方案不能达到实验目的的是
选项 | 实验目的 | 实验过程 |
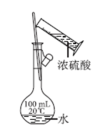
A | 配制 | 将一定质量的 固体放入烧杯中,直接用蒸馏水溶解 固体放入烧杯中,直接用蒸馏水溶解 |
B | 验证 结合 结合 的能力比 的能力比 的弱 的弱 | 室温下,用pH试纸测得0.1  溶液的pH为10,0.1 溶液的pH为10,0.1  溶液的pH约为5 溶液的pH约为5 |
C | 证明: | 向2支盛有2mL相同浓度银氨溶液的试管中分别加入2滴相同浓度的NaCl和NaI溶液,一支试管中产生黄色沉淀,另一支中无明显现象 |
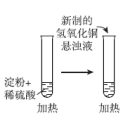
D | 探究催化剂对 分解速率的影响 分解速率的影响 | 在相同条件下,向一支试管中加入2mL 5%  和1mL 和1mL ,向另一支试管中加入2mL 5% ,向另一支试管中加入2mL 5%  和1mL 和1mL  溶液,观察并比较实验现象 溶液,观察并比较实验现象 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
4 . 化学学习离不开实验。下列实验操作能达到实验目的的是
| 选项 | 操作 | 目的 |
| A | 室温下,用pH计分别测量NaA和NaB溶液的pH | 比较HA和HB酸性强弱 |
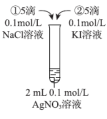
| B | 向2mL0.1mol·L-1的AgNO3溶液中滴加2滴浓度均为0.1mol·L-1NaCl和NaI的混合溶液,振荡,沉淀呈黄色 | 证明Ksp(AgCl)>Ksp(AgI) |
| C | 向含有酚酞的Na2CO3溶液中滴入BaCl2溶液至过量,观察溶液颜色的变化 | 证明Na2CO3溶液中存在碳酸根的水解平衡 |
| D | 在醋酸铅稀溶液中通入硫化氢气体,观察现象 | 判断H2S与CH3COOH酸性强弱 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-09-06更新
|
567次组卷
|
6卷引用:2022年辽宁省高考真题变式题(11-15)
(已下线)2022年辽宁省高考真题变式题(11-15)辽宁省沈阳市同泽中学2022-2023学年高二12月月考化学试题(已下线)2022年辽宁高考真题化学试题变式题(选择题11-15)河南省商丘名校2021-2022学年高二上学期期末联考化学试题(已下线)2022年北京高考真题变式题1-14(已下线)2022年北京高考真题化学试题变式题(选择题6-10)
5 . 含氯物质在生产生活中有重要作用。某合作学习小组进行以下实验探究。
i.实验任务。通过测定溶液电导率,探究温度对AgCl溶解度的影响。
ii.查阅资料。电导率是表征电解质溶液导电能力的物理量。温度一定时,强电解质稀溶液的电导率随溶液中离子浓度的增大而增大;离子浓度一定时,稀溶液电导率随温度的升高而增大。25℃时
iii.提出猜想。
猜想a:较高温度的AgCl饱和溶液的电导率较大。
猜想b:AgCl在水中的溶解度s(45℃)>s(35℃)>s(25℃)。
iv.设计实验、验证猜想。取试样I、II、III(不同温度下配制的AgCl饱和溶液),在设定的测试温度下,进行表中实验1~3,记录数据。
(1)数据分析、交流讨论。25℃的AgCl饱和溶液中,c(Cl-)___________ mol/L。实验结果为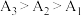 。小组同学认为,此结果可以证明iii中的猜想a成立,但不足以证明猜想b成立。结合ii中信息,猜想b不足以成立的理由有
。小组同学认为,此结果可以证明iii中的猜想a成立,但不足以证明猜想b成立。结合ii中信息,猜想b不足以成立的理由有___________
(2)优化实验。小组同学为进一步验证猜想b,在实验1~3的基础上完善方案,进行实验4和5请完成表中内容。
(3)实验总结。根据实验1~5的结果,并结合ii中信息,小组同学认为猜想b也成立。猜想b成立的判断依据是_______ 。
i.实验任务。通过测定溶液电导率,探究温度对AgCl溶解度的影响。
ii.查阅资料。电导率是表征电解质溶液导电能力的物理量。温度一定时,强电解质稀溶液的电导率随溶液中离子浓度的增大而增大;离子浓度一定时,稀溶液电导率随温度的升高而增大。25℃时

iii.提出猜想。
猜想a:较高温度的AgCl饱和溶液的电导率较大。
猜想b:AgCl在水中的溶解度s(45℃)>s(35℃)>s(25℃)。
iv.设计实验、验证猜想。取试样I、II、III(不同温度下配制的AgCl饱和溶液),在设定的测试温度下,进行表中实验1~3,记录数据。
| 实验序号 | 试样 | 测试温度/℃ | 电导率/S/m |
| 1 | I:25℃的AgCl饱和溶液 | 25 | A1 |
| 2 | II:35℃的AgCl饱和溶液 | 35 | A2 |
| 3 | III:45℃的AgCl饱和溶液 | 45 | A3 |
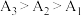 。小组同学认为,此结果可以证明iii中的猜想a成立,但不足以证明猜想b成立。结合ii中信息,猜想b不足以成立的理由有
。小组同学认为,此结果可以证明iii中的猜想a成立,但不足以证明猜想b成立。结合ii中信息,猜想b不足以成立的理由有(2)优化实验。小组同学为进一步验证猜想b,在实验1~3的基础上完善方案,进行实验4和5请完成表中内容。
| 实验序号 | 试样 | 测试温度/℃ | 电导率/S/m |
| 4 | I | B1 | |
| 5 | B2 |
您最近一年使用:0次
2021-11-21更新
|
239次组卷
|
2卷引用:辽宁省东北育才学校2021-2022学年高二上学期期中考试化学试题
6 . 为研究沉淀的生成及转化,同学们进行下图所示实验。

下列关于该实验的分析不正确的是

下列关于该实验的分析不正确的是
A.①中产生白色沉淀的原因是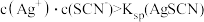 |
B.①中存在平衡: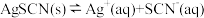 |
C.②中无明显变化是因为溶液中的 过低 过低 |
| D.上述实验不能证明AgSCN向AgI沉淀转化反应的发生 |
您最近一年使用:0次
2021-04-09更新
|
1169次组卷
|
12卷引用:2021年高考化学押题预测卷(辽宁卷)(02)
(已下线)2021年高考化学押题预测卷(辽宁卷)(02)北京市海淀区2021届高三一模化学试题福建省厦门英才学校2021届高三4模考试化学试题北京市第一七一中学2021-2022学年高二上学期12月月考化学试题天津市新华中学2021-2022学年高三下学期 统练2 化学试题(已下线)押新高考卷05题 化学实验基础-备战2022年高考化学临考题号押题(新高考通版)北京市第一六一中学2022-2023学年高三上学期期中考试化学试题广西三新联盟2022-2023学年高二上学期11月联考化学试题广西南宁市藤县中学等2校2022-2023学年高二上学期11月月考化学试题北京市第一○一中学2023-2024学年高二上学期期中练习化学试题北京市第一六一中学2023-2024学年高二上学期12月阶段练习化学试题北京师范大学附属实验中学2023-2024学年高二下学期开学检测化学试题
名校
解题方法
7 . 下列实验能达到实验目的且操作正确的是
A | B | C | D |
| 证明氯化银溶解度大于碘化银的溶解度 | 配制一定物质的量浓度的硫酸溶液 | 检验淀粉水解生成了葡萄糖 | 鉴别溴乙烷和苯 |
 |  |  |  |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2021-01-20更新
|
447次组卷
|
5卷引用:辽宁省葫芦岛市2021届高考第一次模拟考试化学试题
名校
解题方法
8 . 利用过量NaOH溶液处理含 、MgO矿物,然后过滤。向所得滤液中逐滴加入
、MgO矿物,然后过滤。向所得滤液中逐滴加入 溶液,测得溶液pH和生成
溶液,测得溶液pH和生成 与所加入
与所加入 变化的曲线如图。下列说法错误的是
变化的曲线如图。下列说法错误的是

 、MgO矿物,然后过滤。向所得滤液中逐滴加入
、MgO矿物,然后过滤。向所得滤液中逐滴加入 溶液,测得溶液pH和生成
溶液,测得溶液pH和生成 与所加入
与所加入 变化的曲线如图。下列说法错误的是
变化的曲线如图。下列说法错误的是
A.a点溶质为 和NaOH,存在 和NaOH,存在 |
B. 溶液中: 溶液中: |
C.b点到c点过程中 为定值 为定值 |
D.d点溶液: |
您最近一年使用:0次
9 . 已知常温下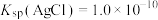 ,
, ,现有等体积的AgCl和AgI的饱和溶液的清液。下列说法错误的是
,现有等体积的AgCl和AgI的饱和溶液的清液。下列说法错误的是
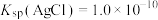 ,
, ,现有等体积的AgCl和AgI的饱和溶液的清液。下列说法错误的是
,现有等体积的AgCl和AgI的饱和溶液的清液。下列说法错误的是A.若向AgI清液加入 固体,则溶液中 固体,则溶液中 增大, 增大,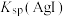 不变 不变 |
B.若将等体积的两饱和清液混合,向其中加入 溶液,当AgCl开始沉淀时,溶液中 溶液,当AgCl开始沉淀时,溶液中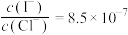 |
C.若向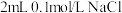 溶液中滴加2滴 溶液中滴加2滴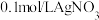 溶液,产生白色沉淀;再向其中滴加4滴 溶液,产生白色沉淀;再向其中滴加4滴 的KI溶液,有黄色沉淀产生,则可验证 的KI溶液,有黄色沉淀产生,则可验证 |
D.若将等体积的两饱和清液混合,再加入足量 固体,则AgCl和AgI都可沉淀,以AgI为主 固体,则AgCl和AgI都可沉淀,以AgI为主 |
您最近一年使用:0次
2023-12-12更新
|
601次组卷
|
7卷引用:辽宁省沈阳市第二中学2023-2024学年高二上学期第二次月考化学试题
10 . 在T℃时,AgBr在水中的沉淀溶解平衡曲线如图所示。又知T℃时AgCl的Ksp=4×10-10,下列说法不正确的是

| A.在T℃时,AgBr的Ksp为4.9×10-13 |
| B.在AgBr饱和溶液中加入NaBr固体,可使溶液由c点到b点 |
| C.图中a点对应的是AgBr的不饱和溶液 |
| D.在T℃时,AgCl(s)+Br-(aq)⇌AgBr(s)+Cl-(aq)的平衡常数K≈816 |
您最近一年使用:0次
2023-12-16更新
|
172次组卷
|
77卷引用:2016-2017学年辽宁省盘锦高中高二上期中化学卷
2016-2017学年辽宁省盘锦高中高二上期中化学卷辽宁省沈阳市铁西区重点协作校2021-2022学年高二上学期期中考试化学试题(已下线)2014年化学高考总复习课时演练 8-4难溶电解质的溶解平衡练习卷(已下线)2014高考名师推荐化学溶度积、沉淀的生成、溶解、转化(已下线)2014高考名师推荐化学--预测152014-2015山西省太原市五中高二上学期期末化学理试卷2016届宁夏银川市第二中学高三上学期统练(三)化学试卷2015-2016学年广西柳州铁路第一中学高二上段考理化学卷2015-2016学年黑龙江大庆一中高二下假期验收化学试卷2015-2016学年山东省菏泽市高二上学期期末考试化学试卷2015-2016学年湖北省宜昌市示范高中高二下期中化学试卷2017届江西省赣中南五校高三上学期第一次模拟考试化学试卷2016-2017学年湖南省长沙一中高二上期中化学卷2016-2017学年江西省南昌市八一中学等五校高二上联考二化学试卷2016-2017学年福建省泉州市南安第一中学高二下学期第一次阶段考试(3月)化学试卷湖南省岳阳市第一中学2016-2017学年高二下学期期中考试化学试题四川省资阳市2016-2017学年高二下学期期末考试化学试题宁夏育才中学孔德校区2017-2018学年高二12月月考化学试题河南省南阳市第一中学2017-2018学年高二上学期第三次月考化学试题河南省滑县第二高级中学2017-2018学年高二12月月考化学试题四川省宜宾市南溪一中2017-2018学年高二下学期第一次月考化学试题(已下线)2018年11月16日 《每日一题》人教选修4-沉淀溶解平衡曲线及应用人教版高二化学选修4 第三章 第四节 难溶电解质的溶解平衡练习题【全国百强校】黑龙江省大庆第一中学2018-2019学年高二上学期期末考试化学试题山东省兖州市2019-2020学年高二上学期期中考试化学试题(已下线)专题8.4 难溶电解质的溶解平衡(讲)-《2020年高考一轮复习讲练测》陕西省咸阳市武功县2020届高三上学期第一次模拟考试化学试题山东省章丘四中2019—2020学年高二上学期12月第二次阶段测试化学试题河北省邯郸市大名县第一中学2019-2020学年高二上学期12月月考化学试题(清北组)2019年秋高三化学复习强化练习—— 难溶电解质的沉淀溶解平衡陕西省西安中学2019-2020学年高二12月月考化学试题吉林省长春市实验中学2019-2020学年高二上学期期末考试化学试题夯基提能2020届高三化学选择题对题专练——选修4化学反应原理——沉淀溶解平衡的曲线分析2020届人教版高三专题基础复习专题8《水溶液中的离子平衡》测试卷2020届高三化学化学二轮复习——常考题型:浓度积及浓度积常数【精编24题】广西钦州市2019-2020学年高二下学期期末教学质量监测化学试题鲁科版(2019)高二选择性必修第一册第3章 物质在水溶液中的行为 第3节 沉淀溶解平衡 高效手册河北省石家庄市藁城区第一中学2019-2020学年高二上学期第三次月考化学试题河北省任丘市第一中学2020-2021学年高二上学期第二次阶段考试化学试题山西省运城市临猗县临晋中学2020-2021学年高二上学期12月月考化学试题甘肃省白银市会宁县2020-2021学年高二上学期期末考试化学试题黑龙江省哈尔滨市呼兰区第一中学校等三校2020-2021学年高二上学期期末联考化学试题宁夏吴忠中学2020-2021学年高二上学期期末考试化学试题重庆实验中学2020-2021学年高二上学期第二阶段考试化学试题黑龙江省龙东南六校2020-2021学年高二上学期期末联考化学试题安徽省安庆市第十中学2020-2021学年高二5月月考化学试题陕西省咸阳市实验中学2020-2021学年高二下学期第三次月考化学试题(已下线)第26讲 难溶电解质的溶解平衡(精讲)-2022年一轮复习讲练测(已下线)考点26 难溶电解质的溶解平衡-备战2022年高考化学一轮复习考点帮(全国通用)河北省石家庄市辛集市第一中学2020-2021学年高二月考第四次考试(一)化学试题河北省石家庄市第一中学2020-2021学年高二上学期学情反馈(一) 化学试题四川省绵阳市南山中学实验学校2022届高三上学学期开学考试化学试题甘肃省白银市第八中学2021-2022学年高二上学期第二次月考(11月)化学试题(已下线)3.4.1 沉淀溶解平衡原理(备作业)-【上好课】2021-2022学年高二化学同步备课系列(苏教版2019选择性必修1)广东省揭阳市揭西县2021-2022学年高二上学期期末考试化学试题天津市五校联考2021-2022学年高二上学期期末考试化学试题河北省保定市博野中学2021-2022学年高二上学期12月月考化学试题甘肃省张掖市第二中学2021-2022学年高二上学期期末考试化学试题河南省九师联盟2021-2022学年高二下学期4月质量检测化学试题(已下线)押全国卷理综第12题 水溶液中的离子平衡-备战2022年高考化学临考题号押题(全国卷)广东省普宁市华侨中学2021-2022学年高二下学期期中考试化学试题山东省德州市2020-2021学年高二上学期反应原理月考(A)化学试题(已下线)第15练 以Ksp的计算突破溶解平衡-2022年【暑假分层作业】高二化学(2023届一轮复习通用)云南省玉龙县第一中学2021-2022学年高二下学期3月份考试化学试题河南省中原名校2021-2022学年高二下学期第一次联考化学试题江西省重点校2022-2023学年高三上学期第二次联考化学试题.云南省玉溪市易门县一中2021-2022学年高二下学期3月月考化学试题江西省丰城市第九中学2021-2022学年高二上学期第一次月考化学试题作业(二十二) 沉淀的溶解与生成、转化及应用第三章 水溶液中的离子反应与平衡 第四节 沉淀溶解平衡 第2课时 沉淀溶解平衡的应用西省西安市铁一中学2023-2024学年高二上学期期中质量检测化学试题(已下线)电离 水解 溶解平衡图像天津市第四十二中学2023-2024学年高二上学期第二次月考化学试题 天津市静海区第一中学2023-2024学年高二上学期12月月考化学试题广东省清远市阳山县南阳中学2023-2024学年高二上学期第二次月考(期中)化学试题陕西省西安市阎良区关山中学2023-2024学年高二上学期第三次质量检测化学试题河北省石家庄市西山学校2023-2024学年高二上学期期末考试化学试题

 和
和 的
的 相对大小
相对大小 的
的 溶液中滴加
溶液中滴加 的
的 溶液,再滴加
溶液,再滴加 溶液
溶液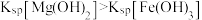
 ,一段时间后反应达平衡,压缩体积至原来的一半
,一段时间后反应达平衡,压缩体积至原来的一半 和
和 的
的 溶液
溶液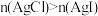 ,则
,则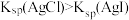
 与
与 的酸性
的酸性 溶液②
溶液②