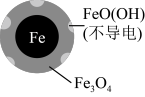
1 . 下列说法正确的是
| A.反应物用量增加后,有效碰撞次数增多,反应速率一定增大 |
| B.等物质的量的硫蒸气和固体硫分别完全燃烧,后者放出热量多 |
| C.△H<0、△S>0的反应在任何温度下都能自发进行 |
| D.铜铁交接处,在潮湿的空气中直接发生反应:Fe-3e-=Fe3+,继而形成铁锈 |
您最近一年使用:0次
2022-02-19更新
|
358次组卷
|
2卷引用:湖北省荆州市八县市2021-2022学年高二上学期期末质量检测化学试题
2 . 某学习小组探究 溶液与
溶液与 溶液在某种条件下的反应。
溶液在某种条件下的反应。
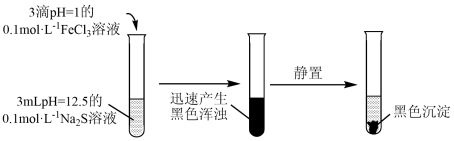
已知:FeS、 均为黑色固体,难溶于水。
均为黑色固体,难溶于水。
(1) 只能大量存在于碱性溶液环境的原因是
只能大量存在于碱性溶液环境的原因是___________ (用化学用语回答)。
(2)小组同学们对试管b中黑色沉淀的提出猜想
猜想1:黑色沉淀是FeS
猜想2:黑色沉淀是
①若猜想1成立,甲同学推测还应该有S生成。甲同学推测所依据的离子方程式___________ 。经检验后确认黑色沉淀中无S单质,猜想1不成立。
②乙同学根据 溶液呈碱性,推测试管b中黑色沉淀除
溶液呈碱性,推测试管b中黑色沉淀除 外,还可能存在
外,还可能存在 ,进行如下实验,以便获得有效信息。
,进行如下实验,以便获得有效信息。
向 浊液中滴加pH=12.5的0.1mol/L
浊液中滴加pH=12.5的0.1mol/L  溶液,观察到红褐色沉淀很快转化为黑色。
溶液,观察到红褐色沉淀很快转化为黑色。
该实验现象能确定的结论是___________ ;不能确定的是___________ 。
(3)丙同学利用电化学原理继续进行探究并设计实验:
丙同学依据实验得出结论:pH=1的0.1mol/L  溶液与pH=12.5的0.1mol/L
溶液与pH=12.5的0.1mol/L  溶液
溶液___________ (填“能”或“不能”)发生氧化还原反应。
(4)综合以上研究,分析试管b中黑色沉淀是 而不是FeS的原因
而不是FeS的原因___________ 。
 溶液与
溶液与 溶液在某种条件下的反应。
溶液在某种条件下的反应。
已知:FeS、
 均为黑色固体,难溶于水。
均为黑色固体,难溶于水。(1)
 只能大量存在于碱性溶液环境的原因是
只能大量存在于碱性溶液环境的原因是(2)小组同学们对试管b中黑色沉淀的提出猜想
猜想1:黑色沉淀是FeS
猜想2:黑色沉淀是

①若猜想1成立,甲同学推测还应该有S生成。甲同学推测所依据的离子方程式
②乙同学根据
 溶液呈碱性,推测试管b中黑色沉淀除
溶液呈碱性,推测试管b中黑色沉淀除 外,还可能存在
外,还可能存在 ,进行如下实验,以便获得有效信息。
,进行如下实验,以便获得有效信息。向
 浊液中滴加pH=12.5的0.1mol/L
浊液中滴加pH=12.5的0.1mol/L  溶液,观察到红褐色沉淀很快转化为黑色。
溶液,观察到红褐色沉淀很快转化为黑色。该实验现象能确定的结论是
(3)丙同学利用电化学原理继续进行探究并设计实验:
| 装置 | 操作及现象 |
 | ①电流计指针有微弱偏转 ②2分钟后,取左侧烧杯溶液,滴加  溶液,有少量蓝色沉淀;2小时后,右侧烧杯有黄色浑浊产生,再取左侧烧杯溶液,滴加 溶液,有少量蓝色沉淀;2小时后,右侧烧杯有黄色浑浊产生,再取左侧烧杯溶液,滴加 溶液,有大量蓝色沉淀。 溶液,有大量蓝色沉淀。 |
 溶液与pH=12.5的0.1mol/L
溶液与pH=12.5的0.1mol/L  溶液
溶液(4)综合以上研究,分析试管b中黑色沉淀是
 而不是FeS的原因
而不是FeS的原因
您最近一年使用:0次
名校
解题方法
3 . 某同学做如下实验,下列说法正确的是
| 装置 | 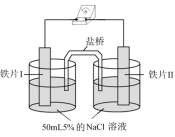 | 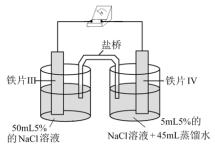 |
| 现象 | 电流计指针未发生偏转 | 电流计指针发生偏转 |
| A.“电流计指针未发生偏转”,说明铁片I、铁片II均未被腐蚀 |
| B.铁片IV的电极反应式为Fe-3e-=Fe3+ |
| C.铁片I、III所处的电解质溶液浓度相同,二者的腐蚀速率相等 |
| D.用K3[Fe(CN)6]溶液检验铁片III、IV附近溶液,可判断电池的正、负极 |
您最近一年使用:0次
2021-02-05更新
|
439次组卷
|
3卷引用:江西省师范大学附属中学2021-2022学年高二上学期期末化学试题
名校
解题方法
4 . 青铜器在潮湿环境中发生电化学腐蚀原理如图所示:多孔催化层中的Cl-扩散到孔口,与电极产物作用生成多孔粉状锈Cu2(OH)3Cl,下列说法正确的是( )
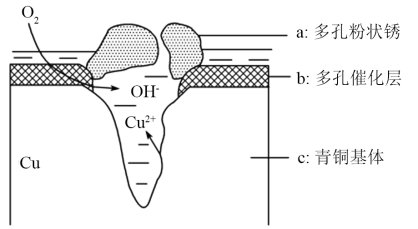

| A.此过程为电化学腐蚀中的析氢腐蚀 |
| B.电极b发生的反应:O2+4e-+2H2O=4OH- |
| C.生成Cu2(OH)3Cl的反应:2Cu2++3H2O+Cl-=Cu2(OH)3Cl↓+3H+ |
| D.若采用牺牲阳极的阴极保护法保护青铜器是利用了电解的原理 |
您最近一年使用:0次
2020-11-19更新
|
1191次组卷
|
4卷引用:黑龙江省友谊县高级中学2022-2023学年高二上学期期末考试(新教材)化学试题
5 . 食品包装中常见的脱氧剂组成为还原性铁粉、氯化钠、炭粉等,其脱氧过程与电化学知识相关。下列分析正确的是
| A.脱氧过程是吸热反应,可降低温度,延长食品保质期 |
| B.脱氧过程中炭作原电池正极,电极反应为:4H++O2+4e-=2H2O |
| C.含有0.56 g铁粉的脱氧剂,理论上最多能吸收氧气168 mL(标准状况) |
| D.该过程实现了电能到化学能的转化 |
您最近一年使用:0次
2020-11-18更新
|
732次组卷
|
6卷引用:江苏省丹阳高级中学2021-2022学年高二下学期期初考试化学试题
江苏省丹阳高级中学2021-2022学年高二下学期期初考试化学试题(已下线)练习10 金属的腐蚀与防护-2020-2021学年【补习教材·寒假作业】高二化学(人教版2019)江苏省苏州市相城区陆慕高级中学2021-2022学年高二上学期第一次月考化学试题河北省张家口市第一中学2021届高三上学期期中考试(衔接班)化学试题广东省广州市第六中学2022届高三第二次月考化学试题(已下线)湖北省七市(州)2023届高三3月联合统一调研测试化学试题变式题(选择题1-5)
2020高三·全国·专题练习
6 . 用零价铁(Fe)去除水体中的硝酸盐( )已成为环境修复研究的热点之一。
)已成为环境修复研究的热点之一。
(1)Fe还原水体中 的反应原理如图所示。
的反应原理如图所示。

①作负极的物质化学式为___________ 。
②正极的电极反应式是_____________ 。
(2)将足量铁粉投入水体中,经24小时测定 的去除率和pH,结果如下:
的去除率和pH,结果如下:
pH=4.5时, 的去除率低。其原因是
的去除率低。其原因是_________________ 。
(3)实验发现:在初始pH=4.5的水体中投入足量铁粉的同时,补充一定量的Fe2+可以明显提高 的去除率。对Fe2+的作用提出两种假设:
的去除率。对Fe2+的作用提出两种假设:
I.Fe2+直接还原 ;
;
II.Fe2+破坏FeO(OH)氧化层。
①做对比实验,结果如图所示,可得到的结论是_________ 。
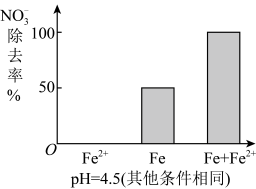
②同位素示踪法证实Fe2+能与FeO(OH)反应生成Fe3O4,该反应的离子方程式为_________ ,解释加入Fe2+提高 去除率的原因:
去除率的原因:___________ 。
 )已成为环境修复研究的热点之一。
)已成为环境修复研究的热点之一。(1)Fe还原水体中
 的反应原理如图所示。
的反应原理如图所示。
①作负极的物质化学式为
②正极的电极反应式是
(2)将足量铁粉投入水体中,经24小时测定
 的去除率和pH,结果如下:
的去除率和pH,结果如下:初始pH | pH=2.5 | pH=4.5 |
| 接近100% | <50% |
24小时pH | 接近中性 | 接近中性 |
铁的最终物质形态 |
|
|
 的去除率低。其原因是
的去除率低。其原因是(3)实验发现:在初始pH=4.5的水体中投入足量铁粉的同时,补充一定量的Fe2+可以明显提高
 的去除率。对Fe2+的作用提出两种假设:
的去除率。对Fe2+的作用提出两种假设:I.Fe2+直接还原
 ;
;II.Fe2+破坏FeO(OH)氧化层。
①做对比实验,结果如图所示,可得到的结论是
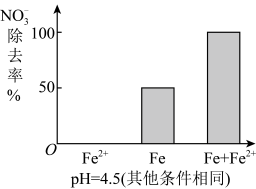
②同位素示踪法证实Fe2+能与FeO(OH)反应生成Fe3O4,该反应的离子方程式为
 去除率的原因:
去除率的原因:
您最近一年使用:0次
名校
解题方法
7 . 有关下列说法中,正确的是
| A.用标准盐酸滴定未知浓度的NaOH溶液,滴定前酸式滴定管尖嘴有气泡未排出,滴定后气泡消失,会造成测定结果偏低 |
| B.工业废水中的Cu2+、Hg2+等重金属阳离子可以通过加入FeS除去 |
| C.工业上常在铁板表面镀上一层锡(俗称马口铁)来防止铁板表面破损后发生电化学腐蚀 |
| D.等体积的pH均为2的酸HA和HB的溶液分别与足量的铁粉反应,HA放出的H2多,说明HA酸性强 |
您最近一年使用:0次
2020-01-24更新
|
390次组卷
|
4卷引用:山东省淄博市高青县第一中学2021-2022学年高二下学期开学收心考试化学试题
山东省淄博市高青县第一中学2021-2022学年高二下学期开学收心考试化学试题山东省济宁市2019-2020学年高二上学期期末考试化学试题湖北省恩施土家族苗族自治州高级中学2019-2020学年高二下学期第二次双周考试化学试题(已下线)练习10 金属的腐蚀与防护-2020-2021学年【补习教材·寒假作业】高二化学(人教版2019)
名校
8 . 《我在故宫修文物》这部纪录片里关于古代青铜器的修复引起了某研学小组的兴趣。“修旧如旧”是文物保护的主旨。
(1)查阅高中教材得知铜锈为Cu2(OH)2CO3,俗称铜绿,可溶于酸。铜绿在一定程度上可以提升青铜器的艺术价值。参与形成铜绿的物质有Cu和_______ 。
(2)继续查阅中国知网,了解到铜锈的成分非常复杂,主要成分有Cu2(OH)2CO3和Cu2(OH)3Cl。考古学家将铜锈分为无害锈和有害锈,结构如图所示:
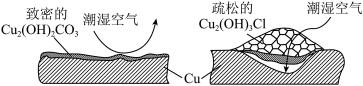
Cu2(OH)2CO3和Cu2(OH)3Cl分别属于无害锈和有害锈,请解释原因_____________ 。
(3)文献显示有害锈的形成过程中会产生CuCl(白色不溶于水的固体),请结合下图回答:
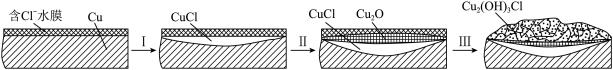
① 过程Ⅰ的正极反应物是___________ 。
② 过程Ⅰ负极的电极反应式是_____________ 。
(4)青铜器的修复有以下三种方法:
ⅰ.柠檬酸浸法:将腐蚀文物直接放在2%-3%的柠檬酸溶液中浸泡除锈;
ⅱ.碳酸钠法:将腐蚀文物置于含Na2CO3的缓冲溶液中浸泡,使CuCl转化为难溶的Cu2(OH)2CO3;
ⅲ.BTA保护法:
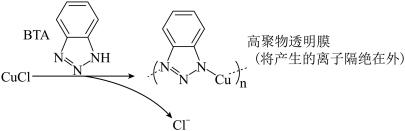
请回答下列问题:
①写出碳酸钠法的离子方程式___________________ 。
②三种方法中,BTA保护法应用最为普遍,分析其可能的优点有___________ 。
A.在青铜器表面形成一层致密的透明保护膜
B.替换出锈层中的Cl-,能够高效的除去有害锈
C.和酸浸法相比,不破坏无害锈,可以保护青铜器的艺术价值,做到“修旧如旧”
(1)查阅高中教材得知铜锈为Cu2(OH)2CO3,俗称铜绿,可溶于酸。铜绿在一定程度上可以提升青铜器的艺术价值。参与形成铜绿的物质有Cu和
(2)继续查阅中国知网,了解到铜锈的成分非常复杂,主要成分有Cu2(OH)2CO3和Cu2(OH)3Cl。考古学家将铜锈分为无害锈和有害锈,结构如图所示:

Cu2(OH)2CO3和Cu2(OH)3Cl分别属于无害锈和有害锈,请解释原因
(3)文献显示有害锈的形成过程中会产生CuCl(白色不溶于水的固体),请结合下图回答:

① 过程Ⅰ的正极反应物是
② 过程Ⅰ负极的电极反应式是
(4)青铜器的修复有以下三种方法:
ⅰ.柠檬酸浸法:将腐蚀文物直接放在2%-3%的柠檬酸溶液中浸泡除锈;
ⅱ.碳酸钠法:将腐蚀文物置于含Na2CO3的缓冲溶液中浸泡,使CuCl转化为难溶的Cu2(OH)2CO3;
ⅲ.BTA保护法:

请回答下列问题:
①写出碳酸钠法的离子方程式
②三种方法中,BTA保护法应用最为普遍,分析其可能的优点有
A.在青铜器表面形成一层致密的透明保护膜
B.替换出锈层中的Cl-,能够高效的除去有害锈
C.和酸浸法相比,不破坏无害锈,可以保护青铜器的艺术价值,做到“修旧如旧”
您最近一年使用:0次
2019-06-11更新
|
1882次组卷
|
7卷引用:福建省泉州市第六中学2022-2023学年高二上学期期中考化学试题
名校
9 . 将 NaCl 溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆周中心区(a)已被腐蚀而变暗,在液滴外沿棕色铁锈环(b),如图所示。下列说法不正确 的是( )
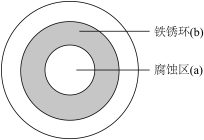

| A.铁片腐蚀过程发生的总化学方程式为:4Fe+6H2O+3O2 ==4 Fe(OH)3 |
| B.液滴之下氧气含量少, 铁片作负极,发生的还原反应为: Fe-2e-=Fe2+ |
| C.液滴边缘是正极区,发生的电极反应为: O2+2H2O+4e-=4OH- |
| D.铁片腐蚀最严重区域不是生锈最多的区域 |
您最近一年使用:0次
2019-06-06更新
|
1319次组卷
|
8卷引用:云南省腾冲市第一中学2021-2022学年高二下学期3月份考试化学试题
2019高三下·江苏·专题练习
名校
10 . 下列说法正确的是
| A.SO2溶于水,其水溶液能导电,说明SO2是电解质 |
| B.向0.1 mol·L−1 CH3COONa溶液中加入少量水,溶液中c(H+)/c(CH3COO−)减小 |
| C.在海轮外壳连接锌块保护外壳不受腐蚀采用了牺牲阳极的阴极保护法 |
| D.反应2CO(g)=2C(s) + O2(g) ΔH>0可以自发进行 |
您最近一年使用:0次