名校
解题方法
1 . 利用微生物燃料电池(MFC)可以将废水中的 降解为N2.某课题组设计出如图所示的微生物燃料电池进行同步硝化和反硝化脱氮研究,下列说法不正确的是
降解为N2.某课题组设计出如图所示的微生物燃料电池进行同步硝化和反硝化脱氮研究,下列说法不正确的是
 降解为N2.某课题组设计出如图所示的微生物燃料电池进行同步硝化和反硝化脱氮研究,下列说法不正确的是
降解为N2.某课题组设计出如图所示的微生物燃料电池进行同步硝化和反硝化脱氮研究,下列说法不正确的是
A.好氧电极b上发生的反硝化反应为2 +10e-+12H+=N2↑+6H2O +10e-+12H+=N2↑+6H2O |
| B.好氧电极b上的副反应为O2+4e-+4H+=2H2O |
| C.鼓入空气越多,越能促进反硝化反应的进行 |
D.理论上(不考虑副反应)每消耗1molC6H12O6,可以处理 的物质的量为4.8mol 的物质的量为4.8mol |
您最近一年使用:0次
2024-01-11更新
|
919次组卷
|
2卷引用:山东省营市胜利第一中学2023-2024学年高一下学期4月份阶段性测试化学试题
名校
解题方法
2 . 当氧化剂电对的电极电势大于还原剂电对的电极电势时,氧化还原反应才能进行。用如图所示装置探究原电池的工作原理,其中 、
、 均为碳棒,此时电流表的指针不发生偏转。已知:①反应
均为碳棒,此时电流表的指针不发生偏转。已知:①反应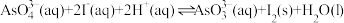 中的两个电对的标准电极电势
中的两个电对的标准电极电势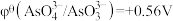 ,
, 。②标准电动势
。②标准电动势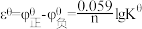 ,n为转移的电子数。下列说法错误的是
,n为转移的电子数。下列说法错误的是

 、
、 均为碳棒,此时电流表的指针不发生偏转。已知:①反应
均为碳棒,此时电流表的指针不发生偏转。已知:①反应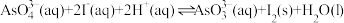 中的两个电对的标准电极电势
中的两个电对的标准电极电势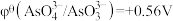 ,
, 。②标准电动势
。②标准电动势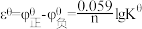 ,n为转移的电子数。下列说法错误的是
,n为转移的电子数。下列说法错误的是
| A.若向右侧烧杯中滴加浓盐酸,电流计指针会发生偏转 |
B.若向右侧烧杯中滴加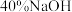 溶液,此时 溶液,此时 电极的电极反应式为 电极的电极反应式为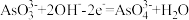 |
C.向右侧烧杯中加入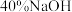 溶液时,盐桥中的阳离子向左侧烧杯移动 溶液时,盐桥中的阳离子向左侧烧杯移动 |
D.反应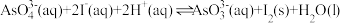 的 的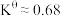 |
您最近一年使用:0次
2022-05-31更新
|
1229次组卷
|
4卷引用:山东省日照市2022届高三校际联考(三模)化学试题
山东省日照市2022届高三校际联考(三模)化学试题(已下线)第18讲 原电池 化学电源(练)-2023年高考化学一轮复习讲练测(全国通用)安徽省六安第一中学2022-2023学年高三上学期第四次月考化学试题(已下线)专题8 新概念应用
解题方法
3 . 电极电势的测定常用甘汞电极作为参比电极(部分数据如下)。
测定过程中,待测电极与甘汞电极组成原电池其工作原理如图。下列说法正确的是
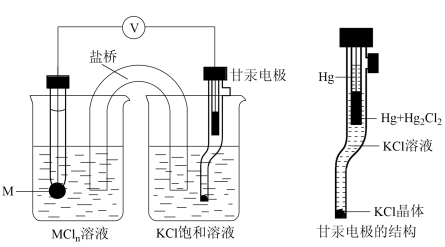
| 电极种类 | Na+/Na | Zn2+/Zn | H+/H2 | 甘汞电极 | Cu2+/Cu |
| 电极电势/V | -2.71 | -0.76 | 0.00 | 0.24 | 0.34 |

| A.盐桥中Cl-向甘汞电极移动 |
| B.若M为Cu,则电极反应式是:Cu-2e-=Cu2+ |
| C.甘汞电极电极反应式是:2Hg+2C1--2e-=Hg2Cl2 |
| D.测定过程中,甘汞电极内部KCl晶体可能增多 |
您最近一年使用:0次
2022-04-01更新
|
953次组卷
|
3卷引用:山东省潍坊市2021-2022学年高三下学期高中学科核心素养测评化学试题
山东省潍坊市2021-2022学年高三下学期高中学科核心素养测评化学试题(已下线)回归教材重难点03 电化学-【查漏补缺】2022年高考化学三轮冲刺过关(全国通用)河北省承德市部分高中2023-2024学年高三上学期12月期中考试化学试题
4 . 化学电源在日常生活和高科技领域中都有广泛应用。下列说法错误的是
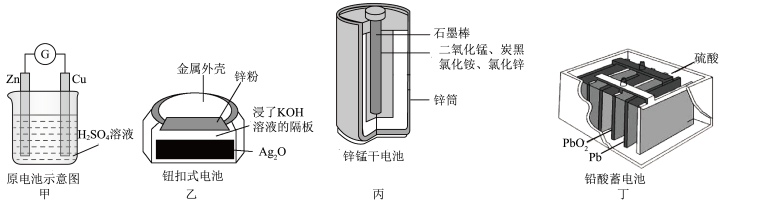

A.甲: 电极附近溶液中 电极附近溶液中 浓度减小 浓度减小 |
B.乙:正极的电极反应式为 |
| C.丙:锌筒作负极,发生氧化反应,锌筒会变薄 |
| D.丁:放电时负极板的质量减小 |
您最近一年使用:0次
5 . 某实验小组对FeCl3分别与Na2SO3、NaHSO3的反应进行探究。
【甲同学的实验】
(1)怎样配制FeCl3溶液? ________________________________________________________ 。
(2)甲同学探究实验I的电极产物。
① 取少量Na2SO3溶液电极附近的混合液,加入_________________________________ ,产生白色沉淀,证明产生了SO42-。
② 该同学又设计实验探究另一电极的产物,其实验方案为_______________________________ 。
(3)实验I中负极的电极反应式为______________________________________________________ 。
乙同学进一步探究FeCl3溶液与NaHSO3溶液能否发生反应,设计、完成实验并记录如下:
(4)乙同学认为刺激性气味气体的产生原因有两种可能,用离子方程式表示②的可能原因。
① Fe3++3HSO3- Fe(OH)3 +3SO2;②
Fe(OH)3 +3SO2;②_____________________________________________ 。
(5)查阅资料:溶液中Fe3+、SO32-、OH-三种微粒会形成红色配合物并存在如下转化:

从反应速率和化学平衡两个角度解释1~30 min的实验现象:______________________________ 。
【实验反思】
(6)分别对比I和II、II和III,FeCl3能否与Na2SO3或NaHSO3发生氧化还原反应和______________________ 有关(写出两条)。
【甲同学的实验】
| 装置 | 编号 | 试剂X | 实验现象 |
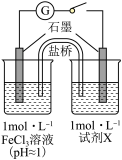 | I | Na2SO3溶液(pH≈9) | 闭合开关后灵敏电流计指针发生偏转 |
| II | NaHSO3溶液(pH≈5) | 闭合开关后灵敏电流计指针未发生偏转 |
(2)甲同学探究实验I的电极产物。
① 取少量Na2SO3溶液电极附近的混合液,加入
② 该同学又设计实验探究另一电极的产物,其实验方案为
(3)实验I中负极的电极反应式为
乙同学进一步探究FeCl3溶液与NaHSO3溶液能否发生反应,设计、完成实验并记录如下:
| 装置 | 编号 | 反应时间 | 实验现象 |
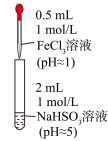 | III | 0~1 min | 产生红色沉淀,有刺激性气味气体逸出 |
| 1~30 min | 沉淀迅速溶解形成红色溶液,随后溶液逐渐变为橙色,之后几乎无色 | ||
| 30 min后 | 与空气接触部分的上层溶液又变为浅红色,随后逐渐变为浅橙色 |
① Fe3++3HSO3-
 Fe(OH)3 +3SO2;②
Fe(OH)3 +3SO2;②(5)查阅资料:溶液中Fe3+、SO32-、OH-三种微粒会形成红色配合物并存在如下转化:

从反应速率和化学平衡两个角度解释1~30 min的实验现象:
【实验反思】
(6)分别对比I和II、II和III,FeCl3能否与Na2SO3或NaHSO3发生氧化还原反应和
您最近一年使用:0次
2020-03-28更新
|
367次组卷
|
2卷引用:山东潍坊市高密一中2020届高三3月份高考模拟化学试题
6 . “低碳经济”已成为全世界科学家研究的重要课题。为减小和消除CO2对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对CO2创新利用的研究。
(1)已知:①CO(g)+H2O(g) H2(g)+CO2(g) ΔH=-41 kJ·mol-1
H2(g)+CO2(g) ΔH=-41 kJ·mol-1
②C(s)+2H2(g) CH4(g) ΔH=-73 kJ·mol-1
CH4(g) ΔH=-73 kJ·mol-1
③2CO(g) C(s)+CO2(g) ΔH=-171 kJ·mol-1
C(s)+CO2(g) ΔH=-171 kJ·mol-1
写出CO2与H2反应生成CH4和H2O(g)的热化学方程式:____
(2)目前工业上有一种方法是用CO2来生产燃料甲醇。为探究该反应原理,在容积为2 L密闭容器中,充入1 mol CO2和3.25 mol H2在一定条件下发生反应,测得CO2、CH3OH(g)和H2O(g)的物质的量(n)随时间的变化如图所示:
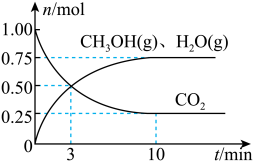
①从反应开始到平衡,氢气的平均反应速率v(H2)=________ 。
②下列措施一定不能使CO2的平衡转化率增大的是________ 。
A 在原容器中再充入1 mol CO2
B 在原容器中再充入1 mol H2
C 在原容器中充入1 mol氦气
D 使用更有效的催化剂
E 缩小容器的容积
F 将水蒸气从体系中分离
(3)煤化工通常研究不同条件下CO转化率以解决实际问题。已知在催化剂存在条件下反应:CO(g)+H2O(g) H2(g)+CO2(g)中CO的平衡转化率随p(H2O)/p(CO)及温度变化关系如图所示:
H2(g)+CO2(g)中CO的平衡转化率随p(H2O)/p(CO)及温度变化关系如图所示:
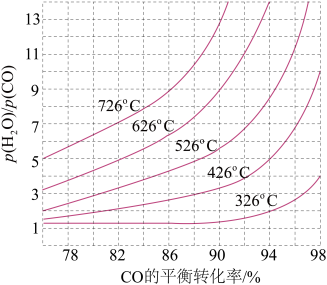
①上述反应的正反应方向是________ 反应(填“吸热”或“放热”);
②对于气相反应,用某组分(B)的平衡压强(pB)代替物质的量浓度(cB)也可以表示平衡常数(记作Kp),则该反应的Kp=_____ (填表达式,不必代数计算);如果提高p(H2O)/p(CO),则Kp_______ (填“变大”“变小”或“不变”)。使用铁镁催化剂的实际工业流程中,一般采用400 ℃左右、p(H2O)/p(CO)=3~5,采用此条件的原因可能是_______
(4)科学家用氮化镓材料与铜组装成如图所示的人工光合系统,利用该装置实现了用CO2和H2O合成CH4。下列关于该电池的叙述错误的是________ 。
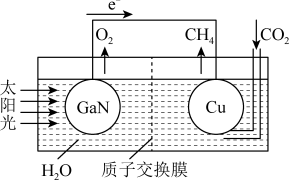
A.该装置能量转化形式仅存在将太阳能转化为电能
B.铜电极为正极,电极反应式为CO2+8e-+8H+===CH4+2H2O
C.电池内部H+透过质子交换膜从左向右移动
(1)已知:①CO(g)+H2O(g)
 H2(g)+CO2(g) ΔH=-41 kJ·mol-1
H2(g)+CO2(g) ΔH=-41 kJ·mol-1②C(s)+2H2(g)
 CH4(g) ΔH=-73 kJ·mol-1
CH4(g) ΔH=-73 kJ·mol-1③2CO(g)
 C(s)+CO2(g) ΔH=-171 kJ·mol-1
C(s)+CO2(g) ΔH=-171 kJ·mol-1写出CO2与H2反应生成CH4和H2O(g)的热化学方程式:
(2)目前工业上有一种方法是用CO2来生产燃料甲醇。为探究该反应原理,在容积为2 L密闭容器中,充入1 mol CO2和3.25 mol H2在一定条件下发生反应,测得CO2、CH3OH(g)和H2O(g)的物质的量(n)随时间的变化如图所示:

①从反应开始到平衡,氢气的平均反应速率v(H2)=
②下列措施一定不能使CO2的平衡转化率增大的是
A 在原容器中再充入1 mol CO2
B 在原容器中再充入1 mol H2
C 在原容器中充入1 mol氦气
D 使用更有效的催化剂
E 缩小容器的容积
F 将水蒸气从体系中分离
(3)煤化工通常研究不同条件下CO转化率以解决实际问题。已知在催化剂存在条件下反应:CO(g)+H2O(g)
 H2(g)+CO2(g)中CO的平衡转化率随p(H2O)/p(CO)及温度变化关系如图所示:
H2(g)+CO2(g)中CO的平衡转化率随p(H2O)/p(CO)及温度变化关系如图所示:
①上述反应的正反应方向是
②对于气相反应,用某组分(B)的平衡压强(pB)代替物质的量浓度(cB)也可以表示平衡常数(记作Kp),则该反应的Kp=
(4)科学家用氮化镓材料与铜组装成如图所示的人工光合系统,利用该装置实现了用CO2和H2O合成CH4。下列关于该电池的叙述错误的是

A.该装置能量转化形式仅存在将太阳能转化为电能
B.铜电极为正极,电极反应式为CO2+8e-+8H+===CH4+2H2O
C.电池内部H+透过质子交换膜从左向右移动
您最近一年使用:0次
2019-06-18更新
|
1201次组卷
|
4卷引用:山东省济南二中2020届高三线上检测化学试题
山东省济南二中2020届高三线上检测化学试题【市级联考】辽宁省兴城市2019届高三第九次模拟考试理科综合化学试题四川省泸州市泸县第二中学2020届高三上学期期中考试理综化学试题(已下线)专题15 化学反应原理大题不丢分-2021年高考化学必做热点专题



